
- •Альтернативный путь
- •[Править]Лектиновый (маннозный) путь активации системы комплемента
- •Биологические функции
- •Рецепторы естественных киллеров
- •Механизм действия
- •30.Суперантигены
- •31 Антигены организма человека
- •История изучения
- •Строение антител
- •[Править]Классификация по тяжелым цепям
- •[Править]Функции антител
- •История открытия
- •]Классификация
- •Механизм действия
- •Возможные причины
- •[Править]Механизм развития
- •[Править]Эволюция
История открытия
В 1957 г. сотрудники Лондонского национального института вирусологи англичанин А. Айзек и швейцарец Дж. Линдеман случайно во время опытов открыли интерферон. Исследователи столкнулись с непонятным явлением: мыши, которых заражали определенными вирусами, не заболевали. Поиски причин этого явления показали, что мыши, не поддавшиеся заражению вирусами, в момент заражения уже болели другой вирусной инфекцией. Таким образом выяснилось, что в организме мышей один из вирусов препятствует размножению другого. Это явление антагонизма вирусов назвали интерференцией (помеха, препятствие, англ.), данное явление встречается при введении в организм двух вирусов одновременно или с интервалом не более 24 часов.
]Классификация
Интерфероны человека подразделяют на группы в зависимости от типа клеток, в которых они образуются: α, β и γ. α-Интерфероны включают несколько видов белков с молекулярной массой около 20 кДа .
Механизм действия
Наиболее изученным свойством интерферона является его способность препятствовать размножению вирусов. Он образуется в клетках млекопитающих и птиц в ответ на вирусную инфекцию.
|
При заражении клетки вирус начинает размножаться. Клетка-хозяин одновременно с этим начинает продукцию интерферона, который выходит из клетки и вступает в контакт с соседними клетками. Хотя интерферон не обладает прямым противовирусным действием, он способен вызывать такие изменения в клетках, которые препятствуют размножению вируса, формированию вирусных частиц и дальнейшему его распространению. Интерферон действует в нескольких направлениях. Во-первых, он оказывает влияние на клетки, соседние с инфицированной, запуская в них цепь событий, приводящих к подавлению синтеза вирусныхбелков и в некоторых случаях сборки и выхода вирусных частиц (путём активации олигоаденилатциклазы). В ответ на воздействие интерферона клетки вырабатывают большое количество протеинкиназы R. Этот ферментфосфорилируетфактор инициации трансляции eIF-2, фосфорилированный eIF-2 формирует неактивный комплекс с другим фактором, eIF-2B. В результате уровень белкового синтеза в клетке снижается. После протеинкиназы R активируется синтез рибонуклеазы L, которая расщепляет клеточные РНК и ещё больше снижает уровень белкового синтеза. В целом, интерферон-зависимое подавление трансляции является губительным как для вируса, так и для клетки-хозяина. Помимо влияния на трансляцию, интерфероны способны активировать сотни других генов (они известны как гены, стимулируемые интерфероном), играющих роль в защите клетки от вирусов[2][3]. Кроме того, интерферон лимитирует распространение вирусных частиц путём активации белка p53, что ведёт к апоптотической смерти инфицированной клетки[4][5].
Вторым направлением действия интерферонов является стимуляция иммунной системы для борьбы с вирусами. Интерферон повышает синтез молекул главного комплекса гистосовместимости I и II классов и активирует иммунопротеасому. Высокий уровень молекул главного комплекса гистосовместимости I класса обеспечивает эффективную презентацию вирусных пептидов цитотоксическим Т-лимфоцитам и натуральным киллерам, а иммунопротеасома осуществляет процессинг вирусных пептидов, предшествующий презентации. Высокий уровень молекул главного комплекса гистосовместимости II класса обеспечивает презентацию вирусных антигенов Т-хелперам. Т-хелперы, в свою очередь, выделяют цитокины, которые координируют активность других клеток иммунной системы. Некоторые виды интерферонов, например интерферон-γ, могут прямо стимулировать клетки иммунной системы, такие как макрофаги и натуральные киллеры.
Образование интерферона могут стимулировать не только интактные вирусы, но и различные другие агенты, например некоторые инактивированные вирусы, двухцепочечные РНК, синтетические двухцепочечные олигонуклеотиды и бактериальные эндотоксины.
Биологическая активность интерферона очень высока. У мышиного интерферона она составляет 2·109 ед./мг., а одна единица снижает образование вирусов примерно на 50 %. Это означает, что достаточно одной молекулы интерферона, чтобы сделать клетку резистентной к вируснойинфекции. Показано, что молекулы интерферона должны оказывать действие на клетку в течение минимум четырех часов, для того, чтобы в клетке начались процессы борьбы с вирусом, таким образом, многие специалисты не считают эффективным интраназальное применение интерферона для профилактики ОРВИ[6]. Тем не менее, последние исследования показывают, что интерферон, примененный на слизистую оболочку, может действовать в качестве иммунологического адъюванта против вируса гриппа, усиливая специфический ответ иммунной системы.[7]. В США проводятся клинические испытания вакцины против гриппа, которая использует интерферон в качестве адъюванта[8].
Интерферон вызывает и целый ряд других биологических эффектов, в том числе подавляет размножение клеток. Недавние исследования показали, что в определённых условиях он может препятствовать развитию злокачественных новообразований. Установлено также, что интерферон действует на иммунную систему и вызывает изменение клеточных мембран. Таким образом, интерфероновая система, вероятно, может играть важную роль в защите организма от вирусов.
48 Факторы некроза опухоли являются многофункциональными цитокинами. Они обладают цитотоксическими, провоспалительными и иммунорегуляторными свойствами. Вырабатываются, главным образом, моноцитарно-макрофагальными клетками, Т-лимфоцитами, тучными клетками.
Существует два структурно сходных цитокина: ФНОα и ФНОβ (лимфотоксин α). На клетках для них существует общий рецептор, относящийся к суперсемейству ФНО-рецепторов.
ФНОα синтезируется преимущественно моноцитарно-макрофагальными и тучными клетками. Благодаря способности этого белка вызывать быструю некротическую регрессию некоторых опухолей, он получил название фактора некроза опухоли. Основным индуктором его выработки являются грамотрицательные бактерии, компонент их клеточной стенки ЛПС. ЛПС в низких концентрациях стимулирует функцию фагоцитов, является митогеном В-лимфоцитов. Секреция ФНОα усиливается под влиянием ИНФ-гамма, продуцируемого Тн-клетками. Секреторная форма ФНОα продуцируется во внеклеточную среду в виде гомотримера (51кД). При связывании его специфическими рецепторами клеток может наблюдаться их гибель через механизм апоптоза или некроз. ФНОα способен также стимулировать активность лейкоцитов, участвующих в воспалении, повышать экспрессию молекул адгезии на эндотелиальных клетках сосудов, что способствует повышенному прилипанию нейтрофилов, моноцитов и лимфоцитов к поверхности этих клеток, стимулирует продукцию цитокинов – ИЛ-1, ИЛ-6, усиливает экспрессию молекул ГКГ на клетках, инфицированных внутриклеточными паразитами, что способствует развитию более эффективного клеточного иммунитета и цитолиза пораженных клеток. При высоких концентрациях ФНОα в крови он оказывает действие на гипоталамус как эндогенный пироген, вызывая лихорадку. Под его влиянием клетками гипоталамуса усиливается синтез простагландинов. Аспирин способен подавлять этот эффект ФНОα и ИЛ-1.
ФНОα вместе с ИЛ-1β участвует в регуляции стадий сна.
ФНОα увеличивает синтез некоторых сывороточных белков в печени, активирует систему свертывания крови, способен подавлять деление стволовых клеток костного мозга.
При системном введении ФНО у животных развиваются метаболические расстройства, проявляющиеся кахексией. ФНО супрессирует синтез липопротеинлипазы, необходимой для образования жирных кислот из циркулирующих липопротеинов так, чтобы они могли быть утилизированы в тканях.
ФНОβ, главным образом, продуцируется активированными Тн1-клетками и цитотоксическими Т-лимфоцитами. Этот цитокин вызывает цитолиз опухолевых клеток и клеток-мишеней в клеточном иммунитете. При воздействии на макрофаги и нейтрофилы активирует их функциональную активность.
49. • Началом процесса служит проникновение Аг во внутреннюю среду организма. В природе это происходит при травмировании покровных тканей. При этом в них выделяются определённые вещества (стресс-протеины, белки теплового шока, цитокины кератиноцитов и клеток соединительной ткани) — медиаторы доиммунного воспаления, которые и «готовят почву» для развития лимфоцитарного иммунного воспаления (если это потребуется). Попадание Аг без значимой травмы покровов сразу во внутреннюю среду — событие редкое. Чаще это происходит при искусственных вмешательствах: парентеральном введении веществ или трансплантации тканей и органов. • Доиммунные защитные реакции в отношении Аг направлены на то, чтобы не пустить Аг глубже покровов. В первую очередь это сосудистые реакции: расширение сосудов микроциркуляторного русла, повышенный выпот из сосудов в ткани плазмы или сыворотки (соответственно всех сывороточных факторов доиммунной резистентности к инфекциям) и экстравазация лейкоцитов (в первую очередь — фагоцитов-нейтрофилов. Локальный отёк препятствует всасыванию Аг в системную циркуляцию. ♦ Проникший в покровы патоген сорбируют и поглощают эндоцитозом ДК, фагоцитируют макрофаги. И те, и другие — профессиональные АПК, но только ДК обладают особыми способностями — мигрируют из покровов (вместе с Аг) в региональные лимфоидные органы. «По дороге» ДК процессируют Аг, экспрессируют на мембране комплексы пептидов с молекулами MHC-I и MHC-II и необходимые корецепторные молекулы, с помощью которых они смогут вступить в эффективное воздействие с Т-лимфоцитами в Т-зависимых зонах периферических лимфоидных органов. ♦ Кроме АПК, в покровных тканях Аг встречают внутриэпителиальные лимфоциты, среди которых много Туб, распознающих непептидные Аг без предварительного процессинга и презентации АПК. Под покровами, в плевральной и брюшной полостях, для перехвата широко распространённых микробных Аг присутствуют AT с широкой перекрёстной реактивностью — продукты B1-лимфоцитов. ♦ Не «перехваченный» в барьерных тканях и всосавшийся в системную циркуляцию Аг, если он опасен для организма, сразу начнёт приносить вред. Тем не менее иммунный ответ на него ещё может развиться, поскольку АПК (ДК и макрофаги) присутствуют и в синусоидах селезёнки, через которую за цикл циркуляции проходит весь объём крови. • В Т-зависимых зонах лимфатических узлов ДК представляют Аг (в комплексе с MHC-II) для «рассмотрения» интенсивно мигрирующим Т-лимфоцитам. Среди Т-лимфоцитов рано или поздно найдётся клетка с Рц, комплементарным данному Аг. Если при этом состоятся все необходимые и достаточные корецепторные взаимодействия с АПК, то Т-лимфоцит получит активационный сигнал, и с этого момента начнётся собственно иммунный — лимфоцитарный — ответ. ♦ Двойное распознавание — процесс распознавания Т-хелпером фрагментов пептидного Аг, в комплексе с MHC-II или цитотоксическим Т-лимфоцитом любых клеток, экспрессирующих MHC-I. При этом Т-лимфоциты инициируют иммунный ответ против распознанного антигена, представленного АПК в комплексе со «своими» молекулами MHC-II или против клеток собственного организма, несущих вирусные или свои, но изменённые пептиды в комплексе с MHC-I. • Распознавший Аг Т-лимфоцит начинает пролиферировать и дифференцироваться. В результате образуется клон антигенспецифичных дифференцированных Т-лимфоцитов. Такие Т-лимфоциты называют иммунными лимфоцитами, лимфоцитами-эффекторами. В процессе дифференцировки Т-лимфоцит экспрессирует в надлежащем количестве мембранные молекулы и секретирует цитокины, необходимые для взаимодействия с В-лимфоцитами, лейкоцитами или для атаки на клетки-мишени. • В Т-зависимых зонах периферических лимфоидных органов происходит взаимодействие активированных Аг Т-лимфоцитов с активированными Аг В-лимфоцитами. • Провзаимодействовавший с Аг и с Т-лимфоцитами В-лимфоцит мигрирует в зону фолликула, где пролиферирует и дифференцируется в антителопродуцента — плазматическую клетку. ♦ Первые плазматические клетки остаются в лимфатическом узле. Секретируемые ими AT в значительном количестве фиксируются на Рц для Fc-фрагмента AT (FcR) фолликулярных дендритных клеток (ФДК) и в таком виде способны в течение продолжительного времени удерживать Аг на территории лимфоидного фолликула. ♦ Остальные плазматические клетки уходят из фолликулов лимфоидных органов и мигрируют преимущественно в костный мозг или слизистые оболочки, где и осуществляют массовую продукцию AT, секретируя их в кровь или во внешнюю среду. • Иммунные Т-лимфоциты (ЦТЛ, Thl, Th2) выходят из региональных лимфатических узлов через эфферентные лимфатические сосуды, попадают в системную циркуляцию, а оттуда — в очаг воспаления в месте проникновения или диссеминации патогена. • Если Т-лимфоцит в очаге воспаления находит и связывает свой Аг, то он начинает усиленно синтезировать и секретировать эффекторные молекулы — цитотоксины, непосредственно обеспечивающие убийство клеток-мишеней, или цитокины, «нанимающие» для деструкции Аг те или иные лейкоциты (макрофаги, эозинофилы, тучные клетки, базофилы, нейтрофилы). • В эффекторной фазе иммунного ответа связанный Аг подвергается фагоцитозу и разрушению гидролитическими ферментами, кислородными радикалами, радикалами оксида азота до мелких метаболитов, которые экскретируются из организма через системы выделения (почки, ЖКТ). • Организм санирован от патогена/Аг — первый результат достигнут. После этого в норме происходит остановка продуктивного иммунного ответа — так называемая супрессия иммунного ответа. • Второй результат лимфоцитарной иммунной реакции — иммунологическая память. По современным представлениям, лимфоцитами иммунологической памяти становится некая часть иммунных лимфоцитов (вероятно, порядка единиц процентов), экспрессирующих особые ингибирующие активацию молекулярные структуры.
50.
52. Феномен иммунологической памяти проявляется в том, что — в случае успешного иммунного ответа при первом попадании патогена в организм — при его повторных попаданиях санация наступает существенно быстрее и эффективнее, и патоген не успевает вызвать патологический инфекционный процесс. Это состояние известно как протективный иммунитет, т.е. иммунитет, защищающий от болезни. В основе феномена иммунологической памяти находится то обстоятельство, что часть лимфоцитов (единицы процентов) Аг-специфичного клона, пролиферировавшего при первом иммунном ответе, «замораживается» и персистирует в организме в течение неопределённого времени (для различных Аг время очень разное — от нуля до пожизненного). Какие именно молекулы и взаимодействия и на каком точно этапе иммуногенеза определяют формирование популяции лимфоцитов памяти, неизвестно. Известна только феноменология отличий разных лимфоцитов памяти от других субпопуляций тех же лимфоцитов. • В-лимфоциты. «Иммунные В-лимфоциты памяти» отличаются от плазматических клеток (терминальная стадия дифференцировки иммунных В-лимфоцитов) по ряду признаков. ♦ Покоящиеся иммунные В-лимфоциты памяти имеют поверхностные Ig, экспрессируют молекулы MHC-II, способны к пролиферации, переключению между изотипами Ig, гипермутациям гипервариабельных участков молекулы Ig — CDR V-Ig, но не способны к интенсивной продукции Ig. ♦ Плазматические клетки, напротив, способны к интенсивной продукции Ig, но не имеют поверхностных Ig, не экспрессируют молекулы MHC-II, не способны к пролиферации, переключению между изотипами Ig, гипермутациям CDR V-Ig. • Т-лимфоциты памяти отличаются от зрелых неиммунных Т-лимфоцитов и по частоте встречаемости антигенспецифичного клона в лимфоидной ткани, и по экспрессии ряда мембранных молекул [LFA-3 (CD58); CD2; LFA-1 (CDlla/CD18); CD44; CD45RO] более чем в 10—100 раз. В отличие от неиммунных лимфоцитов, они существенно меньше нуждаются в медиаторах доиммунного воспаления и в костимулирующих сигналах, чтобы начать иммунный ответ на свой Аг, но могут начать его вне воспаления или при минимальных симптомах воспаления. В то же время, неиммунные Т-клетки (в отличие от Т-лимфоцитов памяти) экспрессируют на поверхности CD45RA и большие количества молекул L-селектина, обеспечивающие хоминг Т-лимфоцитов в лимфатические узлы.
53. Все варианты иммунного ответа регулируемы. Это означает, что величина (и качество) любого варианта иммунного ответа отражает существующий баланс влияний, направленных на его расширение, и других механизмов, направленных на снижение его активности. Актуальность этого вопроса связана с тем, что большое количество иммунологических нарушений, в частности, аутоиммунные болезни и аллергия имеют дизрегуляторный характер. Некоторые формы регуляции заложены генетически и опосредуются продуктами ГКГС. На состоянии иммунорегуляторных механизмов отражаются возрастные, половые, конституциональные различия, характер питания индивида и прочие факторы. Большое значение имеют доза и путь попадания антигена, его физическое состояние, его способность длительно персистировать внутри клеток или, напротив, отсутствие у него такой возможности. Эти различия, особенно последнее, могут определять, будет ли иммунный ответ, в основном, опосредован антителами, или в нем будут играть главенствующую роль клеточные механизмы. Один и тот же антиген, инъецированный внутрь АПК или находящийся в окружающей клетку среде [411] попадает в разные компартменты АПК, по разному процессируется и представляется в контексте различных гликопротеидов ГКГС, что ведёт к преобладанию разных форм иммуногенеза (см. также выше — раздел «Цитокины и белки ГКГС — факторы коммуникации иммунной системы.») Все эти обстоятельства могут также оказывать влияние на классовый спектр Ig, авидность антител, их титр и продолжительность иммунного ответа — в каждом конкретном случае... Все варианты иммунного ответа регулируемы. Это означает, что величина (и качество) любого варианта иммунного ответа отражает существующий баланс влияний, направленных на его расширение, и других механизмов, направленных на снижение его активности. Актуальность этого вопроса связана с тем, что большое количество иммунологических нарушений, в частности, аутоиммунные болезни и аллергия имеют дизрегуляторный характер. Некоторые формы регуляции заложены генетически и опосредуются продуктами ГКГС. На состоянии иммунорегуляторных механизмов отражаются возрастные, половые, конституциональные различия, характер питания индивида и прочие факторы. Большое значение имеют доза и путь попадания антигена, его физическое состояние, его способность длительно персистировать внутри клеток или, напротив, отсутствие у него такой возможности. Эти различия, особенно последнее, могут определять, будет ли иммунный ответ, в основном, опосредован антителами, или в нем будут играть главенствующую роль клеточные механизмы. Один и тот же антиген, инъецированный внутрь АПК или находящийся в окружающей клетку среде [411] попадает в разные компартменты АПК, по разному процессируется и представляется в контексте различных гликопротеидов ГКГС, что ведёт к преобладанию разных форм иммуногенеза (см. также выше — раздел «Цитокины и белки ГКГС — факторы коммуникации иммунной системы.») Все эти обстоятельства могут также оказывать влияние на классовый спектр Ig, авидность антител, их титр и продолжительность иммунного ответа — в каждом конкретном случае. Агентами регуляции иммунного ответа выступают антигены, антитела и цитокины. Наиболее плодотворным подходом в области изучения механизмов регуляции иммунного ответа оказалась сетевая теория Н. Ерне (1974). Иммунный ответ подвержен аутоиммунной саморегуляции. Ерне сформулировал сетевую теорию для объяснения данного феномена. Согласно этой теории, каждый антигенный рецептор (идиотип), как на Т-, так и на В-клетках, способен стимулировать продукцию комплементарных антиидиотипических антител, которые, в основном, снижают продукцию первичных идиотипов. Практически, система антиидиотипических антител впервые была экспериментально получена в СССР Л. Н. Певницким, А. И. Фонталиным и Г. Н. Крыжановским (1960), на модели столбнячного токсина и антитоксина, а чуть позже — во Франции — Ж. Удэном (1966). Например, антиген X (рис. 91) провоцирует продукцию. анти-Х, и оба, анти-Х и В-клетки, производившие анти-Х, несут идиотип анти-Х. Это, в свою очередь, стимулирует другой клон В-клеток к продукции антител к идиотипу анти-Х, т. е. анти-анти-Х. Последние антиидиотипические антитела могут иметь структурное сходство с первоначальным антигеном X (так как оба должны иметь сродство к анти-X), хотя это и не обязательно, а наступает лишь при совпадении идиотипа и паратопа анти-Х. Антиидиотип анти-анти-Х, воспроизводя пространственную структуру и связывающие способности лиганда X, создает его «внутренний иммунологический образ» (Ж. Линдеманн, 1979). Антиидиотипические антитела являются частным случаем антирецепторных антител, большего класса, включающего, например, антитела к инсулиновым рецепторам или к рецепторам тиротропного гормона. В случае антиидиотипических антител к гормону, антигеном служит рецептор; Доказаны регуляторные эффекты таких антител в экспериментах in vitro и in vivo, а также в клинике при ряде аутоиммунных дизрегуляторных заболеваний. Существуют данные, показывающие что в сеть идиотип-антиидиотипических взаимодействий при патологии и в норме вовлечены не только распознающие молекулы иммунной системы, но рецепторы и биорегуляторы соматических клеток организма, а также распознающие элементы хроматина (В. Г. Нестеренко 1984; А. Я. Кульберг 1986; А. Ш. Зайчик и соавт. 1988). Сеть не бесконечна, а замкнута на себя, ибо антиидиотипы изоморфны или даже идентичны по пространственной структуре антигену, а гипотетические «анти-анти-антитела» аналогичны антителам 1-го порядка (К. Раевски, А. Такемори, 1982). [412] Согласно теории иммунологической сети, иммунная система способна по идиотип- антиидиотипическому принципу вырабатывать функционально активные информационные копии многих эндогенных и экзогенных биорегуляторов, причем, не только белковых (Э. М. Смит, Дж. Э. Блэлок 1986; Й. Шехтер 1988, А. Стросбер и соавт. ; 1983; А. Ш. Зайчик и соавт. 1988). Подобные копии участвуют в нормальной регуляции роста и функций клеток, но способны и вызвать нарушения клеточной пролиферации и деятельности при аутоиммунных заболеваниях. По современным данным ауторегуляторные идиотип-антиидиотипические взаимоотношения базируются не только на иммуноглобулиновых рецепторах В-лимфоцитов и антителах, но и на иных взаимно комплементарных структурах, например, идиотипических и антиидиотипических Т-клеточных рецепторах (Г. Голтон, М. Грин 1988). Гомеостатическая регуляция разнообразия иммуноглобулинов также предусматривает механизмы антиидиотипических воздействий. В наследуемых V-гeнах постоянно происходят соматические мутации, а, следовательно, должны возникать и аутореактивные клоны. Аутоантиидиотипические взаимодействия приводят к необратимому супрессированию мутантных идиотипов и к ограниченному во времени подавлению наследуемых, так как процесс дифференцировки будет способствовать восстановлению неизмененных идиотипов (А. Я. Кульберг 1986). С точки зрения сетевой теории, иммунная система выступает, как создатель иммунологических образов антигенов, переданных структурой антиидиотипов. Эти иммунологические образы могут сохраняться вместе с вырабатывающими их клонами и поддерживать иммунный ответ в отсутствие антигена. Более того, если антигеном служит гормон или лекарство, то атрибутивное свойство иммунной системы создавать аутоантиидиотипы превращается в способность вырабатывать, при определённых условиях, иммунологический аналог любого сигнала и эндогенный образ любого лекарства! Выше уже приводились примеры, доказывающие принципиальную реальность этих интригующих соображений. Древняя идея панацеи реализована эволюцией в виде иммунной системы, позволяющей копировать сигналы и антисигналы в виде циркулирующих и поверхностных молекул. Один из наиболее поразительных экспериментов, доказывающих это — получение Ц. Елазаром и соавторами моноклональных антиидиотипических иммуноглобулинов против антител к галоперидолу, имитирующих действие этого лекарства на дофаминовый D2- рецептор (1988)
54. Трансплантационный иммунитет — состояние повышенной иммунной реактивности организма, возникающее в ответ на пересадку органа или ткани, взятых от другой, генетически отличающейся особи. Реакции трансплантационною иммунитета тем сильнее, чем больше выражены генетические различия между донором и реципиентом. Развитие Т. и. приводит к гибели пересаженной ткани. Состояние иммунитета при аллотрансплантации развивается в основном по типу гиперчувствительности замедленного типа. Повышенная чувствительность к пересаженной ткани возникает примерно через 1—2 нед. после трансплантации и сохраняется в течение от 1 мес. до нескольких лет. На протяжении этого периода повторная трансплантация сопровождается отторжением пересаженной ткани в более короткий срок. Сенсибилизация обусловлена в первую очередь реакцией регионарных к трансплантату лимфатических узлов, через которые происходит отток лимфы от пересаженной ткани: далее включаются другие участки лимфоидной ткани хозяина. Иммунитет при аллотрансплантациях не обладает органной специфичностью, реакция имеет индивидуально специфический характер. Она направлена как против той ткани, которая пересаживалась, так и против других тканей того же донора. Основным клеточным компонентом при этом является Т-популяция стимулированных лимфоцитов, хотя гуморальные факторы реципиента также принимают участие в формировании трансплантационного иммунитета. В период реакции тканевой несовместимости установлено появление в крови реципиента антител, оказывающих комплементзависимое цитотоксическое, а также агглютинирующее действие на клетки донорской антигенной принадлежности. Антитела обнаружены также в трансплантате во время его гибели. При аллотрансплантации почек отмечено быстрое отторжение пересаженного органа из-за воздействия на него - и -антител в высоком титре. Полной ясности в механизме отторжения трансплантатов еще нет. Полагают, что генетически чужеродный трансплантат отторгается в результате инфильтрации пересаженной ткани лимфоцитами — Т-киллерами,
которые оказывают разрушающее действие на клетки-мишени, выделяя биологически активное вещество — лимфотоксин. Разрушение лимфоцитами усиливается при воздействии иммунных антител (антителозависимый цитолиз).
В результате клеточной инфильтрации местно (в области трансплантата) достигается высокая концентрация иммунологических эффекторов, приводящая к его гибели. Иммунологическая реакция при пересадке аллогенных клеток может иметь прямо противоположную форму и исходить со стороны иммунокомпетентных клеток пересаженной ткани против организма реципиента — реакция трансплантата против хозяина (РТПХ). Эта реакция наблюдается преимущественно при трансплантации костного мозга, когда иммунная реактивность реципиента понижена (гомологичная, «вторичная» болезнь), или при трансплантации иммунокомпетентных клеток в организм животного в период эмбрионального развития (рант-болезнь, или болезнь отставания),
когда иммунная реактивность организма еще не до конца сформирована. Одним из основных признаков развития рант-болезни является отставание в массе тела и росте животного — феномен карликовости.
Клинически РТПХ может протекать в двух фирмах. Для первой характерна гемолитическая анемия, при которой на эритроцитах обнаруживаются неполные аутогемагглютинины (положительная прямая проба Кумбса), наличие и крови антител, реагирующих с собственными лимфоцитами (аутолимфоцитотоксины). Кроме того, нередки дерматиты с гиперкератозом и гиперпигментацией, спленомегалия, поражения суставов. Для второй формы характерна аплазия как лимфоидной, так и миелоидной ткани. Первую форму РТПХ связывают с преобладанием в организме хозяина лимфоцитов преимущественно хелперного типа, а вторую — объясняют активацией Т-лимфоцитов супрессорного типа.
Реакции Т. и. к пересаженным тканям и РТПХ могут быть ослаблены путем подбора донора по антигенам гистосовместимости,
в результате облучения организма реципиента, применения адренокортикотропных гормонов, антиметаболитов, антилимфоцитарной сыворотки, ингибирующих различные стороны обменных процессов и оказывающих иммунодепрессивное действие.
Необходимым условием возникновения Т. и. и реакции трансплантат против хозяина являются различия между организмом больного и пересаженной тканью по антигенам гистосовместимости, которые представляют собой самую сложную систему среди известных генетических маркеров человека и контролируются генами, расположенными на хромосоме рядом или в тех же областях. Эти гены определяют силу иммунного ответа, продукцию антител и клеточные реакции. В первую очередь к антителам совместимости относится система HLA (Human leucocyte antigens), в которой насчитывают приблизительно 120 антигенов.
56. Толерантность иммунологическая
IТолера́нтность иммунологи́ческая (лат. tolerantia терпение, выносливость)
утрата или ослабление способности организма к иммунному ответу на данный антиген в результате предшествующего контакта с тем же антигеном. Была открыта в 1949—1953 гг. австралийскими учеными Бернетом и Феннером (F.М. Burnet, F.J. Fenner) и английскими исследователями Биллингхемом, Брентом и Медаваром (R.Е. Billingham, L. Brent, P.В. Medawar). За это открытие Бернету и Медавару в 1960 г. была присуждена Нобелевская премия.
При Т. и., в отличие от иммунодефицитных состояний, сохраняется способность к иммунным реакциям на другие антигены, а также способность к иным, не иммунным реакциям на данный антиген (например, чувствительность к токсическому действию некоторых антигенов) Т. и. может быть неполной, или расщепленной. Последним термином обозначают неспособность развития одной из форм иммунного ответа на данный антиген (чаще всего гиперчувствительности замедленного типа или формирования цитотоксических лимфоцитов) при сохранении других иммунных реакций (например, продукции антител).
Наиболее благоприятен для формирования Т. и. эмбриональный период, во время которого возникает толерантность к ряду аутоантигенов и к иным антигенам, проникающим в плод в первые два триместра беременности. Но при определенных условиях Т. и. может возникнуть и во взрослом организме. Этому процессу благоприятствуют неспецифические иммунодепрессивные воздействия (например, общее ионизирующее облучение, некоторые цитостатики, применяемые при пересадке органов и в онкологической практике), а также некоторые особенности самих антигенов и способов их введения. К таким особенностям относятся устойчивость антигена к разрушению ферментами и отсутствие адъювантных примесей, неспецифически активирующих иммунную систему. Внутривенное или интраперитонеальное введение антигена более благоприятно для возникновения Т. и., чем подкожная или внутримышечная иммунизация.
Т. и. может быть устранена различными способами: введением иммунных лимфоцитов, иммунизацией перекрестно реагирующими антигенами, неспецифической стимуляцией иммунной системы и др.
При формировании Т. и. временно или постоянно инактивируются лимфоциты, способные реагировать на данный антиген. Инактивация осуществляется либо непосредственно антигеном, либо другими лимфоцитами (Т-супрессорами, антиидиотипическими клетками) и их продуктами. Поскольку общий пул лимфоцитов в организме непрерывно обновляется, то Т. и. нуждается в постоянном поддержании антигеном. Наиболее подвержены инактивации Т-лимфоциты. В вилочковой железе уничтожаются незрелые Т-лимфоциты, имеющие рецепторы ко многим аутоантигенам и к другим антигенам, проникающим в этот орган. В костном мозге, селезенке и лимфатических узлах при возникновении Т. и. Т- и В-лимфоциты обычно не погибают, но временно или постоянно теряют способность реагировать на данный антиген.
Проблемы формирования, поддержания или, наоборот, прекращения Т. и. возникают во многих областях практической медицины. В трансплантологии, аллергологии, клинике аутоиммунных заболеваний одной из важных задач является формирование Т. и. к соответствующим трансплантационным антигенам, аллергенам и аутоантигенам (см. Аутоиммунные болезни, Иммунопатология, Трансплантация органов и тканей). Помимо различного рода неспецифических иммунодепрессивных воздействий с этой целью используют особые методы предобработки чужеродных трансплантатов, а также высокотолерогенные препараты некоторых аллергенов.
Перед онкологами стоит противоположная задача — устранить часто возникающую расщепленную Т. и. к опухолевым антигенам. Эту задачу пытаются решить с помощью различных иммунокорригирующих средств, введения иммунных лимфоцитов, иммунизации модифицированными опухолевыми клетками и Т.п. (см. Опухоли).
Т. и. к антигенам возбудителя может возникнуть при некоторых вертикально передающихся вирусных инфекциях (лимфоцитарный хориоменингит, вирусный гепатит В и др.), при некоторых формах туберкулеза, лепры и других хронических инфекциях. Эта толерантность обычно носит расщепленный характер и часто сопровождается неспецифической иммунодепрессией. Ее роль в инфекционной патологии неоднозначна: с одной стороны, она устраняет или облегчает иммунопатологический компонент инфекционного процесса, а с другой — ослабляет защитные силы организма и способствует длительному вирусоносительству. Поэтому суммарная оценка роли Т. и. в инфекционном процессе зависит от патогенеза последнего: обусловлен ли он непосредственным воздействием инфекционных агентов на чувствительные к ним ткани либо опосредован иммунопатологическими механизмами.
57. АЛЛЕРГЕН (аллергия + genos греч. рождение, происхождение) - вещество, вызывающее аллергию. Аллергенами могут быть самые различные соединения - от простых химических веществ (бром, йод) до самых сложных (белки, полисахариды, сочетания тех и других между собой). Одни из них попадают в организм извне (экзогенные), другие образуются в самом организме (эндогенные или аутоаллергены). Экзогенные аллергены могут быть неинфекционного происхождения (бытовая пыль, шерсть и пот(!) животных, лекарственные препараты, химические вещества, пыльца растений, животные и растительные пищевые продукты) и инфекционными (бактерии, микробы, вирусы, грибки и продукты их жизнедеятельности). Попадая в организм различными путями, экзогенные аллергены могут вызывать поражение различных органов и систем. Экзогенные аллергены делят на следующие группы: 1.Биологические аллергены - микробы, бактерии, вирусы, грибки, гельминты, сывороточные и вакцинные препараты. Развитие многих инфекционных заболеваний (бруцеллез, туберкулез, брюшной тиф и др.) сопровождается аллергией. Этот вид аллергии называют инфекционной, а группу заболеваний, вызванных микробами, грибками или вирусами, в механизме развития которых большую роль играет аллергия, обычно называют инфекционно-аллергическими болезнями. Нередко к их развитию приводят и те микробы и грибки, которые обычно находятся на коже, или в дыхательных путях, полости рта и кишечнике. Источниками аллергии являются также такие очаги инфекции в организме, как кариозные зубы, воспаление придаточных пазух носа, холециститы и другие воспалительные процессы. Сыворотки и вакцины, введенные в организм путем инъекций, могут явиться причиной такой аллергической реакции, как анафилаксия. Аллергия при гельминтозах развивается в связи с всасыванием продуктов распада и обмена гельминтов (глистов) - паразитических червей, возбудителей глистных заболеваний. 2. Лекарственные аллергены. Аллергическую реакцию может вызвать практически любой лекарственный препарат. Особенно часто аллергенами оказываются синтетические препараты, значительно реже - лекарственные препараты на основе природных компонентов. Так, аллергические осложнения при применении аспирина составляют 2%, сульфаниламидов 7%, пенициллина - до 16%. Нередки аллергические осложнения на новокаин, хлороформ, витамины группы В и многие другие препараты. Частота аллергических реакций во многом зависит от масштаба потребления конкретного препарата. Так, в период широкого применения сульфаниламидов (этазол, стрептоцид, сульфадимезин, сульфадиметоксин и др.) аллергические реакции на них отмечались чаще, чем в последнее время, когда их употребление снизилось. В связи с увеличением использования антибиотиков они, и среди них в первую очередь пенициллин, относятся к группе лекарств, дающих наиболее часто аллергические осложнения. Частота аллергических осложнений возрастает и по мере повторения курса лечения. Пенициллин чаще других медикаментов является причиной смертельных аллергических реакций, причем доза, дающая аллергическую реакцию, может быть очень незначительной. Учитывая все вышесказанное, нужно помнить, что прием любых лекарственных средств, особенно это касается синтетических препаратов, без назначения врача крайне опасен. 3. Бытовые аллергены. Нередко аллергеном является сушеный рачек - дафния, служащий кормом для рыб. Среди этого вида аллергенов главную роль играет домашняя пыль, в состав которой входят пылевые частички, попадающие с улицы, с ковров, одежды, постельного белья, грибки на стенах сырых комнат, частички домашних насекомых (клопов, тараканов, блох, постельных клещей). К этой группе можно отнести так называемые эпидермальные аллергены- волосы, отмершие клетки кожи, шерсть, перхоть животных. В последние годы неуклонно увеличивается число аллергических реакций на препараты бытовой химии, среди которых наибольшую роль играют стиральные порошки. Бытовые аллергены чаще всего вызывают аллергические заболевания дыхательных путей (бронхиальная астма, аллергический насморк, кожные высыпания). 4. Пыльцевые аллергены. Аллергические заболевания возникают в результате попадания в организм пыльцы некоторых растений, такой, которая не превышает в диаметре 35 мкм. Чаще всего это пыльца различных видов ветроопыляемых растений. Она вызывает насморк, конъюнктивит и другие проявления поллинозов. Наиболее сильным аллергизирующим свойством обладает пыльца амброзии, широко распространенного растения-сорняка. 5. Пищевые аллергены. В качестве аллергенов, для склонных к аллергическим проявлениям пациентов, практически могут выступать чуть ли не все пищевые продукты. Но наиболее часто аллергию вызывают такие продукты, как молоко, мед, орехи, яйца, мясо, рыба, помидоры, цитрусовые, шоколад, .клубника, земляника, раки. Имеются сведения о том, что дети, вскормленные искусственными молочными смесями, болеют аллергическими заболеваниями чаще, чем дети вскормленные материнским молоком. Состояние, развивающееся при попадании в организм аллергенов через желудочно-кишечный тракт, называют пищевой аллергией. В отличие от нее, аллергические поражения желудочно-кишечного тракта, возникающие при попадании аллергена другим путем, называют желудочно-кишечной аллергией. Например, аллерген, проникающий в организм через слизистую оболочку дыхательных путей, может вызвать аллергическую реакцию в любом отделе желудочно-кишечного тракта. Аллергическая реакция при пищевой аллергии может развиваться уже через несколько минут после попадания в желудочно-кишечный тракт пищевого аллергена. Так при аллергии к молоку через несколько минут после его приема может появиться рвота, внезапный понос. Несколько позже возможно присоединение других симптомов (крапивница, лихорадка). Иногда первые симптомы аллергических реакций со стороны желудочно-кишечного тракта возникают через некоторый промежуток времени. Обычно пищевая аллергия развивается на фоне нарушений функции желудочно-кишечного тракта. Способствует развитию пищевой аллергии у детей перекармливание. Очень часто пищевые аллергены вызывают у детей диатезы. Не всегда непереносимость определенных пищевых продуктов связана с аллергической реакцией. Она может быть обусловлена недостатком в пищеварительных соках некоторых ферментов, что в свою очередь приводит к нарушению переваривания пищи и расстройствам, по своим симптомам схожим на пищевую аллергию. Более подробно вопросы пищевой аллергии рассмотрены в разделе 8 данной лекции. 6. Промышленные аллергены. Бурное развитие промышленности, в особенности химической, значительно увеличило контакт людей с различными веществами на производстве и в быту, что обусловило возникновение разных по своему характеру аллергических реакций, главным образом в виде поражений кожи - аллергических профессиональных контактных дерматитов. Промышленными аллергенами могут быть: скипидар, минеральные масла, никель, хром, мышьяк, деготь, дубильные вещества, анилиновые, азонафтоловые и прочие красители, лаки, инсектофунгициды, вещества, содержащие бакелит, формалин, мочевину, эпоксидные смолы, отверждающие вещества, детергенты, аминобензолы, производные хинолина, хлорбензола и многие другие вещества. В парикмахерских и косметических кабинетах аллергенами могут оказаться красители для волос, бровей и ресниц, парфюмерные вещества, жидкости для волос; в фотолабораториях - метол, гидрохинон, соединения брома и др. 7. Особая группа аллергенов. К этой группе аллергенов можно отнести внешние физические факторы, воздействующие на человеческий организм: тепло, холод, солнечная радиация, радиочастотные и радиоактивные излучения, механические раздражения. Установлено, что во многих случаях под действием этих факторов в организме образуются определенные вещества, которые и становятся аллергенами. Механизм заболевания аллергией. Современная медицина трактует механизм заболевания аллергией следующим образом. В ответ на внедрение в организм, или воздействие на организм, аллергена в нем начинают развиваться и происходить аллергические реакции, которые могут быть специфическими и неспецифическими. Развитию специфической реакции предшествует скрытый период, в течение которого развивается повышенная чувствительность организма к впервые попавшему в него аллергену - так называемая сенсибилизация. Сенсибилизация происходит в результате выработки в организме антител - белковых веществ, образующихся в ответ на введение только данного аллергена, или появления лимфоцитов. способных взаимодействовать с данным аллергеном. Если к моменту их появления аллерген был удален из организма, то никаких болезненных проявлений не отмечается. При повторном воздействии аллергена на уже сенсибилизированный к нему организм, развивается аллергическая реакция - взаимодействие антител или лимфоцитов с вызвавшим их образование аллергеном. В результате этого взаимодействия происходит ряд биохимических процессов с выделением химических веществ (гистамин, серотонин и др.), вызывающих повреждение клеток, тканей и органов, которое лежит в основе аллергических заболеваний. Повышенная чувствительность организма в таких случаях специфична, т. е. она повышается к тому аллергену, с которым уже ранее был контакт, и который вызвал состояние сенсибилизации. Неспецифические аллергические реакции возникают при первичном контакте с аллергеном. При этом нет периода сенсибилизации. Попадающий в организм аллерген сам вызывает образование веществ, повреждающих клетки, ткани и органы. К числу таких реакций относится идиосинкразия - некоторые случаи непереносимости пищевых продуктов и лекарственных веществ. В большинстве случаев у человека, склонного к аллергии, развиваются специфические аллергические реакции. По времени проявления аллергические реакции принято делить на два типа: немедленный и замедленный. Реакциями немедленного типа считают кожные и системные аллергические реакции (дыхательной, пищеварительной и других систем), возникающие через 15-20 минут после воздействия на больного специфического аллергена. Такими реакциями являются кожный волдырь, спазм бронхов, расстройство функции желудочно-кишечного тракта и др. К аллергическим реакциям немедленного типа относят анафилактический шок, поллиноз, крапивницу, бронхиальную астму, сывороточную болезнь, отек Квинке. Сывороточная болезнь развивается при определенной настроенности организма через 2-12 дней после введения сыворотки или гамма-глобулина и проявляется появлением сыпи с мучительным зудом, припухлостью лимфатических узлов, повышением температуры, другими симптомами. Отек Квинке - преходящий ограниченный отек кожи, подкожной клетчатки и слизистых оболочек при попадании в организм любого аллергена; чаще встречается на лице, однако может наблюдаться на слизистой оболочке рта, гортани, желудочно-кишечного тракта. Реакции замедленного типа развиваются в течение многих часов, иногда суток. К ним относятся повышенная чувствительность к бактериям (например, при туберкулезе, бруцеллезе, сапе, туляремии и др.), контактные дерматиты у работников химической промышленности, фармацевтов, медицинского персонала.
60. РЕАКЦИИГИПЕРЧУВСТВИТЕЛЬНОСТИIТИПА
-АНАФИЛАКТИЧЕСКИЕРЕАКЦИИ
Реакции
гиперчувствительности I типа бывают
системными и местными. Системная реакция
развивается обычно в ответ на внутривенное
введение антигена, к которому организм
хозяина уже сенсибилизирован. При этом
часто спустя несколько минут развивается
шоковое состояние, которое может стать
причиной смерти. Местные реакции зависят
от места, в которое попадет антиген, и
носят характер локализованного отека
кожи (кожная аллергия, крапивница),
выделений из носа и конъюнктивы
(аллергический ринит и конъюнктивит),
сенной лихорадки, бронхиальной астмы
или аллергического гастроэнтерита
(пищевая аллергия).
Схема
25. РеакциигиперчувствительностиIтипа—
анафилактическиереакции
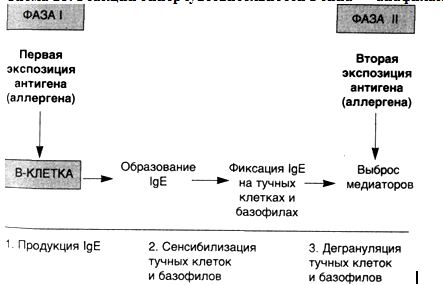 Известно,
что реакции гиперчувствительности I
типа проходят в развитии две фазы
(схема 25). Первая фаза инициального
ответа характеризуется расширением
сосудов и повышением их проницаемости,
а также, в зависимости от локализации,
спазмом гладкой мускулатуры или секрецией
желез. Эти признаки появляются через
5—30 мин после экспозиции аллергена. Во
многих случаях вторая (поздняя) фаза
развивается через 2—8 ч, без дополнительной
экспозиции антигена и продолжается
несколько дней. Эта поздняя фаза реакции
характеризуется интенсивной инфильтрацией
эозинофилами, нейтрофилами, базофилами
и моноцитами, а также деструкцией
ткани в виде повреждения эпителиальных
клеток слизистых оболочек.
Тучные
клетки и базофилы играют главную роль
в развитии реакций гиперчувствительности
I типа; они активируются посредством
перекрестно реагирующих высокоаффинных
рецепторов к IgE. Кроме того, тучные
клетки активируются компонентами
комплемента С5а и С3а (анафилатоксины),
а также цитокинами макрофагов
(интерлейкин-8), некоторыми лекарственными
веществами (кодеин и морфин) и физическими
воздействиями (тепло, холод, солнечный
свет).
У человека реакции
гиперчувствительности I типа вызываются
иммуноглобулинами класса IgE. Аллерген
стимулирует продукцию IgE В-лимфоцитами
в основном в слизистых оболочках в месте
попадания антигена и в регионарных
лимфатических узлах. IgE-антитела,
образованные в ответ на аллерген, атакуют
тучные клетки и базофилы, которые
обладают высокочувствительными
рецепторами для Fc-порции IgE. После того
как тучные клетки и базофилы, атакованные
цитофильными IgE-антитела-ми, повторно
встречаются со специфическим антигеном,
развивается серия реакций, приводящая
к выбросу ряда сильных медиаторов,
ответственных за клинические проявления
гиперчувствительности I типа.
Вначале
антиген (аллерген) связывается с
IgE-антителами. При этом мультивалентные
антигены связывают более одной молекулы
IgE и вызывают перекрестное связывание
соседних IgE-антител. Связывание молекул
IgE инициирует развитие двух независимых
процессов: 1) дегрануляцию тучных клеток
с выбросом первичных медиаторов; 2)
синтез de novo и выброс вторичных
медиаторов, таких как метаболиты
арахидоновой кислоты. Эти медиаторы
непосредственно ответственны за
начальные симптомы реакций
гиперчувствительности I типа. Кроме
того, они включают цепь реакций, которые
приводят к развитию второй (поздней)
фазы инициального ответа.
Первичные
медиаторы содержатся в гранулах тучных
клеток. Их делят на четыре категории.
▲Биогенные
амины включают гистамин и аденозин.
ГистамиН вызывает выраженный спазм
гладкой мускулатуры бронхов, усиление
сосудистой проницаемости, интенсивную
секрецию носовых, бронхиальных и
желудочных желез. Аденозин стимулирует
тучные клетки к выбросу медиаторов,
вызывающих бронхоспазм и торможение
агрегации тромбоцитов.
▲Медиаторы
хемотаксиса включают эозинофильный
хемотаксический фактор и нейтрофильный
хемотаксический фактор.
▲
ферменты содержатся в матриксе гранул
и включают протезы (химаза, триптаза)
и некоторые кислые гидролазы. Ферменты
вызывают образование кининов и активацию
компонентов комплемента (СЗа), воздействуя
на их предшественников.
▲
Протеогликан — гепарин.
Вторичные
медиаторы включают два класса соединений:
липидные медиаторы и цитокины.
▲
Липидные медиаторы образуются
благодаря последовательным реакциям,
происходящим в мембранах тучных клеток
и приводящим к активации фосфолипазы
А2. Она воздействует на фосфолипиды
мембран, вызывая появление арахидоновой
кислоты. Из арахидоновой кислоты в
свою очередь образуются лейкотриены и
простагландины.
Лейкотриены
играют исключительно важную роль в
патогенезе реакций гиперчувствительности
I типа. Лейкотриены С4 и D4 — самые сильные
из известных вазоактивных и спазмогенных
агентов. Они действуют в несколько тысяч
раз активнее гистамина при повышении
сосудистой проницаемости и сокращении
гладкой мускулатуры бронхов. Лейкотриен
В4 обладает сильным хемотаксическим
действием в отношении нейтрофилов,
эозинофилов и моноцитов.
Простагландин
D2образуется в
тучных клетках и вызывает интенсивный
бронхоспазм и повышенную секрецию
слизи.
Фактор активации
тромбоцитов (ФАТ) — вторичный
медиатор, вызывающий агрегацию
тромбоцитов, выброс гистамина, бронхоспазм,
повышение сосудистой проницаемости и
расширение кровеносных сосудов.
Кроме того, он обладает выраженным
провоспалительным эффектом. ФАТ оказывает
токсическое действие в отношении
нейтрофилов и эозинофилов. В высоких
концентрациях он активирует клетки,
участвующие в воспалении, вызывая
их агрегацию и дегрануляцию.
▲Цитокины
играют важную роль в патогенезе
реакций гиперчувствительности I типа
благодаря их способности рекрутировать
и активировать воспалительные клетки.
Полагают, что тучные клетки продуцируют
ряд цитокинов, включая фактор некроза
опухоли а (ФНО-а), интерлейкины (ИЛ-1,
ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6) и
гранулоцитарно-макрофагальный
колониестиму-лирующий фактор (ГМ-КСФ).
В экспериментальных моделях показано,
что ФНО-а является важным медиатором
IgE-зависимых кожных реакций. ФНО-а считают
сильным провоспалительным цитокином,
который может привлекать нейтрофилы и
эозинофилы, способствуя их проникновению
через стенки сосудов и активируя их в
тканях. Наконец, ИЛ-4 необходим для
рекрутирования эозинофилов. Воспалительные
клетки, накапливающиеся в местах
развития реакции гиперчувствительности
I типа, являются дополнительным источником
цитокинов и гистаминвысвобождающих
факторов, которые вызывают дальнейшую
дегрануляцию тучных клеток.
Таким
образом, гистамин и лейкотриены быстро
выделяются из сенсибилизированных
тучных клеток и ответственны за
немедленно развивающиеся реакции,
характеризующиеся отеком, секрецией
слизи, спазмом гладкой мускулатуры.
Многие другие медиаторы, представленные
лейкотриенами, ФАТ и ФНО-а, включаются
в позднюю фазу ответа, рекрутируя
дополнительное количество лейкоцитов
— базофилов, нейтрофилов и эозинофилов.
Среди
клеток, которые появляются в позднюю
фазу реакции, особенно важны эозинофилы.
Набор медиаторов в них столь же велик,
как и в тучных клетках. Таким образом,
дополнительно рекрутированные клетки
усиливают и поддерживают воспалительный
ответ без дополнительного поступления
антигена.
эозинофилы.
Системнаяиместнаяанафилаксия
Системная
анафилаксия возникает после
введения гетерологичных белков, например
антисывороток, гормонов, ферментов,
полисахаридов и лекарственных веществ.
Тяжесть заболевания зависит от уровня
сенсибилизации. Шоковая доза антигена,
однако, может быть исключительно
мала. Например, для кожного тестирования
различных форм аллергии достаточно
минимального количества антигена.
Спустя несколько минут после экспозиций
появляются зуд, крапивница и кожная
эритема, затем через короткое время
развивается спазм респираторных бронхиол
и появляется респираторный дистресс.
Рвота, спазмы в животе, понос и обструкция
гортани могут закончиться шоком и
смертью больного. На вскрытии в одних
случаях обнаруживаются отек и кровоизлияние
в легких, тогда как в других — острая
эмфизема легких с расширением правого
желудочка сердца.
Местную
анафилаксию называют атопической
аллергией. Около 10 % населения
страдает от местной анафилаксии,
возникающей в ответ на попадание в
организм аллергенов: пыльцы растений,
перхоти животных, домашней пыли и т.п.
К заболеваниям, в основе которых
лежит местная анафилаксия, относят
крапивницу, ангионевротический отек,
аллергический ринит (сенная лихорадка)
и некоторые формы астмы. Существует
семейная предрасположенность к этому
типу аллергии.
Известно,
что реакции гиперчувствительности I
типа проходят в развитии две фазы
(схема 25). Первая фаза инициального
ответа характеризуется расширением
сосудов и повышением их проницаемости,
а также, в зависимости от локализации,
спазмом гладкой мускулатуры или секрецией
желез. Эти признаки появляются через
5—30 мин после экспозиции аллергена. Во
многих случаях вторая (поздняя) фаза
развивается через 2—8 ч, без дополнительной
экспозиции антигена и продолжается
несколько дней. Эта поздняя фаза реакции
характеризуется интенсивной инфильтрацией
эозинофилами, нейтрофилами, базофилами
и моноцитами, а также деструкцией
ткани в виде повреждения эпителиальных
клеток слизистых оболочек.
Тучные
клетки и базофилы играют главную роль
в развитии реакций гиперчувствительности
I типа; они активируются посредством
перекрестно реагирующих высокоаффинных
рецепторов к IgE. Кроме того, тучные
клетки активируются компонентами
комплемента С5а и С3а (анафилатоксины),
а также цитокинами макрофагов
(интерлейкин-8), некоторыми лекарственными
веществами (кодеин и морфин) и физическими
воздействиями (тепло, холод, солнечный
свет).
У человека реакции
гиперчувствительности I типа вызываются
иммуноглобулинами класса IgE. Аллерген
стимулирует продукцию IgE В-лимфоцитами
в основном в слизистых оболочках в месте
попадания антигена и в регионарных
лимфатических узлах. IgE-антитела,
образованные в ответ на аллерген, атакуют
тучные клетки и базофилы, которые
обладают высокочувствительными
рецепторами для Fc-порции IgE. После того
как тучные клетки и базофилы, атакованные
цитофильными IgE-антитела-ми, повторно
встречаются со специфическим антигеном,
развивается серия реакций, приводящая
к выбросу ряда сильных медиаторов,
ответственных за клинические проявления
гиперчувствительности I типа.
Вначале
антиген (аллерген) связывается с
IgE-антителами. При этом мультивалентные
антигены связывают более одной молекулы
IgE и вызывают перекрестное связывание
соседних IgE-антител. Связывание молекул
IgE инициирует развитие двух независимых
процессов: 1) дегрануляцию тучных клеток
с выбросом первичных медиаторов; 2)
синтез de novo и выброс вторичных
медиаторов, таких как метаболиты
арахидоновой кислоты. Эти медиаторы
непосредственно ответственны за
начальные симптомы реакций
гиперчувствительности I типа. Кроме
того, они включают цепь реакций, которые
приводят к развитию второй (поздней)
фазы инициального ответа.
Первичные
медиаторы содержатся в гранулах тучных
клеток. Их делят на четыре категории.
▲Биогенные
амины включают гистамин и аденозин.
ГистамиН вызывает выраженный спазм
гладкой мускулатуры бронхов, усиление
сосудистой проницаемости, интенсивную
секрецию носовых, бронхиальных и
желудочных желез. Аденозин стимулирует
тучные клетки к выбросу медиаторов,
вызывающих бронхоспазм и торможение
агрегации тромбоцитов.
▲Медиаторы
хемотаксиса включают эозинофильный
хемотаксический фактор и нейтрофильный
хемотаксический фактор.
▲
ферменты содержатся в матриксе гранул
и включают протезы (химаза, триптаза)
и некоторые кислые гидролазы. Ферменты
вызывают образование кининов и активацию
компонентов комплемента (СЗа), воздействуя
на их предшественников.
▲
Протеогликан — гепарин.
Вторичные
медиаторы включают два класса соединений:
липидные медиаторы и цитокины.
▲
Липидные медиаторы образуются
благодаря последовательным реакциям,
происходящим в мембранах тучных клеток
и приводящим к активации фосфолипазы
А2. Она воздействует на фосфолипиды
мембран, вызывая появление арахидоновой
кислоты. Из арахидоновой кислоты в
свою очередь образуются лейкотриены и
простагландины.
Лейкотриены
играют исключительно важную роль в
патогенезе реакций гиперчувствительности
I типа. Лейкотриены С4 и D4 — самые сильные
из известных вазоактивных и спазмогенных
агентов. Они действуют в несколько тысяч
раз активнее гистамина при повышении
сосудистой проницаемости и сокращении
гладкой мускулатуры бронхов. Лейкотриен
В4 обладает сильным хемотаксическим
действием в отношении нейтрофилов,
эозинофилов и моноцитов.
Простагландин
D2образуется в
тучных клетках и вызывает интенсивный
бронхоспазм и повышенную секрецию
слизи.
Фактор активации
тромбоцитов (ФАТ) — вторичный
медиатор, вызывающий агрегацию
тромбоцитов, выброс гистамина, бронхоспазм,
повышение сосудистой проницаемости и
расширение кровеносных сосудов.
Кроме того, он обладает выраженным
провоспалительным эффектом. ФАТ оказывает
токсическое действие в отношении
нейтрофилов и эозинофилов. В высоких
концентрациях он активирует клетки,
участвующие в воспалении, вызывая
их агрегацию и дегрануляцию.
▲Цитокины
играют важную роль в патогенезе
реакций гиперчувствительности I типа
благодаря их способности рекрутировать
и активировать воспалительные клетки.
Полагают, что тучные клетки продуцируют
ряд цитокинов, включая фактор некроза
опухоли а (ФНО-а), интерлейкины (ИЛ-1,
ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6) и
гранулоцитарно-макрофагальный
колониестиму-лирующий фактор (ГМ-КСФ).
В экспериментальных моделях показано,
что ФНО-а является важным медиатором
IgE-зависимых кожных реакций. ФНО-а считают
сильным провоспалительным цитокином,
который может привлекать нейтрофилы и
эозинофилы, способствуя их проникновению
через стенки сосудов и активируя их в
тканях. Наконец, ИЛ-4 необходим для
рекрутирования эозинофилов. Воспалительные
клетки, накапливающиеся в местах
развития реакции гиперчувствительности
I типа, являются дополнительным источником
цитокинов и гистаминвысвобождающих
факторов, которые вызывают дальнейшую
дегрануляцию тучных клеток.
Таким
образом, гистамин и лейкотриены быстро
выделяются из сенсибилизированных
тучных клеток и ответственны за
немедленно развивающиеся реакции,
характеризующиеся отеком, секрецией
слизи, спазмом гладкой мускулатуры.
Многие другие медиаторы, представленные
лейкотриенами, ФАТ и ФНО-а, включаются
в позднюю фазу ответа, рекрутируя
дополнительное количество лейкоцитов
— базофилов, нейтрофилов и эозинофилов.
Среди
клеток, которые появляются в позднюю
фазу реакции, особенно важны эозинофилы.
Набор медиаторов в них столь же велик,
как и в тучных клетках. Таким образом,
дополнительно рекрутированные клетки
усиливают и поддерживают воспалительный
ответ без дополнительного поступления
антигена.
эозинофилы.
Системнаяиместнаяанафилаксия
Системная
анафилаксия возникает после
введения гетерологичных белков, например
антисывороток, гормонов, ферментов,
полисахаридов и лекарственных веществ.
Тяжесть заболевания зависит от уровня
сенсибилизации. Шоковая доза антигена,
однако, может быть исключительно
мала. Например, для кожного тестирования
различных форм аллергии достаточно
минимального количества антигена.
Спустя несколько минут после экспозиций
появляются зуд, крапивница и кожная
эритема, затем через короткое время
развивается спазм респираторных бронхиол
и появляется респираторный дистресс.
Рвота, спазмы в животе, понос и обструкция
гортани могут закончиться шоком и
смертью больного. На вскрытии в одних
случаях обнаруживаются отек и кровоизлияние
в легких, тогда как в других — острая
эмфизема легких с расширением правого
желудочка сердца.
Местную
анафилаксию называют атопической
аллергией. Около 10 % населения
страдает от местной анафилаксии,
возникающей в ответ на попадание в
организм аллергенов: пыльцы растений,
перхоти животных, домашней пыли и т.п.
К заболеваниям, в основе которых
лежит местная анафилаксия, относят
крапивницу, ангионевротический отек,
аллергический ринит (сенная лихорадка)
и некоторые формы астмы. Существует
семейная предрасположенность к этому
типу аллергии.
61. РЕАКЦИИГИПЕРЧУВСТВИТЕЛЬНОСТИIIТИПА
-ЦИТОТОКСИЧЕСКИЕРЕАКЦИИ
При
реакциях гиперчувствительности II типа
в организме появляются антитела,
которые направлены против антигенов,
расположенных на поверхности клеток
или других компонентов тканей. Антигенные
детерминанты могут быть связаны с
клеточной мембраной или представляют
собой экзогенный антиген, адсорбированный
на поверхности клеток. В любом случае
реакция гиперчувствительности возникает
как следствие связывания антител с
нормальными или поврежденными антигенами
на поверхности клетки. Описаны три
антителозависимых механизма развития
реакции этого типа.
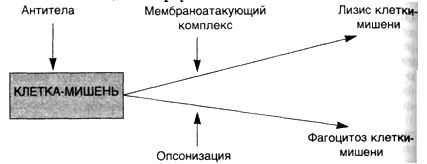
Комплементзависимые
реакции (схема 26). Существует два
механизма, с помощью которых антитело
и комплемент могут вызывать реакции
гиперчувствительности II типа: прямой
лизис и опсонизация. В первом случае
антитело (IgM или IgG) реагирует с
антигеном на поверхности клетки, вызывая
активацию системы комплемента и
приводя в действие мембраноатакующий
комплекс, который нарушает целостность
мембраны, "продырявливая"
липидный слой. Во втором случае клетки
сенсибилизированы к фагоцитозу
посредством фиксации антитела или СЗЬ
— фрагмента комплемента к поверхности
клетки (опсонизация). При этом варианте
реакции гиперчувствительности II типа
чаще всего затрагиваются клетки крови
(эритроциты, лейкоциты и тромбоциты),
но антитела могут быть направлены также
против внеклеточных структур, например
против гломерулярной ба-зальной
мембраны.
Клинически такие реакции
возникают в следующих
случаях:
▲припереливаниинесовместимойкрови,
когдаклеткидонорареагируютсантителамихозяина;
▲
при эритробластозе плода, когда имеются
антигенные различия между матерью
и плодом, а антитела (IgG) матери, проникая
сквозь плаценту, вызывают разрушение
эритроцитов плода;
Схема
26. РеакциягиперчувствительностиIIтипа—
комплементзависимыереакции
 ▲
при аутоиммунной гемолитической анемии,
агранулоцитозе и тромбоцитопении, когда
происходит образование антител против
собственных клеток крови, которые затем
разрушаются;
▲принекоторыхреакцияхна
лекарства образующиеся антитела
реагируют с препаратами, образуя
комплексы с эритроцитарным
антигеном.
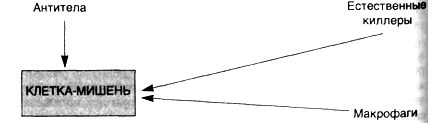
Антителозависимая связанная
с клетками цитотоксичность (схема
27) не сопровождается фиксацией комплемента,
однако вызывает кооперацию лейкоцитов.
Клетки-мишени, покрытые IgG-антителами
в низких концентрациях, уничтожаются
несенсибилизированными клетками,
которые обладают Fc-рецепторами.
Несенсибилизированные клетки связывают
клетки-мишени рецепторами для
Fc-фрагмента IgG, а лизис клеток происходит
без фагоцитоза. В этом виде цитотоксичности
участвуют моноциты, нейтрофилы, эозинофилы
и естественные киллеры (NK). Хотя в
большинстве случаев в данном типе
реакции участвуют антитела IgG; иногда
(например, при связанной с эозинофилами
цитотоксичности против паразитов)
задействованы IgE-антитела. Этот вид
цитотоксичности также имеет значение
при реакции отторжения трансплантата.
Схема
27. РеакциягиперчувствительностиIIтипа—
антителозависимаясвязаннаясклеткамицитотоксичность
▲
при аутоиммунной гемолитической анемии,
агранулоцитозе и тромбоцитопении, когда
происходит образование антител против
собственных клеток крови, которые затем
разрушаются;
▲принекоторыхреакцияхна
лекарства образующиеся антитела
реагируют с препаратами, образуя
комплексы с эритроцитарным
антигеном.
Антителозависимая связанная
с клетками цитотоксичность (схема
27) не сопровождается фиксацией комплемента,
однако вызывает кооперацию лейкоцитов.
Клетки-мишени, покрытые IgG-антителами
в низких концентрациях, уничтожаются
несенсибилизированными клетками,
которые обладают Fc-рецепторами.
Несенсибилизированные клетки связывают
клетки-мишени рецепторами для
Fc-фрагмента IgG, а лизис клеток происходит
без фагоцитоза. В этом виде цитотоксичности
участвуют моноциты, нейтрофилы, эозинофилы
и естественные киллеры (NK). Хотя в
большинстве случаев в данном типе
реакции участвуют антитела IgG; иногда
(например, при связанной с эозинофилами
цитотоксичности против паразитов)
задействованы IgE-антитела. Этот вид
цитотоксичности также имеет значение
при реакции отторжения трансплантата.
Схема
27. РеакциягиперчувствительностиIIтипа—
антителозависимаясвязаннаясклеткамицитотоксичность
 Антителоопосредованная
клеточная дисфункция. В некоторых
случаях антитела, направленные против
рецепторов на поверхности клеток,
нарушают их функционирование, не вызывая
повреждения клеток или развития
воспаления. Например, при миастении
антитела вступают в реакцию с
ацетилхолиновыми рецепторами в
двигательных концевых пластинках
скелетных мышц, нарушая нервно-мышечную
передачу и вызывая таким образом мышечную
слабость. Наоборот, при антителоопосредованной
стимуляции функций клетки развивается
базедова болезнь. При этом заболевании
антитела против рецепторов тиреотропного
гормона на эпителиальных клетках
щитовидной железы стимулируют клетки,
что приводит к гипертиреозу. Этот же
механизм лежит в основе реакций
инактивации и нейтрализации.
Антителоопосредованная
клеточная дисфункция. В некоторых
случаях антитела, направленные против
рецепторов на поверхности клеток,
нарушают их функционирование, не вызывая
повреждения клеток или развития
воспаления. Например, при миастении
антитела вступают в реакцию с
ацетилхолиновыми рецепторами в
двигательных концевых пластинках
скелетных мышц, нарушая нервно-мышечную
передачу и вызывая таким образом мышечную
слабость. Наоборот, при антителоопосредованной
стимуляции функций клетки развивается
базедова болезнь. При этом заболевании
антитела против рецепторов тиреотропного
гормона на эпителиальных клетках
щитовидной железы стимулируют клетки,
что приводит к гипертиреозу. Этот же
механизм лежит в основе реакций
инактивации и нейтрализации.
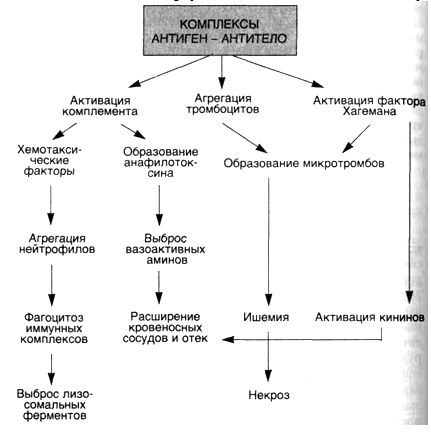
62. РЕАКЦИИГИПЕРЧУВСТВИТЕЛЬНОСТИIIIТИПА -ИММУНОКОМПЛЕКСНЫЕРЕАКЦИИ Развитие реакций гиперчувствительности III типа вызывают комплексы антиген — антитело, которые повреждают ткань в связи с их способностью активировать различные медиаторы сыворотки крови, главным образом систему комплемента (схема 28). Токсическая реакция возникает тогда, когда антиген связывается с антителом или в кровеносном русле (циркулирующие иммунные комплексы), или вне сосудов, где антиген может осаждаться (иммунные комплексы in situ). Отдельные формы гломе-рулонефрита, при которых иммунные комплексы образуются in situ, начинаются с имплантации антигена в гломерулярную ба-зальную мембрану. Комплексы, образованные в кровотоке, вызывают повреждение тогда, когда они попадают в стенки кровеносных сосудов или оседают в фильтрующих структурах, таких как гломерулярный фильтр. Образование комплексов антиген — антитело еще не означает болезнь, так как они встречаются при многих иммунных процессах и могут представлять собой нормальный механизм элиминации антигена.
Известны два типа иммунокомплексных
повреждений: 1) при поступлении в организм
экзогенного антигена (чужеродный белок,
бактерия, вирус) и 2) при образовании
антител против собственных антигенов
(эндогенные). Заболевания, развитие
которых обусловлено иммунными комплексами,
могут быть генерализованными, если
иммунные комплексы образуются в крови
и осе-Дают во многих органах, или местными,
когда иммунные комплексы локализованы
в отдельных органах, таких как почки
(гломе-РУлонефрит), суставы (артрит) или
мелкие кровеносные сосуды к°Жи
(местная реакция Артюса).
Схема
28. РеакциигиперчувствительностиIIIтипа—
иммунокомплексныереакции
 Системнаяиместнаяиммунокомплексная
болезнь
Системная
иммунокомплексная болезнь. Одной
из ее разновидностей является острая
сывороточная болезнь, которая часто
возникает в результате многократного
введения большого количества
чужеродной сыворотки крови, используемой
для пассивной иммунизации.
Патогенез
системной иммунокомплексной болезни
складывается из трех
фаз:
▲образованиевкровикомплексов
антиген —
антитело;
▲осаждениеиммунныхкомплексоввразличныхтканях;
▲воспалительнаяреакциявразныхчастяхтела.
Перваяфазаначинаетсяспопаданияантигенавкровьиеговзаимодействиясиммунокомпетентнымиклетками,
приводящегокобразованиюантител.
Приблизительно через 5 дней после
введения сыворотки вырабатываются
антитела против ее компонентов,
которые, еще находясь в кровотоке,
образуют комплексы антиген — антитело.
Во вторую фазу эти комплексы оседают в
различных тканях. Дальнейшее течение
болезни определяют два фактора: 1) размеры
иммунных комплексов и 2) состояние
системы моноцитарных фагоцитов
(СМФ).
Очень крупные комплексы
образуются при значительном избытке
антител, быстро удаляются из кровотока
клетками СМФ и относительно безвредны.
Наиболее патогенны мелкие и средних
размеров комплексы, которые образуются
при незначительном избытке антител,
дольше циркулируют и не так жадно
захватываются фагоцитирующими
клетками.
В связи с тем что СМФ в норме
разрушает циркулирующие иммунные
комплексы, ее перегрузка или существенная
дисфункция увеличивает возможность
персистенции иммунных комплексов в
кровотоке и их осаждение в тканях.
Кроме
того, такие факторы, как заряд иммунных
комплексов (анионный или катионный
полюс комплекса), валентность антигена,
авидность антитела, аффинность антигена
к компонентам различных тканей, трехмерная
структура комплексов (решетка) и
гемодинамические факторы, влияют на
осаждение иммунных комплексов в тканях.
Чаще всего иммунные комплексы оседают
в почечных клубочках, а также в суставах,
коже, сердце, серозных оболочках и
мелких кровеносных сосудах.
Для того
чтобы комплексы покинули систему
кровообращения и осели в тканях,
должна увеличиться проницаемость
сосудистого русла. Во-первых,
IgE-антитела, образовавшиеся вскоре после
поступления в кровь антигена, связываются
с циркулирующими базофилами, и
происходит выброс гистамина и ФАТ. Эти
медиаторы раздвигают эндотелиальные
клетки, и иммунные комплексы проходят
сквозь стенку сосудов. Как только
иммунные комплексы оседают в тканях,
они вызывают острую воспалительную
реакцию. В эту фазу (приблизительно
через 10 дней после введения антигена)
наблюдаются клинические проявления
болезни, такие как лихорадка, крапивница,
артралгии, увеличение лимфатических
узлов и протеинурия. Вслед за осаждением
иммунных комплексов происходит активация
системы комплемента с образованием
его биологически активных
компонентов.
Активация системы
комплемента сопровождается
провоспалительными эффектами: выбросом
С3b-опсонина, способствующего
фагоцитозу; образованием хемотаксических
факторов, вызывающих миграцию
полиморфно-ядерных лейкоцитов и моноцитов
(С5, С5Ь67); выбросом анафилотоксинов (С3а
и С5а), которые увеличивают проницаемость
сосудов и вызывают сокращение гладких
мышц; образованием мембраноатакующего
комплекса (С5—9), вызывающего разрушение
клеточных мембран и цитолиз.
Фагоцитоз
комплексов антиген — антитело лейкоцитами
приводит к выбросу или образованию
различных дополнительных провоспалительных
веществ, включая простагландины,
сосудорасширяющие белки и хемотаксические
вещества, например некоторые
лизосомальные ферменты, в том числе
протеазы, способные растворять
базальную мембрану, коллаген, эластин
и хрящ. Повреждение тканей опосредуется
также свободными радикалами кислорода,
продуцируемыми активированными
нейтрофилами.
Иммунные комплексы
вызывают агрегацию тромбоцитов и
активацию фактора Хагемана, что приводит
к усилению воспалительного процесса
и образованию микротромбов. В результате
развиваются васкулит, гломерулонефрит,
артрит и т.п.
Все эти повреждения
возникают при участии комплементсвязанных
антител (IgG и IgM). Однако, так как IgA может
активировать комплемент по
альтернативному пути, IgA-содержащие
комплексы также могут вызывать тканевые
повреждения. Важная роль комплемента
в патогенезе тканевых повреждений
подтверждается наблюдением, что
истощение комплемента в сыворотке
крови (в эксперименте) обычно уменьшает
выраженность повреждений.
В
морфологической картине иммунокомплексного
повреждения доминирует острый
некротизирующий васкулит с образованием
фибриноида и экссудацией нейтрофилов.
Например, пораженные клубочки почки
всегда увеличены вследствие набухания
и пролиферации эндотелиальных и
мезангиальных клеток, инфильтрации
нейтрофилами и моноцитами. При
иммунофлюоресцентной микроскопии
иммунные комплексы видны в виде
гранулярных депозитов иммуноглобулина
и комплемента, а под электронным
микроскопом — в виде электронно-плотных
депозитов вдоль гломерулярной базальной
мембраны. Если заболевание возникает
после разовой массивной экспозиции
антигена, например при остром
постстрептококковом гломерулонефрите
и острой сывороточной болезни, то
все повреждения имеют тенденцию к
разрешению благодаря катаболизму
иммунных комплексов.
Для развития
хронической иммунокомплексной болезни
необходима постоянная антигенемия,
так как иммунные комплексы чаще всего
оседают в сосудистом русле. Это наблюдается
при некоторых заболеваниях, таких,
как системная красная волчанка, которая
обусловлена персистенцией аутоантигенов.
Часто, однако, несмотря на наличие
характерных морфологических изменений
и других признаков, свидетельствующих
о развитии иммунокомплексной болезни,
антиген остается неизвестным, например
при ревматоидном артрите, узелковом
периартериите, мембранозном гломерулонефрите
и некоторых васкулитах.
Местная
иммунокомплексная болезнь. Ее еще
называют реакцией Артюса. Она
заключается в местном некрозе ткани,
возникающем вследствие острого
иммунокомплексного васкулита. реакцию
можно вызвать в эксперименте путем
внутрикожного введения антигена
иммунному животному, которое имеет
циркулирующие антитела против
антигена. Вследствие избытка антител,
когда антиген проникает в стенки сосудов,
образуются крупные иммунные комплексы,
которые вызывают воспалительную реакцию.
В отличие от IgE-опосредованных реакций
гиперчувствительности I типа, которые
возникают немедленно, реакция Артюса
развивается в течение нескольких часов
и достигает пика через А—10
ч после инъекции. При иммунофлюоресцентном
окрашивании удается выявить комплемент,
иммуноглобулины и фибриноген, осажденные
в стенках сосудов, обычно венул; при
светооптическом исследовании —
фибриноидный некроз сосудов. Разрыв
сосудов приводит к возникновению
кровоизлияний, но чаще наблюдается
тромбоз, способствующий развитию
местных ишемических повреждений.
Системнаяиместнаяиммунокомплексная
болезнь
Системная
иммунокомплексная болезнь. Одной
из ее разновидностей является острая
сывороточная болезнь, которая часто
возникает в результате многократного
введения большого количества
чужеродной сыворотки крови, используемой
для пассивной иммунизации.
Патогенез
системной иммунокомплексной болезни
складывается из трех
фаз:
▲образованиевкровикомплексов
антиген —
антитело;
▲осаждениеиммунныхкомплексоввразличныхтканях;
▲воспалительнаяреакциявразныхчастяхтела.
Перваяфазаначинаетсяспопаданияантигенавкровьиеговзаимодействиясиммунокомпетентнымиклетками,
приводящегокобразованиюантител.
Приблизительно через 5 дней после
введения сыворотки вырабатываются
антитела против ее компонентов,
которые, еще находясь в кровотоке,
образуют комплексы антиген — антитело.
Во вторую фазу эти комплексы оседают в
различных тканях. Дальнейшее течение
болезни определяют два фактора: 1) размеры
иммунных комплексов и 2) состояние
системы моноцитарных фагоцитов
(СМФ).
Очень крупные комплексы
образуются при значительном избытке
антител, быстро удаляются из кровотока
клетками СМФ и относительно безвредны.
Наиболее патогенны мелкие и средних
размеров комплексы, которые образуются
при незначительном избытке антител,
дольше циркулируют и не так жадно
захватываются фагоцитирующими
клетками.
В связи с тем что СМФ в норме
разрушает циркулирующие иммунные
комплексы, ее перегрузка или существенная
дисфункция увеличивает возможность
персистенции иммунных комплексов в
кровотоке и их осаждение в тканях.
Кроме
того, такие факторы, как заряд иммунных
комплексов (анионный или катионный
полюс комплекса), валентность антигена,
авидность антитела, аффинность антигена
к компонентам различных тканей, трехмерная
структура комплексов (решетка) и
гемодинамические факторы, влияют на
осаждение иммунных комплексов в тканях.
Чаще всего иммунные комплексы оседают
в почечных клубочках, а также в суставах,
коже, сердце, серозных оболочках и
мелких кровеносных сосудах.
Для того
чтобы комплексы покинули систему
кровообращения и осели в тканях,
должна увеличиться проницаемость
сосудистого русла. Во-первых,
IgE-антитела, образовавшиеся вскоре после
поступления в кровь антигена, связываются
с циркулирующими базофилами, и
происходит выброс гистамина и ФАТ. Эти
медиаторы раздвигают эндотелиальные
клетки, и иммунные комплексы проходят
сквозь стенку сосудов. Как только
иммунные комплексы оседают в тканях,
они вызывают острую воспалительную
реакцию. В эту фазу (приблизительно
через 10 дней после введения антигена)
наблюдаются клинические проявления
болезни, такие как лихорадка, крапивница,
артралгии, увеличение лимфатических
узлов и протеинурия. Вслед за осаждением
иммунных комплексов происходит активация
системы комплемента с образованием
его биологически активных
компонентов.
Активация системы
комплемента сопровождается
провоспалительными эффектами: выбросом
С3b-опсонина, способствующего
фагоцитозу; образованием хемотаксических
факторов, вызывающих миграцию
полиморфно-ядерных лейкоцитов и моноцитов
(С5, С5Ь67); выбросом анафилотоксинов (С3а
и С5а), которые увеличивают проницаемость
сосудов и вызывают сокращение гладких
мышц; образованием мембраноатакующего
комплекса (С5—9), вызывающего разрушение
клеточных мембран и цитолиз.
Фагоцитоз
комплексов антиген — антитело лейкоцитами
приводит к выбросу или образованию
различных дополнительных провоспалительных
веществ, включая простагландины,
сосудорасширяющие белки и хемотаксические
вещества, например некоторые
лизосомальные ферменты, в том числе
протеазы, способные растворять
базальную мембрану, коллаген, эластин
и хрящ. Повреждение тканей опосредуется
также свободными радикалами кислорода,
продуцируемыми активированными
нейтрофилами.
Иммунные комплексы
вызывают агрегацию тромбоцитов и
активацию фактора Хагемана, что приводит
к усилению воспалительного процесса
и образованию микротромбов. В результате
развиваются васкулит, гломерулонефрит,
артрит и т.п.
Все эти повреждения
возникают при участии комплементсвязанных
антител (IgG и IgM). Однако, так как IgA может
активировать комплемент по
альтернативному пути, IgA-содержащие
комплексы также могут вызывать тканевые
повреждения. Важная роль комплемента
в патогенезе тканевых повреждений
подтверждается наблюдением, что
истощение комплемента в сыворотке
крови (в эксперименте) обычно уменьшает
выраженность повреждений.
В
морфологической картине иммунокомплексного
повреждения доминирует острый
некротизирующий васкулит с образованием
фибриноида и экссудацией нейтрофилов.
Например, пораженные клубочки почки
всегда увеличены вследствие набухания
и пролиферации эндотелиальных и
мезангиальных клеток, инфильтрации
нейтрофилами и моноцитами. При
иммунофлюоресцентной микроскопии
иммунные комплексы видны в виде
гранулярных депозитов иммуноглобулина
и комплемента, а под электронным
микроскопом — в виде электронно-плотных
депозитов вдоль гломерулярной базальной
мембраны. Если заболевание возникает
после разовой массивной экспозиции
антигена, например при остром
постстрептококковом гломерулонефрите
и острой сывороточной болезни, то
все повреждения имеют тенденцию к
разрешению благодаря катаболизму
иммунных комплексов.
Для развития
хронической иммунокомплексной болезни
необходима постоянная антигенемия,
так как иммунные комплексы чаще всего
оседают в сосудистом русле. Это наблюдается
при некоторых заболеваниях, таких,
как системная красная волчанка, которая
обусловлена персистенцией аутоантигенов.
Часто, однако, несмотря на наличие
характерных морфологических изменений
и других признаков, свидетельствующих
о развитии иммунокомплексной болезни,
антиген остается неизвестным, например
при ревматоидном артрите, узелковом
периартериите, мембранозном гломерулонефрите
и некоторых васкулитах.
Местная
иммунокомплексная болезнь. Ее еще
называют реакцией Артюса. Она
заключается в местном некрозе ткани,
возникающем вследствие острого
иммунокомплексного васкулита. реакцию
можно вызвать в эксперименте путем
внутрикожного введения антигена
иммунному животному, которое имеет
циркулирующие антитела против
антигена. Вследствие избытка антител,
когда антиген проникает в стенки сосудов,
образуются крупные иммунные комплексы,
которые вызывают воспалительную реакцию.
В отличие от IgE-опосредованных реакций
гиперчувствительности I типа, которые
возникают немедленно, реакция Артюса
развивается в течение нескольких часов
и достигает пика через А—10
ч после инъекции. При иммунофлюоресцентном
окрашивании удается выявить комплемент,
иммуноглобулины и фибриноген, осажденные
в стенках сосудов, обычно венул; при
светооптическом исследовании —
фибриноидный некроз сосудов. Разрыв
сосудов приводит к возникновению
кровоизлияний, но чаще наблюдается
тромбоз, способствующий развитию
местных ишемических повреждений.
63.
РЕАКЦИИГИПЕРЧУВСТВИТЕЛЬНОСТИIVТИПАИММУНОКЛЕТОЧНЫЕРЕАКЦИИ
Реакции
гиперчувствительности IV типа вызывают
специфически сенсибилизированные
Т-лимфоциты. К реакциям этого типа
относятся классические замедленные
реакции гиперчувствительности,
вызываемые СD4+Т-лимфоцитами, и
прямая клеточная цитотоксичность,
опосредованная СD8+Т-лимфоцитами.
Это основной тип иммунного ответа на
различные внутриклеточные патогенные
агенты, особенно микобактерии туберкулеза,
а также на многие вирусы, грибы,
простейшие и паразиты. Другими примерами
являются контактная кожная чувствительность
к химическим веществам и реакция
отторжения. Описаны два варианта
реакций гиперчувствительности IV
типа.
Гиперчувствительность
замедленного типа (схема 29). Хорошо
известным примером такого варианта
является реакция на введенный внутрикожно
туберкулин — белково-липополисахаридный
компонент микобактерии туберкулеза. У
сенсибилизированного пациента через
8—12 ч возникают покраснение и уплотнение
в месте введения, а пик реакции наступает
через 24—72 ч. сильно сенсибилизированных
больных в месте инъекции может развиться
некроз. Гиперчувствительность замедленного
типа (ГЗТ) характеризуется накоплением
мононуклеарных клеток в дерме и подкожной
основе (подкожно-жировая клетчатка).
Наблюдается преимущественное накопление
клеток вокруг мелких вен и венул с
образованием характерных периваскулярных
манжеток. Увеличение сосудистой
проницаемости сопровождается
образованием пор между эндотелиальными
клетками. Выход белков плазмы за
пределы сосудистого русла увеличивает
отек дермы и сопровождается оседанием
фибрина в интерстиции. С помощью
иммунопероксидазного метода в участках
повреждений обнаруживается преобладание
СD4+Т-лимфоцитов-хелпе-ров.
Схема
29. РеакциигиперчувствительностиIVтипа—
гиперчувствительностьзамедленноготипа
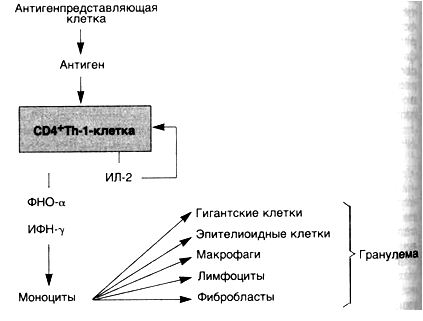 При
персистенции антигена макрофаги часто
трансформируются в эпителиоидные
клетки, которые окружает вал из лимфоцитов
— формируется гранулема. Такой тип
воспаления характерен для реакций
гиперчувствительности IV типа и называется
гранулематозным
воспалением.
Последовательность
событий при ГЗТ можно рассмотреть на
примере туберкулиновой реакции, которая
начинается с первой встречи индивидуума
с микобактериями туберкулеза.
CD4+T-лимфоциты распознают белки
туберкулезной микобактерий, связанные
с молекулами II класса на поверхности
моноцитов или других антигенпредставляющих
клеток. Эта первая встреча вызывает
дифференцировку СD4+Т-клеток в
Th-1-клетки. Образование Th-1 -клеток
является важным звеном в патогенезе
ГЗТ, так как ее дальнейшее развитие
зависит от цитокинов, которые секретируются
Th-1-клетками. У неиммунизированного
хозяина микроорганизмы впервые
подвергаются атаке макрофагами, что
приводит в некоторых случаях к продукции
ИЛ-12. Этот цитокин регулирует дифференцировку
СD4+Т-клеток в Th-1. Таким образом,
развитие ГЗТ может быть связано с
продукцией ИЛ-12. Сенсибилизированные
Th-1-клетки поступают в кровоток и остаются
там длительное время, иногда годами. В
ответ на инъекцию туберкулина
индивидууму, который имел раньше контакт
с микобактериями туберкулеза,
сенсибилизированные Th-1-клетки
взаимодействуют с антигеном на
поверхности антигенпредставляющих
клеток и активируются, например
подвергаются бласттрансформации и
пролиферации. Эти изменения сопровождаются
секрецией цитокинов, ответственных
за ГЗТ.
ИФН-7 является наиболее важным
медиатором ГЗТ и сильным активатором
макрофагов. Активированные макрофаги
обладают способностью к фагоцитозу
и уничтожают микроорганизмы. На
поверхности макрофагов имеются молекулы
II класса, с помощью которых они
способствуют представлению антигена.
Возрастает их активность, направленная
на элиминацию опухолевых клеток.
Макрофаги секретируют некоторые
полипептидные факторы роста, такие
как тромбоцитарный фактор роста и
трансформирующий фактор роста. Последний
стимулирует пролиферацию фибробластов
и усиливает синтез коллагена. Таким
образом, активированные макрофаги
обеспечивают элиминацию антигена, а
если активация продолжается, то
способствуют развитию фиброза и его
отграничению.
ИЛ-2 вызывает аутокринную
и паракринную пролиферацию Т-клеток,
которые аккумулируются в местах развития
ГЗТ, причем включение в инфильтрат
антигенспецифических CD4+T-лимфоцитов
активируется ИЛ-2.
ФНО-а и лимфотоксин
являются цитокинами, оказывающими
воздействие на эндотелиальные клетки.
Повышенная секреция простациклина
эндотелиальными клетками приводит к
увеличению кровотока в результате
вызываемого им расширения сосудов.
Наблюдается усиление экспрессии
адгезивной молекулы Е-селектина (ELAM-1),
что способствует прикреплению пришлых
лимфоцитов и моноцитов. Происходит
усиление секреции низкомолекулярных
хемотаксических факторов, например
ИЛ-8. Все эти изменения в эндотелии
способствуют выходу лимфоцитов и
моноцитов за пределы сосудистого русла
в места развития реакции ГЗТ. ФНО-а также
играет важную роль в образовании
гранулем.
Этот тип гиперчувствительности
является главным механизмом защиты
от различных внутриклеточных патогенных
агентов, включая микобактерии, грибы
и некоторых паразитов, а также может
участвовать в отторжении трансплантата
и опухолевом иммунитете.
Цитотоксичность,
опосредованная Т-лимфоцитами. При
данной цитотоксичности сенсибилизированные
СD8+Т-лимфоциты уничтожают
клетки-мишени, которые являются носителями
антигена. Такие эффекторные клетки
называют цитотоксическими Т-лимфоцитами
(ЦТЛ). Т-лимфоциты, направленные против
антигенов гистосовместимости на
поверхности клеток, играют важную роль
в отторжении трансплантата. Они также
участвуют в защите от вирусных инфекций.
В клетках, пораженных вирусом, вирусные
пептиды связываются с молекулами I
класса и в виде комплексов транспортируются
к поверхности клетки. Этот комплекс
распознается CD8+ЦТЛ. Лизис зараженных
клеток завершается до репликации
вируса, что приводит к уничтожению
инфекции. Полагают, что многие опухолевые
антигены также могут быть представлены
на поверхности клеток, а ЦТЛ могут
участвовать и в противоопухолевом
иммунитете.
Отторжениетрансплантата
В
отторжении трансплантата принимают
участие некоторые реакции
гиперчувствительности (схема 30). Реакция
отторжения зависит от распознавания
хозяином пересаженной ткани как
чужеродной. Антигенами, ответственными
за такое отторжение у человека, являются
антигены главного комплекса
гистосовместимости (HLA). Отторжение
трансплантата — сложный процесс, во
время которого имеют значение как
клеточный иммунитет, так и циркулирующие
антитела.
Схема
30. Отторжениетрансплантата
При
персистенции антигена макрофаги часто
трансформируются в эпителиоидные
клетки, которые окружает вал из лимфоцитов
— формируется гранулема. Такой тип
воспаления характерен для реакций
гиперчувствительности IV типа и называется
гранулематозным
воспалением.
Последовательность
событий при ГЗТ можно рассмотреть на
примере туберкулиновой реакции, которая
начинается с первой встречи индивидуума
с микобактериями туберкулеза.
CD4+T-лимфоциты распознают белки
туберкулезной микобактерий, связанные
с молекулами II класса на поверхности
моноцитов или других антигенпредставляющих
клеток. Эта первая встреча вызывает
дифференцировку СD4+Т-клеток в
Th-1-клетки. Образование Th-1 -клеток
является важным звеном в патогенезе
ГЗТ, так как ее дальнейшее развитие
зависит от цитокинов, которые секретируются
Th-1-клетками. У неиммунизированного
хозяина микроорганизмы впервые
подвергаются атаке макрофагами, что
приводит в некоторых случаях к продукции
ИЛ-12. Этот цитокин регулирует дифференцировку
СD4+Т-клеток в Th-1. Таким образом,
развитие ГЗТ может быть связано с
продукцией ИЛ-12. Сенсибилизированные
Th-1-клетки поступают в кровоток и остаются
там длительное время, иногда годами. В
ответ на инъекцию туберкулина
индивидууму, который имел раньше контакт
с микобактериями туберкулеза,
сенсибилизированные Th-1-клетки
взаимодействуют с антигеном на
поверхности антигенпредставляющих
клеток и активируются, например
подвергаются бласттрансформации и
пролиферации. Эти изменения сопровождаются
секрецией цитокинов, ответственных
за ГЗТ.
ИФН-7 является наиболее важным
медиатором ГЗТ и сильным активатором
макрофагов. Активированные макрофаги
обладают способностью к фагоцитозу
и уничтожают микроорганизмы. На
поверхности макрофагов имеются молекулы
II класса, с помощью которых они
способствуют представлению антигена.
Возрастает их активность, направленная
на элиминацию опухолевых клеток.
Макрофаги секретируют некоторые
полипептидные факторы роста, такие
как тромбоцитарный фактор роста и
трансформирующий фактор роста. Последний
стимулирует пролиферацию фибробластов
и усиливает синтез коллагена. Таким
образом, активированные макрофаги
обеспечивают элиминацию антигена, а
если активация продолжается, то
способствуют развитию фиброза и его
отграничению.
ИЛ-2 вызывает аутокринную
и паракринную пролиферацию Т-клеток,
которые аккумулируются в местах развития
ГЗТ, причем включение в инфильтрат
антигенспецифических CD4+T-лимфоцитов
активируется ИЛ-2.
ФНО-а и лимфотоксин
являются цитокинами, оказывающими
воздействие на эндотелиальные клетки.
Повышенная секреция простациклина
эндотелиальными клетками приводит к
увеличению кровотока в результате
вызываемого им расширения сосудов.
Наблюдается усиление экспрессии
адгезивной молекулы Е-селектина (ELAM-1),
что способствует прикреплению пришлых
лимфоцитов и моноцитов. Происходит
усиление секреции низкомолекулярных
хемотаксических факторов, например
ИЛ-8. Все эти изменения в эндотелии
способствуют выходу лимфоцитов и
моноцитов за пределы сосудистого русла
в места развития реакции ГЗТ. ФНО-а также
играет важную роль в образовании
гранулем.
Этот тип гиперчувствительности
является главным механизмом защиты
от различных внутриклеточных патогенных
агентов, включая микобактерии, грибы
и некоторых паразитов, а также может
участвовать в отторжении трансплантата
и опухолевом иммунитете.
Цитотоксичность,
опосредованная Т-лимфоцитами. При
данной цитотоксичности сенсибилизированные
СD8+Т-лимфоциты уничтожают
клетки-мишени, которые являются носителями
антигена. Такие эффекторные клетки
называют цитотоксическими Т-лимфоцитами
(ЦТЛ). Т-лимфоциты, направленные против
антигенов гистосовместимости на
поверхности клеток, играют важную роль
в отторжении трансплантата. Они также
участвуют в защите от вирусных инфекций.
В клетках, пораженных вирусом, вирусные
пептиды связываются с молекулами I
класса и в виде комплексов транспортируются
к поверхности клетки. Этот комплекс
распознается CD8+ЦТЛ. Лизис зараженных
клеток завершается до репликации
вируса, что приводит к уничтожению
инфекции. Полагают, что многие опухолевые
антигены также могут быть представлены
на поверхности клеток, а ЦТЛ могут
участвовать и в противоопухолевом
иммунитете.
Отторжениетрансплантата
В
отторжении трансплантата принимают
участие некоторые реакции
гиперчувствительности (схема 30). Реакция
отторжения зависит от распознавания
хозяином пересаженной ткани как
чужеродной. Антигенами, ответственными
за такое отторжение у человека, являются
антигены главного комплекса
гистосовместимости (HLA). Отторжение
трансплантата — сложный процесс, во
время которого имеют значение как
клеточный иммунитет, так и циркулирующие
антитела.
Схема
30. Отторжениетрансплантата
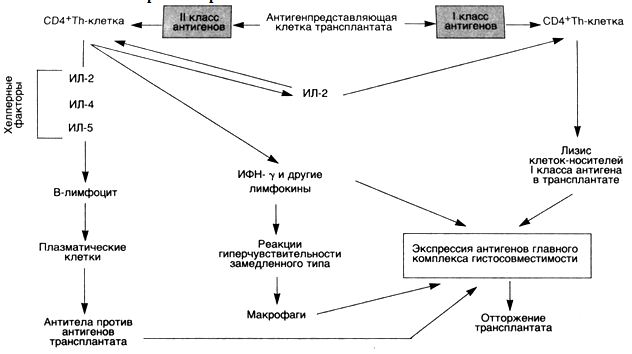 Реакции,
обусловленные Т-лимфоцитами. Активированные
СD4+Т-хелперы участвуют в активации
CD8+ ЦТЛ. Развитие реакций, опосредованных
Т-лимфоцитами, происходит при встрече
лимфоцитов реципиента с антигенами HLA
донора. Полагают, что наиболее важными
иммуногенами являются дендритические
клетки в донорских органах. Т-клетки
хозяина встречаются с дендритическими
клетками в пересаженном органе, а затем
мигрируют в регионарные лимфатические
узлы. Предшественники СШ+ЦТЛ (прекиллеры
Т-клеток), обладающие рецепторами к
HLA-антигенам I класса, дифференцируются
в зрелые ЦТЛ. Процесс дифференцировки
сложен и не совсем понятен. В нем участвуют
антигенпредставляющие клетки, Т-лимфоциты
и цитокины ИЛ-2, ИЛ-4 и ИЛ-5. Зрелые ЦТЛ
лизируют пересаженную ткань. Кроме
специфических ЦТЛ, образуются
лимфокинсекретирующие СО4+Т-лимфоциты,
которые играют исключительно важную
роль в отторжении трансплантата. Как и
при замедленной реакции
гиперчувствительности, активированные
СО4+Т-лимфоциты выделяют цитокины,
вызывающие повышение сосудистой
проницаемости и местное скопление
мононуклеарных клеток (лимфоцитов и
макрофагов). Считают, что ГЗТ, проявляющаяся
повреждением микрососудов, ишемией и
деструкцией тканей, является наиболее
важным механизмом деструкции
трансплантата. Более вероятно, однако,
что относительная важность цитотоксичности,
связанной с СБ8+Т-лимфоцитами, по
сравнению с реакциями, обусловленными
СО4+Т-лимфоцитами, зависит от
природы несоответствия HLA донора и HLA
реципиента.
Реакции,
обусловленные антителами. Эти
реакции могут протекать в двух
вариантах. Сверхострое отторжение
развивается в том случае, если в крови
реципиента имеются антитела против
донора. Такие антитела могут встречаться
у реципиента, у которого уже было
отторжение трансплантата. Предшествующие
переливания крови от HLA-неидентифицированных
доноров также могут привести к
сенсибилизации вследствие того, что
тромбоциты и лейкоциты особенно
богаты HLA-антигенами. В таких случаях
отторжение развивается немедленно
после трансплантации, так как циркулирующие
антитела образуют иммунные комплексы,
которые оседают в эндотелии сосудов
пересаженного органа. Затем происходит
фиксация комплемента и развивается
реакция Артюса.
У реципиентов, которые
не были предварительно сенсибилизированы
к антигенам трансплантата, экспозиция
донорских HLA-антигенов I и II класса
сопровождается образованием антител.
Антитела, образованные реципиентами,
могут вызывать повреждение с помощью
нескольких механизмов, в том числе
комплементзависимой цитотоксичности,
антителозависимого, обусловленного
клетками цитолиза и выпадения комплексов
антиген — антитело. Изначально
мишенью для этих антител служат сосуды
трансплантата, поэтому феномен
антителозависимого отторжения
(например, в почке) представлен васкулитом.
Реакции,
обусловленные Т-лимфоцитами. Активированные
СD4+Т-хелперы участвуют в активации
CD8+ ЦТЛ. Развитие реакций, опосредованных
Т-лимфоцитами, происходит при встрече
лимфоцитов реципиента с антигенами HLA
донора. Полагают, что наиболее важными
иммуногенами являются дендритические
клетки в донорских органах. Т-клетки
хозяина встречаются с дендритическими
клетками в пересаженном органе, а затем
мигрируют в регионарные лимфатические
узлы. Предшественники СШ+ЦТЛ (прекиллеры
Т-клеток), обладающие рецепторами к
HLA-антигенам I класса, дифференцируются
в зрелые ЦТЛ. Процесс дифференцировки
сложен и не совсем понятен. В нем участвуют
антигенпредставляющие клетки, Т-лимфоциты
и цитокины ИЛ-2, ИЛ-4 и ИЛ-5. Зрелые ЦТЛ
лизируют пересаженную ткань. Кроме
специфических ЦТЛ, образуются
лимфокинсекретирующие СО4+Т-лимфоциты,
которые играют исключительно важную
роль в отторжении трансплантата. Как и
при замедленной реакции
гиперчувствительности, активированные
СО4+Т-лимфоциты выделяют цитокины,
вызывающие повышение сосудистой
проницаемости и местное скопление
мононуклеарных клеток (лимфоцитов и
макрофагов). Считают, что ГЗТ, проявляющаяся
повреждением микрососудов, ишемией и
деструкцией тканей, является наиболее
важным механизмом деструкции
трансплантата. Более вероятно, однако,
что относительная важность цитотоксичности,
связанной с СБ8+Т-лимфоцитами, по
сравнению с реакциями, обусловленными
СО4+Т-лимфоцитами, зависит от
природы несоответствия HLA донора и HLA
реципиента.
Реакции,
обусловленные антителами. Эти
реакции могут протекать в двух
вариантах. Сверхострое отторжение
развивается в том случае, если в крови
реципиента имеются антитела против
донора. Такие антитела могут встречаться
у реципиента, у которого уже было
отторжение трансплантата. Предшествующие
переливания крови от HLA-неидентифицированных
доноров также могут привести к
сенсибилизации вследствие того, что
тромбоциты и лейкоциты особенно
богаты HLA-антигенами. В таких случаях
отторжение развивается немедленно
после трансплантации, так как циркулирующие
антитела образуют иммунные комплексы,
которые оседают в эндотелии сосудов
пересаженного органа. Затем происходит
фиксация комплемента и развивается
реакция Артюса.
У реципиентов, которые
не были предварительно сенсибилизированы
к антигенам трансплантата, экспозиция
донорских HLA-антигенов I и II класса
сопровождается образованием антител.
Антитела, образованные реципиентами,
могут вызывать повреждение с помощью
нескольких механизмов, в том числе
комплементзависимой цитотоксичности,
антителозависимого, обусловленного
клетками цитолиза и выпадения комплексов
антиген — антитело. Изначально
мишенью для этих антител служат сосуды
трансплантата, поэтому феномен
антителозависимого отторжения
(например, в почке) представлен васкулитом.
64. Иммунодефициты — это нарушения нормального иммунного статуса, обусловленные дефектом одного или нескольких механизмов иммунного ответа. Различают первичные, или врожденные (генетические), и вторичные, или приобретенные, иммунодефициты. Первичные, или врожденные, иммунодефициты. В качестве первичных иммунодефицитов выделяют такие состояния, при которых нарушение иммунных гуморальных и клеточных механизмов связано с генетическим блоком, т. е. генетически обусловлено неспособностью организма реализовывать то или иное звено иммунологической реактивности. Расстройства иммунной системы могут затрагивать как основные специфические звенья в функционировании иммунной системы, так и факторы, определяющие неспецифическую резистентность. Возможны комбинированные и селективные варианты иммунных расстройств. В зависимости от уровня и характера нарушений различают гуморальные, клеточные и комбинированные иммунодефициты. Врожденные иммунодефицитные синдромы и заболевания представляют собой довольно редкое явление. Причинами врожденных иммунодефицитов могут быть удвоение хромосом, точечные мутации, дефектферментов обмена нуклеиновых кислот, генетически обусловленные нарушения мембран, повреждения генома в эмбриональном периоде и др. Как правило, первичные иммунодефицита проявляются на ранних этапах постнатального периода и наследуются по аутосомно-рецессивному типу. Проявляться первичные иммунодефициты могут в виде недостаточности фагоцитоза, системы комплемента, гуморального иммунитета (В-системы), клеточного иммунитета (Т-системы) или же в виде комбинированной иммунологической недостаточности. Вторичные, или приобретенные, иммунодефициты Вторичные иммунодефициты в отличие от первичных развиваются у лиц с нормально функционировавшей от рождения иммунной системой. Они формируются под воздействием окружающей среды на уровне фенотипа и обусловлены нарушением функции иммунной системы в результате различных заболеваний или неблагоприятных воздействий на организм. При вторичных иммунодефицитах могут поражаться Т- и В-системы иммунитета, факторы неспецифической резистентности, возможны также их сочетания. Вторичные иммунодефициты встречаются значительно чаще, чем первичные. Вторичные иммунодефицита, как правило, преходящи и поддаются иммунокоррекции, т. е. восстановлению нормальной деятельности иммунной системы. Вторичные иммунодефицита могут быть: после перенесенных инфекций (особенно вирусных) и инвазий (протозойные и гельминтозы); при ожоговой болезни; при уремии; при опухолях; при нарушении обмена веществ и истощении; при дисбиозах; при тяжелых травмах, обширных хирургических операциях, особенно выполняемых под общим наркозом; при облучении, действии химических веществ; при старении, а также медикаментозные, связанные с приемом лекарств. По времени возникновения выделяют антенатальные (например, ненаследственные формы синдрома ДиДжорджи), перинатальные (например, нейтропения новорожденного, вызванная изосенсибилизацией матери к антигенам нейтрофилов плода) и постнатальные вторичные иммунодефицита. По клиническому течению выделяют компенсированную, субкомпенсированную и декомпенсированную формы вторичных иммунодефицитов. Компенсированная форма сопровождается повышенной восприимчивостью организма к инфекционным агентам, вызывающим оппортунистические инфекции. Субкомпенсированная форма характеризуется склонностью к хронизации инфекционных процессов. Декомпенсированная форма проявляется в виде генерализованных инфекций, вызванных условно-патогенными микробами (УПМ) и злокачественными новообразованиями. Известно разделение вторичных иммунодефицитов на: Физиологические, новорожденные,пубертатного периода, беременности и лактации,старения,биоритмичности,экологические, сезонные, эндогенные интоксикации, радиационные,СВЧ, патологические, постинфекционные, стрессовые, регуляторно-метаболические, медикаментозные, онкологические. Иммунодефициты, как первичные, так иособенно вторичные, широко распространены среди людей. Они являются причиной проявления многих болезней и патологических состояний, поэтому требуют профилактики и лечения с помощью иммунотропных препаратов.
65. Онкопатология занимает второе место после сердечно-сосудистых заболеваний среди причин смерти в цивилизованных странах. Опухоли (новообразования) возникают, когда по каким-либо причинам наблюдается неконтролируемая избыточная пролиферация клеток. Обычно во всех органах и тканях поддерживается баланс между процессами гибели клеток и их новообразованием. Это обеспечивается механизмами контроля и регуляции гомеостаза тканей.
Главной отличительной особенностью опухолевых клеток от нормальных является способность к неограниченному росту и потеря механизмов аутокринной и паракринной регуляции. Для злокачественных клеток также характерна инвазия окружающих тканей и метастазирование в отдаленные участки организма. Распространение опухолевых клеток происходит по лимфатическим путям и через кровоток.
Опухоли способны возникать спонтанно, без видимых на то причин, а также могут быть индуцированы. У человека, как правило, появляющиеся опухоли – это спонтанные, хотя отличить спонтанно возникшую опухоль от индуцированной чрезвычайно трудно. Опухоли, искусственно вызванные, называются индуцированными. Индуцировать канцерогенез способны различные химические вещества (метилхолантрен, бензпирен, афлатоксин В1), физические факторы (ультрафиолетовый свет, ионизирующая радиация), вирусы (папова-, герпес-, адено- и ретровирусы). У человека 3 типа вирусов тесно связаны с опухолями, это вирус Эпштейна-Барр (лимфома Беркита), цитомегаловирус (саркома Капоши) и вирус папилломы.
Иммунологические исследования показали, что на опухолевых клетках могут быть представлены два вида антигенов: опухолеспецифические антигены и опухолеассоциированные антигены. Опухолеспецифические антигены являются уникальными молекулами для организма и не присутствуют ни в один из периодов развития, в том числе и эмбриональный, на нормальных клетках организма. Полагают, они являются результатом мутаций в геноме опухолевых клеток, приводящих к формированию новых клеточных белков, которые, подвергаясь процессингу в цитозоле клетки, дают начало опухолевым пептидам, представленным на клеточной поверхности в комплексе с молекулами HLA-1 класса. Опухолеассоциированные белки (антигены), в свою очередь, не являются строго специфическими для опухолевых клеток, и, как правило, являются белками, которые были экспрессированы на нормальных клетках в эмбриональный период или являются молекулами, которые экспрессированы обычно на нормальных клетках, но в очень малых количествах, а при злокачественной трансформации клеток экспрессируются в высокой плотности. Реэкспресия эмбриональных генов или чрезмерная активация регуляторных генов в нормальных зрелых клетках, вероятно, является результатом тех изменений, которые происходят в геноме при злокачественной трансформации клеток. Известные к настоящему времени некоторые опухолеспецифические антигены суммированы в таблицах
Исследования показали, что гены, кодирующие опухолеспецифические антигены, часто отличаются от нормальных генов только одной точечной мутацией. Преобладающее большинство опухолевых антигенов не являются мембранными белками клеток, а представляют собой пептиды, прошедшие процессинг в цитозоле клетки и представленные молекулами HLA- 1 класса
Специфические антигены вирусиндуцированных опухолей, как правило, представлены вирусными пептидами. Это подтверждается множеством данных. Так, установлено, что отдельный штамм вируса (например, SV-40)индуцирует одинаковые опухолевые антигены на различных тканях и у различных видов организмов. Эти антигены одинаковы для всех трансформированных клеток. Другой пример – мыши, которым были ранее введены убитые клетки из опухоли, индуцированной вирусом полиомы, при повторном введении им живых клеток любой другой опухоли, индуцированной этим же вирусом, способны элиминировать их с помощью иммунных механизмов. Более того, при переносе лимфоцитов от животных с вирус-индуцированной опухолью нормальным сингенным животным, у последних развивалась невосприимчивость к трансплантатам всех опухолей, индуцированных тем же вирусом. У человека клетки лимфомы Беркета экспрессируют ядерный антиген вируса Эпштейн-Барра, который, как полагают, является опухолеспецифическим для этого вида опухоли. На раковых клетках шейки матки более чем в 90% случаев выявляются белки Е6 и Е7 вируса папилломы человека (HPV).
Опухолеассоциированные белки (антигены) не являются уникальными для опухолевых клеток. Они представлены антигенами двух типов. Представителями первого типа являются раково-эмбриональные антигены. Из них наиболее изучены альфа-фетопротеин (АФП) и раковоэмбриональный антиген (РЭА). Эти антигены (белки) появляются в норме в эмбриональном периоде развития индивидуума и участвуют как регуляторные белки в дифференцировке тканей и развитии органов.
Альфа-фетопротеин впервые был обнаружен в фетальной сыворотке теленка. Он вырабатывается преимущественно гепатоцитами, а также клетками желудочно-кишечного тракта. Представляет собой гликопротеин м.м. 70 кD. У плода человека его концентрация составляет 3000 мкг/мл, у взрослого 0,02 мкг/мл. Повышение содержания АФП в сыворотке больного в 80 % случаев свидетельствует о первичном раке печени. Повышение концентрации АФП может также выявляться у 20% лиц, страдающих гепатитом и циррозом печени. Повышение его количества во время беременности может служить сигналом нарушения развития плода.
Раково-эмбриональный антиген (РЭА) является мембранным гликопротеином. Экспрессируется в норме на гастроинтестинальных клетках и клетках печени плода на 2-6 месяце внутриутробного развития. У взрослых в норме не выявляется. Его появление в сыворотке свидетельствует с 90% вероятностью о карциноме толстой кишки, а также карциноме поджелудочной железы.
Другая категория опухолеассоциированных белков, как правило, представлена факторами роста и рецепторами для этих факторов. Известно, что рецепторы к факторам роста в повышенной плотности почти всегда экспрессированы на опухолевых клетках. Например, различные опухолевые клетки экспрессируют в 100 раз больше рецепторов к эпидермальному фактору роста, чем нормальные клетки. Клетки рака груди человека в повышеном количестве продуцируют белок HER2, кодируемый онкогеном Neu, являющийся структурным компонентом рецептора эпидермального фактора роста. На нормальных клетках этот белок экспрессируется в следовых количествах. Клетки меланомы экспрессируют порядка 50 000 – 500 000 молекул белка р97, участвующего в транспорте железа в клетку. На обычной клетке этих молекул содержится порядка 8 000. Следует заметить, что тип опухолевых антигенов определяет иммуногенность и антигенность опухолей.
66. Аутоиммунные заболевания — это класс разнородных по клиническим проявлениям заболеваний, развивающихся вследствие патологической выработки аутоиммунных антител или размножения аутоагрессивных клонов киллерных клеток против здоровых, нормальных тканей организма, приводящих к повреждению и разрушению нормальных тканей и к развитию аутоиммунного воспаления.
|
