
- •Азотистая кислота hno2
- •Химические свойства азотистой кислоты
- •III. Восстановительные свойства
- •1) Взаимодействием щелочей с оксидом азота(III)
- •2) Восстановлением нитратов
- •2) Взаимодействует с неметаллами
- •Получение азотной кислоты в промышленности
- •I. Окисление аммиака
- •II. Окисление no воздухом
- •III. Поглощение no2 водой
- •Применение азотной кислоты
- •Соли азотной кислоты – нитраты Me(no3)X
- •Фосфор p4 физические свойства фосфора
- •Химические свойства фосфора
- •1) Самовоспламеняется на воздухе со свечением
- •Получение фосфина
- •1) Гидролиз фосфидов
- •2) Действием кислот на фосфиды
- •3) Действием концентрированной щелочи на белый фосфор
- •1) Характерные свойства кислот
- •Фосфорные удобрения
- •2. Двойной суперфосфат – Ca(h2po4)2
- •3. Преципитат – CaHpo4·2h2o
- •Применение соединений фосфора
Химические свойства фосфора
Фосфор более
активен, чем азот N2,
так как атомы в структуре P4
связаны одинарными связями, а в молекуле
азота атомы связаны тройной связью
![]() .
.
1) Взаимодействует с металлами при повышенной температуре с образованием фосфидов
Mg + P Combin Mg3P2 фосфид магния
2) Взаимодействует с кислородом
P + O2(недостаток) → P2O3
P + O2(избыток) → P2O5
С водородом НЕ взаимодействует!
4) Взаимодействует с серой
P + S → P2S3 сульфид фосфора(III)
5) Взаимодействует с галогенами
P + Cl2(недостаток) → PCl3 хлорид фосфора(III)
P + Cl2(избыток) → PCl5 хлорид фосфора(V)
Галогениды фосфора легко гидролизуются:
PCl3 + Н2O → H3PO3 + HCl
PBr5 + Н2O Combin H3PO4 + HBr
6) Взаимодействует с водой при нагревании и в присутствии катализатора
P + Н2O Combin H3PO4 + H2 катализатор – медный порошок, температура 700 °С
7) Взаимодействует с кислотами-окислителями
P + HNO3(конц) → H3PO4 + NO2 + H2O
P + HNO3(разб) → H3PO4+ NO
P + H2SO4(конц) → H3PO4 + SO2 + H2O
C другими кислотами НЕ реагирует
8) Со щелочами диспропорционирует
P + Ba(OH)2 + H2O Combin PH3 + Ba(H2PO2)2 гипофосфит бария
ПОЛУЧЕНИЕ ФОСФОРА
Прокаливанием фосфорита с песком и углем в электропечи
Ca3(PO4)2 + SiO2 + C Combin CaSiO3 + CO + P
Пары фосфора затем конденсируются под водой
ФОСФИН PН3
ФИЗИЧЕСКИЕ СВОЙСТВА ФОСФИНА
РН3 – бесцветный газ с запахом гнилой рыбы. tкип = -88 °С, tпл = -133 °С. Довольно хорошо растворим в воде, но хуже, чем аммиак NH3. ОЧЕНЬ ЯДОВИТ! Летальный исход наступает после получасового пребывания в атмосфере с концентрацией PH3 0,05 мг/л.
ХИМИЧЕСКИЕ СВОЙСТВА ФОСФИНА
1) Самовоспламеняется на воздухе со свечением
PH3 + O2 → P2O5 + H2O → H3PO4
Чистый фосфин загорается на воздухе только при 150 °С, но обычно в качестве примеси он содержит следы более активного дифосфина (P2H4) и поэтому самовоспламеняется на воздухе при комнатной температуре.
2) Взаимодействует с очень сильными кислотами подобно аммиаку
PH3 + HJ → PH4J йодид фосфония
3) Является очень сильным восстановителем. Окисляется обычно до H3PO4
PH3 + KMnO4 + H2SO4 → H3PO4 + MnSO4 + K2SO4 + H2O
Получение фосфина
1) Гидролиз фосфидов
Mg3P2 + HOH → PH3↑ + Mg(OH)2
2) Действием кислот на фосфиды
Mg3P2 + HCl → PH3↑ + MgCl2
3) Действием концентрированной щелочи на белый фосфор
P + NaOH + H2O → PH3↑ + Na2HPO2 гипофосфит натрия
Наряду с фосфином образуется дифосфин P2H4,который воспламеняется на воздухе еще легче, чем фосфин. Это обуславливает появление блуждающих огней на болотах и старых кладбищах (фосфин образуется за счет биохимического восстановления органических фосфорных эфиров и фосфата кальция, содержащегося в костях).
ПРИМЕНЕНИЕ ФОСФИНА
Фосфин применяется в синтезе фосфорорганических соединений и высокочистого фосфора.
Кислородсодержащие соединения фосфора
ФОСФОРИСТЫЙ АНГИДРИД P2O3
Истинная формула фосфористого ангидрида – Р4О6
Ф ИЗИЧЕСКИЕ
СВОЙСТВА P2O3
ИЗИЧЕСКИЕ
СВОЙСТВА P2O3
P2O3 – белые кристаллы или хлопья с неприятным запахом. tпл = 23,8 °С, tкип = 175 °С. Хорошо растворяется в органических растворителях (бензол, сероуглерод). Неустойчив на свету, вначале желтеет, а затем краснеет. ОЧЕНЬ ЯДОВИТ!
Х![]() ИМИЧЕСКИЕ
СВОЙСТВА P2O3
ИМИЧЕСКИЕ
СВОЙСТВА P2O3
1) Медленно растворяется в холодной воде
P2O3 + H2O → H3PO3 фосфористая кислота
2) С горячей водой реагирует быстро
P2O3 + H2O Combin P↓ + PH3↑ + H3PO4 фосфорная кислота
3) Реагирует со щелочами
P2O3 + NaOH → Na2HPO3 + H2O
Так как фосфористая кислота – двухосновная, то в подобных реакциях замещается только два атома водорода.
Na3PO3 в таких реакциях не образуется.
4) Легко окисляется на воздухе со свечением
P2O3 + O2 → P2O5
Соединения P+3 – сильные восстановители, окисляются до Р+5. ОЧЕНЬ ЯДОВИТЫ.
ПОЛУЧЕНИЕ P2O3
1) Окислением фосфора в недостатке кислорода
P + O2 → P2O3
2) Осторожное окисление белого фосфора
P + N2O Combin P2O3 + N2
ФОСФОРНЫЙ АНГИДРИД P2O5
И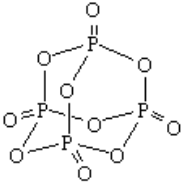 стинная
формула фосфористого ангидрида – Р4О10
стинная
формула фосфористого ангидрида – Р4О10
ФИЗИЧЕСКИЕ СВОЙСТВА P2O5
P2O5 – белый кристаллический порошок. Возгоняется при 360 °С. Очень сильно поглощает влагу.
ХИМИЧЕСКИЕ СВОЙСТВА P2O5
1) Взаимодействует с водой. В зависимости от количества воды образуются разные кислоты
P2O5 + H2O → 2HPO3 метафосфорная кислота
P2O5 + 2H2O → H4P2O7 пирофосфорная кислота
P2O5 + 3H2O → 2H3PO4 ортофосфорная кислота
При разбавлении водой стекловидная масса метафосфорной кислоты превращается в ортофосфорную кислоту:
HPO3 + 3H2O → H3PO4
2) Отнимает воду у других соединений
P2O5 + HNO3 → HPO3 + P2O5
P2O5 + HClO4 → (HPO3)4 + Cl2O7
3) Проявляет свойства кислотных оксидов
NaOH + P2O5 → Na3PO4 + H2O
K2O + P2O5 → K3PO4
ПОЛУЧЕНИЕ P2O5
1) Горение фосфора в избытке кислорода
P + O2 → P2O5
2) Окисление Р2О3
P2O3 + O2 → P2O5
орто-ФОСФОРНАЯ КИСЛОТА H3PO4
ФИЗИЧЕСКИЕ СВОЙСТВА H3PO4
H3PO4 – бесцветные гигроскопичные кристаллы. tпл = 42 °С, tкип = 158 °С. Очень хорошо растворяется в воде.
Не ядовита. Обычно применяют 85 %-й водный раствор – бесцветную сиропообразную жидкость без запаха.
ПОЛУЧЕНИЕ H3PO4
1) Обработкой природных фосфоритов серной кислотой
Ca3(PO4)2 + H2SO4 → CaSO4↓ + H3PO4
2) Растворение фосфорного ангидрида в воде
P2O5 + H2O → H3PO4
3) Растворение фосфора в 30 %-й азотной кислоте
P + HNO3 + H2O → H3PO4 + NO
4) Гидролизом галогенидов фосфора(V)
PCl5 + Н2O Combin H3PO4 + HCl
ХИМИЧЕСКИЕ СВОЙСТВА H3PO4
Фосфорная кислота – это кислота средней силы.
