
- •Азотистая кислота hno2
- •Химические свойства азотистой кислоты
- •III. Восстановительные свойства
- •1) Взаимодействием щелочей с оксидом азота(III)
- •2) Восстановлением нитратов
- •2) Взаимодействует с неметаллами
- •Получение азотной кислоты в промышленности
- •I. Окисление аммиака
- •II. Окисление no воздухом
- •III. Поглощение no2 водой
- •Применение азотной кислоты
- •Соли азотной кислоты – нитраты Me(no3)X
- •Фосфор p4 физические свойства фосфора
- •Химические свойства фосфора
- •1) Самовоспламеняется на воздухе со свечением
- •Получение фосфина
- •1) Гидролиз фосфидов
- •2) Действием кислот на фосфиды
- •3) Действием концентрированной щелочи на белый фосфор
- •1) Характерные свойства кислот
- •Фосфорные удобрения
- •2. Двойной суперфосфат – Ca(h2po4)2
- •3. Преципитат – CaHpo4·2h2o
- •Применение соединений фосфора
2) Взаимодействует с неметаллами
При этом азот обычно восстанавливается до NO или NO2:
S + HNO3(конц) → H2SO4 + NO2 + H2O
S + HNO3(разб) → H2SO4 + NO
P + HNO3(конц) → H3PO4 + NO2 + H2O
P + HNO3(разб) → H3PO4 + NO
C + HNO3(конц) → CO2 + NO2 + H2O
Некоторые органические соединения (например амины, гидразин, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
Получение азотной кислоты в промышленности
Азотная кислота является одним из самых крупнотоннажных продуктов химической промышленности.
I. Окисление аммиака
NH3 + O2→ NO + H2O Катализатор – платиновая сетка, t = 750 °C
II. Окисление no воздухом
NO + O2Combin NO2
III. Поглощение no2 водой
NO2 + H2O + O2 → HNO3
Полученная кислота имеет концентрацию 40–60 %. Ее перегоняют с серной кислотой – испаряется только HNO3.
Перевозят и хранят разбавленную азотную кислоту в хромированной стали, концентрированную – в алюминиевой таре.
Применение азотной кислоты
1. В ювелирном деле — основной способ определения золота в золотом сплаве;
2. В производстве минеральных удобрений;
3. В военной промышленности (дымящая — в производстве взрывчатых веществ, как окислитель ракетного топлива, разбавленная — в синтезе различных веществ, в том числе отравляющих);
4. В станковой графике — для травления печатных форм (офортных досок, цинкографических типографских форм и магниевых клише);
5. В производстве пластмасс, красителей и лекарств (нитроглицерин);
6. Как окислитель в химических синтезах (смесь концентрированной серной и азотной кислот – "нитрующая смесь").
Соли азотной кислоты – нитраты Me(no3)X
Нитраты – белые кристаллические вещества, ВСЕ хорошо растворимы в воде.
Нитраты калия, натрия, кальция, аммония – селитры – используются как удобрения. KNO3, NH4NO3 – в пиротехнике.
Черный порох – это смесь калиевой селитры, древесного угля и серы. Реакция горения черного пороха:
KNO3 + C + S → KNO2 + CO2 + SO2 побочными продуктами являются K2SO4, K2S, K2CO3, CO, N2
При нагревании все нитраты разлагаются. Состав продуктов разложения зависит от положения металла в электрохимическом ряду напряжения:
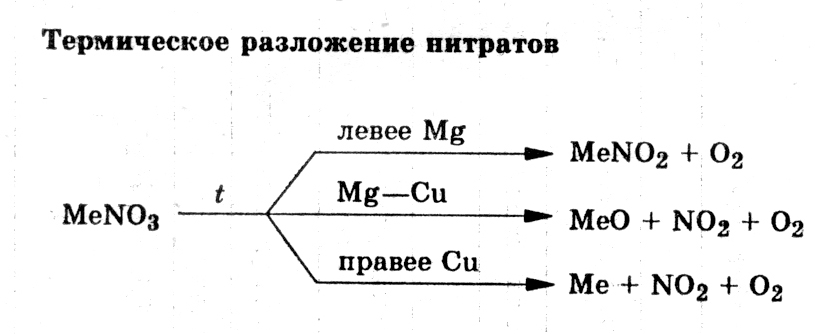
NH4NO3 Combin N2O + H2O взрывается без детонатора
NH4NO3 Combin N2 + H2O + O2 взрывается с детонатором
Фосфор p4 физические свойства фосфора
Фосфор существует в виде трех основных аллотропных модификаций (всего их у фосфора около 11):
1 .
Белый фосфор – белое
кристаллическое вещество со своеобразным
запахом.
.
Белый фосфор – белое
кристаллическое вещество со своеобразным
запахом.
tпл = 44 °С, tкип = 280 °С. Существует в виде молекул Р4.
Нерастворим в воде. Мягкий. Летучий. Легко воспламеняется (уже при 40 °С). Окисление на воздухе сопровождается свечением. ОЧЕНЬ ЯДОВИТ (даже через кожу)! Он способен аккумулироваться в организме и вызывать некроз костных тканей (особенно челюстей). Смертельная доза – 0,05…0,15 г.
Очень активен химически, поэтому его хранят под водой и в темноте.
Получается при быстром охлаждении паров красного фосфора.
2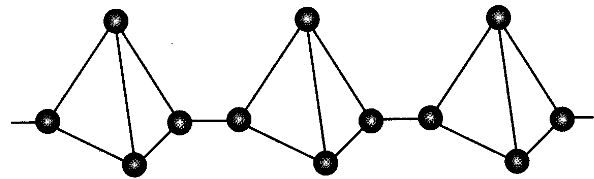 . Красный
фосфор – красно-фиолетовое
мелкокристаллическое вещество,
нерастворимое в воде. Не токсичен, не
светится. Менее реакционноспособен.
Воспламеняется только при температуре
210 °С. Обладает полимерной структурой
Рn.
. Красный
фосфор – красно-фиолетовое
мелкокристаллическое вещество,
нерастворимое в воде. Не токсичен, не
светится. Менее реакционноспособен.
Воспламеняется только при температуре
210 °С. Обладает полимерной структурой
Рn.
П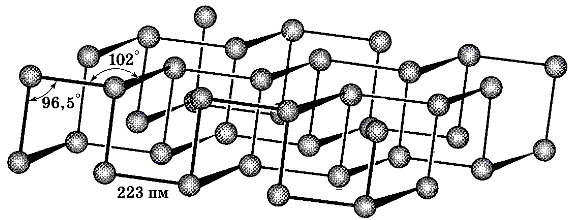 олучается
при длительном (50 ч) нагревании белого
фосфора (280 °С).
олучается
при длительном (50 ч) нагревании белого
фосфора (280 °С).
3. Черный фосфор –наиболее устойчивая форма элемента – черное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Поджечь черный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Черный фосфор проводит электрический ток и имеет свойства полупроводника. Температура плавления черного фосфора – 1000 °С под давлением 18·105 Па. Воспламеняется при температуре 500 °С. Не ядовит, малоактивен.
Получается из белого фосфора при 220 °С и давлении 1,2 ГПа (13000 атм)
