
1. Решение
1. Процесс диссоциации заключается в том, что двухатомные молекулы под действием внешних условий электрического, механического, физического или термодинамического характера, распадаются на отдельные атомы.
2. Предположим далее, что в исходном состоянии в рассматриваемом объеме содержалось N двухатомных молекул водорода. После диссоциации будет иметь место смесь двух газов: молекулярного и атомарного водорода, причем 40% от общего количества будут составлять двухатомные молекулы, а 60% одноатомные. Пусть масса одного атома водорода равна m0, в этом случае массы этих газов, составляющих смесь, можно представить следующим образом
![]() ,
(1)
,
(1)
где М первоначальная масса недиссоциированного водорода, m1 конечная масса недиссоциированного газа, m2 масса диссоциированного газа.
3. Уравнение удельной теплоёмкости сV смеси запишется в этом случае следующим образом
![]() ,
(2)
,
(2)
где i1 = 5 число степеней свободы недиссоциированной молекулы водорода, i2 = 3 число степеней свободы диссоциированных одноатомных молекул, 1 = 210 3 кг/моль молярная масса водорода Н2, 1 = 110 3 кг/моль молярная масса атомарного водорода Н.
4. Подставим числовые данные величин в уравнение (2)
![]() .
(3)
.
(3)
2.1.11. Найти показатель адиабаты для смеси газов, состоящей из m1 = 10 г гелия и m2 = 4 г водорода.
Решение
1. Определим удельные теплоёмкости смеси газов cp и cV с учётом того, что: i1 = 3, 1 = 410 3 кг/моль, i2 = 5, 2 = 210 3 кг/моль
![]() ,
(1)
,
(1)
![]() ,
(2)
,
(2)
![]() ,
(3)
,
(3)
![]() .
(4)
.
(4)
2. Определим показатель адиабаты смеси гелия и водорода
![]() .
(5)
.
(5)
2.1.12. Смесь газов состоим из азота и аргона, взятых в одинаковых объемах. Определить показатель адиабаты этой смеси.
Решение
1. Для определения удельной теплоёмкости смеси cV воспользуемся уравнением (2) задачи 2.1.5
![]() ,
(1)
,
(1)
![]() .(2)
.(2)
2. Удельную теплоёмкость смеси cp определим по уравнению (1) задачи 2.1.8
сp =
=
 .
(3)
.
(3)
![]() .
(4)
.
(4)
3. Определим показатель адиабаты
![]() .
(5)
.
(5)
2.1.13. Определить показатель адиабаты для смеси водорода и неона, взятых в одинаковых объемах и находящихся в равных условиях.
Решение
1. Неон с 1 = 2010 3 кг/моль, будучи инертным газом, обладает одноатомной молекулой, имеющей три степени свободы i1 = 3, водородная молекула состоит из двух атомов, 2 = 210 3 кг/моль, i2 = 5.
2. Поскольку объемы составляющих смеси одинаковы, то уместно воспользоваться уравнениями (2) и (3) предыдущей задачи
![]() ,
(1)
,
(1)
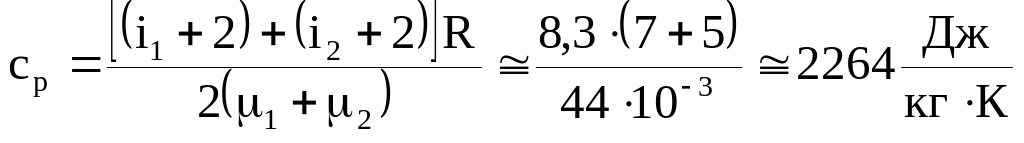 .
(2)
.
(2)
3. Определим далее показатель адиабаты для заданной смеси газов
![]() .
(3)
.
(3)
2.1.14. Найти показатель адиабаты смеси газов , содержащей водород и неон в одинаковых массовых долях = 0,5.
Решение
1. Запишем параметры газов, составляющих заданную смесь: водород Н2 1 = 210 3 кг/моль, i1 = 5; неон Ne 2 = 2010 3 кг/моль, i2 =3.
2. Определим удельные теплоёмкости смеси по аналогии с уравнением (1) задачи 2.1.8
![]() ,
(1)
,
(1)
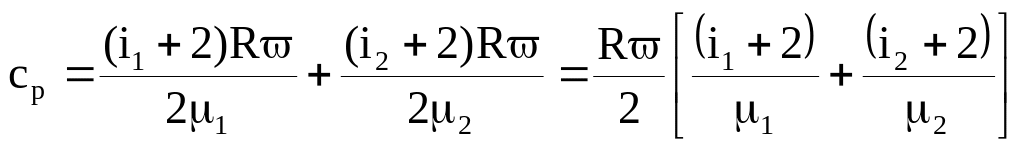 ,
(2)
,
(2)
![]() .
(3)
.
(3)
3. вычислим показатель адиабаты смеси водорода и неона
![]() .
(4)
.
(4)
2.1.15. Определить показатель адиабаты частично диссоциированного газообразного азота N2, степень диссоциации которого равна =0,4.
Решение
1. Для решения задачи воспользуемся результатами анализа, проведенного в задаче 2.1.10
![]() ,
(1)
,
(1)
![]() ,
(2)
,
(2)
где 1 = 2810 3 кг/моль, 2 = 1410 3 кг/моль молярные массы недиссоциированного и диссоциированного газа, соответственно, i1 = 5, i2 = 3 степени свободы двухатомных и одноатомных молекул.
2. Подставим параметры газов в уравнение (2)
![]() .
(3)
.
(3)
3. Определим далее величину удельной теплоёмкости смеси ср
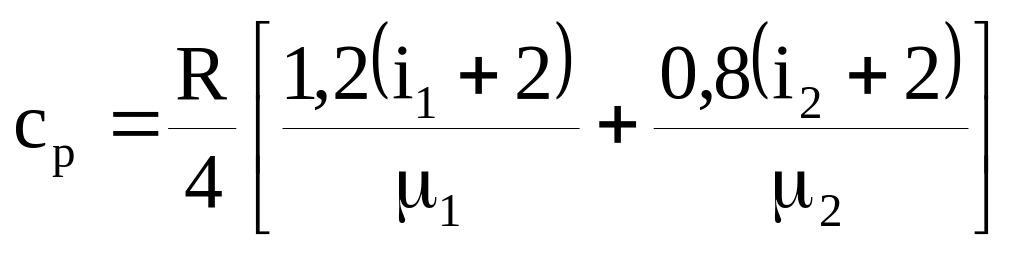 .
(4)
.
(4)
![]() .
(5)
.
(5)
4. Найдём величину показателя адиабаты
![]() .
(6)
.
(6)
2.1.16. Определить степень диссоциации газообразного хлора Cl2, если показатель адиабаты такого частично диссоциированного газа равен = 1,55.
Решение
1. Будем считать, что масса недиссоциированных двухатомных молекул хлора равна m1 = (1 )2m0N, масса диссоциированных одноатомных молекул, при этом, составляет m2 = m0N, где m0 масса атома хлора, N начальное число недиссоциированных молекул. Молярную массу недиссоциированных молекул примем равной , а диссоциированных 0,5 , число степеней свободы молекул будет соответственно равно i1 = 5, i2 = 3.
2. В соответствии с принятыми обозначениями запишем уравнения для удельных теплоёмкостей cp и cV
![]() ,
(1)
,
(1)
![]() ,
(2)
,
(2)
![]() ,
(3)
,
(3)
![]() ,
(4)
,
(4)
![]() .
(5)
.
(5)
3. Запишем далее уравнение показателя адиабаты
![]() .
(6)
.
(6)
4. Разрешим уравнение (6) относительно
![]() .
(7)
.
(7)
2.1.17. Кислород О2 массой m = 0,16 кг нагревают на Т = 12 К, затрачивая Q = 1744 Дж теплоты. Определить, протекал ли процесс при постоянном давлении или при постоянном объёме?
Решение
1. Определим удельные теплоёмкости кислорода сp и сV
![]() ,
(1)
,
(1)
![]() .
(2)
.
(2)
2. Количество тепла, требуемое на нагревание газа, в случае постоянства его объёма или давления определяется уравнениями
![]() ,
(3)
,
(3)
Таким образом, процесс, судя по всему, протекал при постоянном давлении.
2.1.18. При адиабатном сжатии газа его объём уменьшился в n = 10 раз, давление при этом возросло в k = 21,4 раза. Определить отношение теплоёмкостей этого газа Ср/СV.
Решение
1. Связь между конечными и начальными параметрами состояния газа определяется уравнением
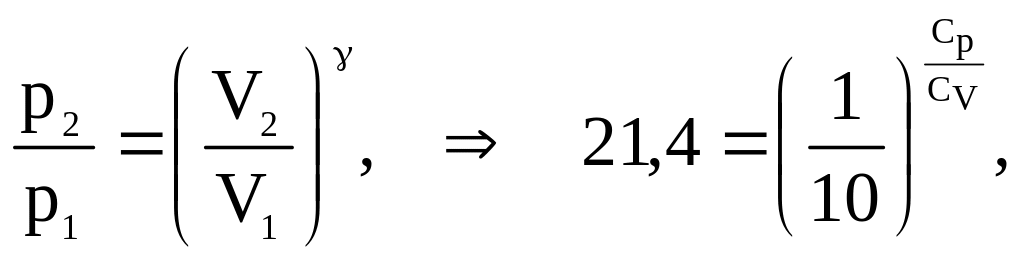 (1)
(1)
откуда следует, что
![]() .
(2)
.
(2)
2.1.19. Азот адиабатически расширяется от объёма V до объёма 2V. Какова конечная температура, если начальная температура составляла Т1 = 273 К?
Решение
1. Молекула азота N2 состоит из двух атомов, число степеней свободы молекулы азота равно i = 5, молярная масса азота = 2810 3 кг/моль.
2. Определим удельные теплоёмкости азота
![]() .
(1)
.
(1)
3. Так как
![]() ,
то
,
то
![]() .
.
4. Запишем уравнение Пуассона применительно к заданным условиям
 .
(1)
.
(1)
2.1.20. При адиабатическом сжатии воздуха в цилиндре двигателя внутреннего сгорания давление изменяется от р1 0,1 МПа до р2 4 МПа. В начальной фазе сжатия температура составляет Т1 = 313 К. Определить температуру воздуха в конечной фазе сжатия.
Решение
1. В первом приближении можно считать, что воздух имеет двухатомные молекулы, так как на 78% состоит из азота, число степеней свободы i =5.
2. Определим показатель адиабаты воздуха
![]() .
(1)
.
(1)
3. Запишем уравнение Пуассона в виде
 .
(2)
.
(2)
4. Выразим из последнего соотношения конечную температуру Т2
![]() .
(3)
.
(3)
2.1.21. При адиабатическом расширении газа было зафиксировано двукратное увеличение объёма и уменьшение температуры в 1,32 раза. Определить число степеней свободы молекул этого газа.
Решение
1. Запишем уравнение для показателя адиабаты
![]() ,
(1)
,
(1)
и уравнение Пуассона для заданных условий
 .
(2)
.
(2)
2. Выразим из уравнения (2) значение i
![]() .
(3)
.
(3)
2.1.22. Разность удельных теплоёмкостей двухатомного газа составляет c = 260 Дж/(кгК). Определить молярную массу газа и его удельные теплоёмкости.
Решение
1. Заданную по условию задачи разность удельных теплоёмкостей можно представить следующим образом
![]() ,
(1)
,
(1)
откуда
![]() .
(2)
.
(2)
2. Очевидно, что в задаче рассматривается кислород, для которого можно определить значения удельных теплоёмкостей
![]() .
(3)
.
(3)
2.1.23. Как будет меняться средняя квадратичная скорость молекул двухатомного газа, если его объём адиабатически увеличивается в два раза?
Решение
1. Определим показатель адиабаты газа с числом степеней свободы молекул i = 5, = (i+2)/i =1,4.
2. При адиабатическом изменении объёма будет изменяться температура газа, следовательно, будет изменяться и скорость теплового движения молекул. Изменение скорости удобно представить в виде отношения
 .
(1)
.
(1)
3. В соответствии с уравнением Пуассона Т1/Т2 = (V2/V1) -1, другими словами
![]() .
(2)
.
(2)
2.1.24. Для нагревания газа массой m = 1 кг на Т = 1 К при постоянном давлении потребовалось Q1 = 912 Дж теплоты, а при постоянном объёме на этот процесс было затрачено Q2 = 649 Дж. Какой это газ?
Решение
1. Определим удельные теплоёмкости газа
![]() ,
(1)
,
(1)
![]() .
(2)
.
(2)
2. Найдём показатель адиабаты газа и число степеней его молекулы
![]() ,
(3)
,
(3)
молекула искомого газа, судя по числу степеней свободы, двухатомная.
3. Используя уравнение для удельной теплоёмкости газа при постоянном объёме (или при постоянном давлении) определим молярную массу газа
![]() .
(4)
.
(4)
Полученная величина молярной массы позволяет утверждать, что нагреванию подвергался кислород.
2.1.25. Как изменится средняя длина свободного пробега молекул двухатомного газа, если его давление адиабатически уменьшается в два раза?
Решение
1. Запишем уравнение для средней длины свободного пробега молекул
![]() .
(1)
.
(1)
2. Таким образом, для адиабатического процесса можно записать
![]()
 = 1,4; (2)
= 1,4; (2)
![]() .
(3)
.
(3)
