
- •1. Генетический код: основные характеристики.
- •2. Биосинтез белка. Белок-синтезирующий аппарат клетки.
- •4. Активирование аминокислот.
- •5. Аминоацил-тРнк-синтетаза
- •6. Рибосомы
- •7. Инициация трансляции. Белковые факторы инициации. Образование функционально активной 70s-рибосомы
- •8. Элонгация трансляции. Белковые факторы элонгации. Последовательность событий в процессе элонгации. Элонгация – циклический процесс.
- •9. Терминация трансляции. Белковые факторы терминации.
- •10. Точность процесса трансляции.
- •11. Энергетические затраты на синтез белка.
- •12. Игибиторы трансляции
- •13. Посттрансляционное сворачивание белковой молекулы. Роль шаперонов в этом процессе.
- •14. Посттрансляционная модификация белков.
4. Активирование аминокислот.
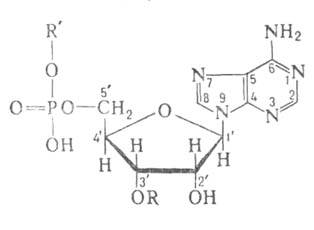
Для каждой из 20 аминокислот имеется соответствующая аминоацил-тРНК-лигаза, которая в цитоплазме соединяет аминокислоту с тPHK(tRNA) (см. с. 88). Этот процесс активации аминокислот осуществляется в две стадии. Сначала аминокислота связывается с ферментом и реагирует с АТФ (АТР), образуя макроэргический смешанный ангидрид — аминоациладенилат. Затем аминоацильный остаток переносится на концевую 3'-ОН-группу концевого остатка рибозы тРНК (другой группой лигаз аминоацил переносится на 2'-ОН-группу). В аминоацил-тРНК карбоксильная группа аминокислотного остатка этерифицируется остатком рибозы 3'-концевого остатка аденозина, входящего в последовательность ...ССА-3'.
Точность трансляции зависит, прежде всего, от субстратной специфичности аминоацил-тРНК-лигаз. Корректирующий механизм активного центра лигазы обеспечивает немедленное удаление ошибочно присоединенных аминокислотных остатков. В среднем встречается только одна ошибка на 1300 аминокислотных остатков — поразительно высокая точность «работы», если представить, насколько близки структуры некоторых аминокислот.
5. Аминоацил-тРнк-синтетаза
АМИНОАЦИЛ-тРНК-СИНТЕТАЗЫ [аминокислота: тРНК-лигазы (образующие АМФ)], ферменты класса ли-газ, катализирующие аминоацилирование транспортной РНК (тРНК) по схеме:
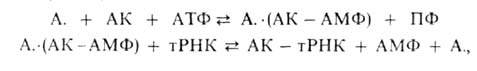
где А. - фермент, АК - активируемая аминокислота, АТФ - аденозинтрифосфат, ПФ - пирофосфат, АМФ - аденозинмонофосфат. Карбоксильная группа аминокислоты в АК-АМФ связана ангидридной связью с остатком фосфорной к-ты (см. ф-лу; R-ацил аминокислоты, R = Н), а в АК - тРНК - сложноэфирной связью с гидроксильной группой в положении 2 или 3 рибозы концевого остатка аденозина тРНК (в ф-ле R-продолжение цепи тРНК, R-аминоацил):
Каждая А. специфична только по отношению к одной из 20 аминокислот, входящих в белки, и к одной или нескольким тРНК.
Большинство А. состоит из 1, 2 или 4 одинаковых полипептидных цепей, а глицил- и фенилаланил-тРНК-синтетазы - из 2, отличающихся друг от друга, пар. Мол. м. полипептидных цепей 30-140 тыс., оптимальная каталитич. активность фермента при рН 7-9; р/ обычно 5-6,5. Многие А. содержат два активных центра. В индивидуальном состоянии выделены А., специфичные к каждой из 20 аминокислот. Известны первичные структуры нескольких А., определенные в осн. из нуклеотидной последовательности кодирующих их генов, и пространств. структуры тирозил-тРНК-синтетазы и участка молекулы метионил-тРНК-синтетазы, обладающего каталитич. активностью.
Специфичность р-ций, катализируемых А., очень высока, что определяет точность белкового синтеза в живой клетке. Если А. осуществит ошибочное аминоацилирование тРНК близкой по структуре аминокислотой, произойдет коррекция путем катализируемого той же А. гидролиза ошибочных АК-тРНК до АК и тРНК. В цитоплазме содержится полный набор А., кодируемых ядерным геномом; в хлоропластах и митохондриях есть свои А.
6. Рибосомы
Рибосомы представляют собой рибонуклеопротеиновые образования — своеобразные «фабрики», на которых идёт сборка аминокислот в белки. Эукариотические рибосомы имеют константу седиментации 80S и состоят из 40S (малой) и 60S (большой) субъединиц. Каждая субъединица включает рРНК и белки. В 40S субъединицу входит рРНК с константой седиментации 18S и около 30—40 белков. В 60S субъединице обнаружено 3 вида рРНК: 5S, 5,8S и 28S и около 50 различных белков.
Белки входят в состав субъединиц рибосомы в количестве одной копии и выполняют структурную функцию, обеспечивая взаимодействие между мРНК и тРНК, связанными с аминокислотой или пептидом.
В присутствии мРНК 40S и 60S субъединиц объединяются с образованием полной рибосомы, масса которой примерно в 650 раз больше массы молекулы гемоглобина.
В рибосоме есть 2 центра для присоединений молекул тРНК: аминоацильный (А) и пептидильный (Р) центры, в образовании которым участвуют обе субъединицы. Вместе центры А и Р включают участок мРНК, равный 2 кодонам. В ходе трансляции центр А связываем аа-тРНК, строение которой определяет кодон, находящийся в области этого центра. В струкЯ туре этого кодона зашифрована природа аминокислоты, которая будет включена в растущую полипептидную цепь. Центр Р занимает пептидил-тРНК, т.е. тРНК, связанная с пептидной цепочкой, которая уже синтезирована.
У эукариотов различают рибосомы 2 типом «свободные», обнаруживаемые в цитоплазма клеток, и связанные с эндоплазматическим ретикулумом (ЭР). Рибосомы, ассоциированнье с ЭР, ответственны за синтез белков «на экспорт», которые выходят в плазму крови и участвуют в обновлении белков ЭР; мембраны aаппарата Гольджи, митохондрий или лизосом.
Митохондрии содержат свой набор рибосом. Митохондриальные рибосомы мельче, чем рибосомы эукариотов, прокариотов и имеют константу седиментации 55S. Они также состояв из двух субъединиц, но отличаются от эукаририотических рибосом количеством и составом РНК и белков.
