- •1.2. Прямая потенциометрия. Ионометрия.
- •1.2.1. Ионоселективные мембранные электроды и их классификация
- •1.2.2. Ионоселективные электроды с твердыми мембранами
- •1.2.3. Электроды с жесткой матрицей. Стеклянный электрод
- •1.2.4. Ионоселективные электроды с жидкими мембранами
- •1.2.5. Газочувствительные электроды
- •1.2.6. Потенциометрические биосенсоры
- •1.2.7. Ионоселективные полевые транзисторы
- •1.2.8. Ионоселективные микроэлектроды
1.2.4. Ионоселективные электроды с жидкими мембранами
В электродах с жидкостной мембраной пористая перегородка, пропитанная неводной фазой, разделяет две водные фазы – исследуемый раствор и внутренний раствор электрода. При этом неводная фаза содержит гидрофобные ионы (активные центры ионообменника), присутствие которых определяет ионоселективную функцию электрода, и противоположно заряженные определяемые ионы (противоионы). Поведение такой мембраны определяется коэффициентом распределения соли ионообменника с определяемым ионом между водным раствором и несмешивающимся с водой растворителем, образованием ионных пар в фазе мембраны и степенью проницаемости мембраны по отношению к посторонним ионам.
Если пористая перегородка пропитана органическим растворителем с растворенными в нем катионами достаточно больших размеров (четвертичные аммониевые соли, комплексы переходных металлов и др.), то такая мембрана реагирует на изменение активности анионов. И наоборот, если пропитывающий пористую перегородку раствор содержит анионные комплексообразующие агенты или анионы большого размера, то мембрана чувствительна к изменению активности катионов. При этом жидкий ионообменник не должен растворяться в исследуемом растворе и в растворе сравнения.
Жидкостные ионообменные мембраны можно изготовить и на основе растворов нейтральных молекул, например таких, как циклодекстрины, циклические антибиотики или соединения, образующие хелатные комплексы с определяемыми катионами. Наиболее известным примером указанных электродов является электрод на основе валиномицина, коэффициент селективности которого по отношению к ионам калия почти на два порядка превышает аналогичный коэффициент для лучших стеклянных электродов.
Теория возникновения потенциала в случае жидкостных мембран основана на учете распределения вещества между двумя несмешивающимися жидкостями. Наблюдаемые при этом закономерности достаточно сложны. Схема процессов, происходящих в жидкостных ионообменных мембранах, приведена на рис 5.
Если в мембране содержится достаточное количество ионизирующегося вещества (в простейшем случае внутри мембраны находится соль однозарядного аниона ионообменника, то катионы А+ и В+ переходят через границу мембрана/раствор, а крупные по размеру гидрофобные анионы остаются в органической фазе. При этом анионы практически не проникают из раствора в мембрану. На поверхности мембраны возникает потенциал, который для хорошо диссоциирующих солей АR и БR описывается выражением, формально не отличающимся от выражения для твердых мембран:
![]() (27)
(27)
где kА и kB – коэффициенты распределения ионов А+ и В+ между водной фазой и органическим растворителем.

Рис. 5. Схема процессов в жидкостной мембране
Из выражения (27) следует, что селективность жидкостных мембран зависит от коэффициентов распределения и подвижности ионов А+ и В+. В случае полной диссоциации молекул ионита (чего следует ожидать в растворителях с высокой диэлектрической проницаемостью) подвижность ионов определяется только природой растворителя и не зависит от природы аниона. Так, вводя карбоновые, сульфоновые или фосфорорганические кислоты с длинной цепью в нитробензол или нитрометан, можно получить на их основе мембранные электроды с высокой селективностью к различным катионам. При этом неважно, какого рода группы – карбоксильные, сульфатные или фосфатные – введены в качестве ионообменных. Если вместо кислоты в нитробензол ввести анионообменные молекулы, например тетраалкиламмониевые соли, то получим анионоселективный электрод, селективность которого уменьшается в ряду: I- > Br- > Cl- > F-.
При использовании растворителей с низкой диэлектрической проницаемостью (ε < 10), таких как алифатические и ароматические углеводороды и некоторые их производные, наблюдается сильная ассоциация катионов А+ и В+ с анионами R-. В результате образуются нейтральные пары. Электродный потенциал указанных систем зависит от подвижности ионов и является сложной функцией от природы растворителя и растворенного вещества.
В общем случае параметр селективности для жидкостных мембран определяется соотношением
![]() ,
(28)
,
(28)
в котором вклад величины Кобм можно оценить следующим образом:
![]() ,
(29)
,
(29)
где kar и kbr – константы ассоциации ионов А+ и В+ с R-.
Для различных систем мембранный потенциал определяется первым и вторым членом выражения. Например, в случае, когда анион R- более подвижен, чем противоионы А+ и В+, мембранный потенциал определяется преимущественно вторым членом. При этом селективность, характеризуемая константой ионообменного равновесия, зависит от свойств растворителя, образующего мембрану, и от химической природы органофильных ионов.
Первый член выражения описывает свойства систем с малоподвижными (по сравнению с противоионами) органофильными ионами. Поскольку величиной uR можно пренебречь, в выражение для потенциала электрода войдут те же параметры, что и в случае полной диссоциации, т.е. uB /иА и kB /kА, характеризующие свойства диссоциированных ионов и не зависящие от химической природы ионита.
В жидкостных мембранах с сильной ассоциацией молекул ионита, ведущей к образованию мицелл, более вероятен вакансионный механизм переноса, при котором создается своеобразная эстафетная цепь, т.е. происходит перескок иона от одной частицы к другой. Селективность электродов с такими мембранами зависит в основном от природы ионита, а не растворителя.
В случае нейтральных переносчиков (S), типичным примером которых являются макроциклические соединения, селективность жидкостных мембран определяется равновесными параметрами и зависит от отношения kB/kА. Величину этого отношения легко определить из данных по равновесной экстракции солей нейтральными молекулами из водных растворов в органический растворитель. Механизм переноса также отличается от ионообменного, поскольку в нем не участвуют заряженные ионообменные центры. Вместо этого образуются заряженные комплексные ионы (KS+) нейтральных молекул с катионами, которые и выступают переносчиками последних:
К+ + S = KS+.
Для катионов приблизительно одинакового размера с одинаковым зарядом отношение kB/kА не зависит от природы растворителя, поскольку комплексы практически не отличается друг от друга по устойчивости. По этой причине селективность таких мембран зависит только от химических свойств нейтральных переносчиков, которые отражаются на величинах констант образования соответствующих комплексов. Кроме того, селективность во многом зависит от специфичности взаимодействия катионов со связывающими их нейтральными молекулами.
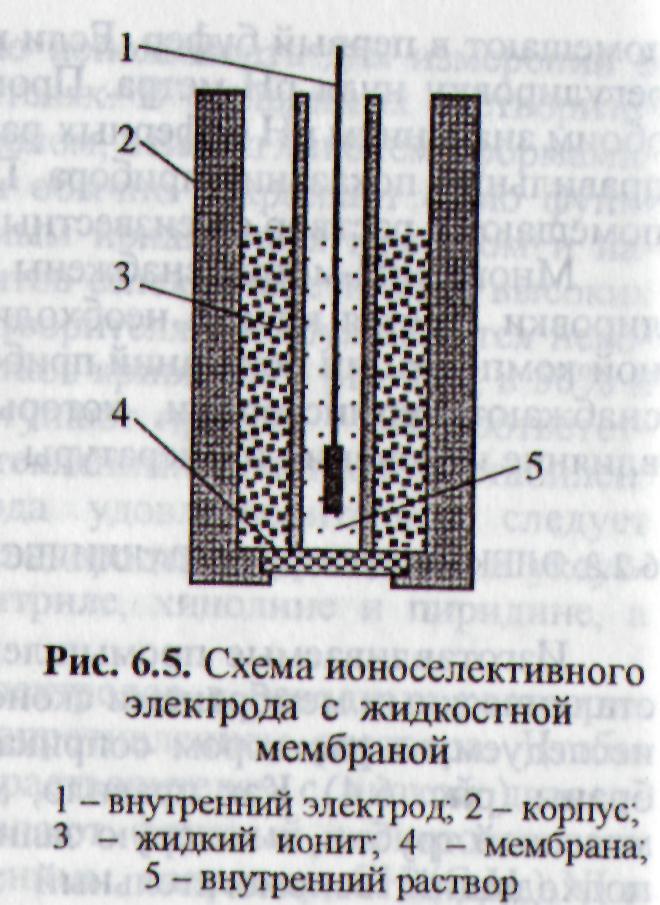
В электродах на основе мембран с подвижными носителями слой жидкого ионообменника, состоящего из не смешивающегося с водой органического растворителя и растворенного в нем ионита, удерживается между анализируемым раствором и водным раствором постоянного состава, в который погружен внутренний электрод, с помощью пористого гидрофобного пластмассового диска. Последний препятствует вытеканию органической жидкости из резервуара, расположенного между двумя концентрическими трубками (рис. 5). Внутреннюю трубку заполняют стандартным раствором определяемого иона и насыщают AgCl, чтобы при погружении в него серебряной проволоки образовался Ag/AgCl-электрод. Данный электрод обладает всеми преимуществами электродов с тонкими мембранами, и в то же время способен выдерживать давление более одной атмосферы без разрушения мембраны или вытеснения из нее органической жидкости.
|
Рис. 5. Схема ионоселективного электрода с жидкой мембраной 1 − внутренний электрод; 2 − корпус; 3 − жидкий ионит; 4 − мембрана; 5 − внутренний раствор |
Жидкая фаза мембраны должна быть нерастворимой в воде и иметь низкое давление паров, так как в случае высокой растворимости или летучести органического растворителя, растворенный в нем ионит будет выделяться в виде твердой фазы, что ведет к потере электродной функции. Растворитель, даже если он почти не смешивается с водой и имеет низкую летучесть, должен также обладать высокой вязкостью для предотвращения его диспергирования в анализируемом растворе, иначе мембрана не будет иметь достаточную долговечность. Указанным требованиям отвечают многие органические растворители, обладающие сравнительно большой молекулярной массой и низкой диэлектрической проницаемостью: деканол, диоктилфенилфосфат, дифениловый эфир, дибензиловый эфир, о-нитрофенил-н-октиловый эфир и др. Следует заметить, что требования, которым должен удовлетворять растворитель, не всегда можно определить однозначно, поскольку природа растворителя оказывает заметное влияние на перенос ионов через границу раздела водный раствор/органическая фаза.
В качестве ионитов обычно применяют органические соли, которые в полярных растворителях существуют в виде нейтральных, практически недиссоциированных молекул, имеющих кислотные, щелочные или хелатообразующие функциональные группы. Такие соли должны иметь высокую молекулярную массу и хорошую растворимость в растворителях с низкой диэлектрической проницаемостью. Коэффициент распределения ионита между органической фазой и водным раствором должен быть таким, чтобы его концентрация в органической фазе значительно превышала соответствующую величину для водных растворов. Кроме того, ионит должен образовывать с определяемыми ионами более прочные комплексы, чем с любыми потенциально мешающими ионами, присутствующими в анализируемом растворе. Помимо селективности активная группа ионита должна обладать способностью вступать с определяемыми ионами в быстрое подвижное ионообменное равновесие. Как правило, эти условия выполняются, если молекулы ионита содержат длинные углеводородные цепочки с большим числом углеродных атомов. Для каждого конкретного случая практически всегда можно найти систему, удовлетворяющую данным требованиям.
Первым электродом с жидкостной мембраной был кальций-селективный электрод на основе кальциевой соли додецилфосфорной кислоты, растворенной в диоктилфенилфосфате. В выпускаемых в настоящее время электродах для определения кальция в качестве ионофоров применяют эфиры фосфорной кислоты с двумя алифатическими радикалами, содержащими от 8 до 16 углеродных атомов, или нейтральные переносчики. В случае эфиров фосфорной кислоты на поверхности мембраны устанавливается равновесие
[(RO)2POO]2Ca = 2(RO)2POО- + Са2+.
Выбор фосфорных соединений связан с тем, что фосфат- и полифосфат-ионы образуют с ионами Са+ устойчивые комплексные соединения. Если ионит растворить в менее полярном растворителе, например деканоле, то электрод становится чувствительным по отношению ко всем двухзарядным ионам. Такие мембраны применяют при изготовлении электродов для определения суммарного содержания кальция и магния в растворе, т.е. для определения жесткости воды.
Кальций-селективные электроды реагируют на активность ионов кальция в диапазоне от 10-1 до 10-5 моль/л. При меньшем содержании кальция в анализируемом растворе потенциал электрода не зависит от активности ионов кальция в водной фазе вследствие растворимости кальциевых солей фосфорных эфиров в воде. Определению Са2+ мешают ионы стронция (KCa./Sr = 0,014), магния и бария, для которых коэффициенты селективности имеют несколько меньшую величину. Коэффициенты селективности KСа/Na и KCa/K. равны 3∙10-4. При рН < 5,5 ионы водорода обмениваются с ионами кальция и потенциал электрода зависит от рН.
Высокой селективностью по отношению к ионам тяжелых металлов обладают иониты с активными группами, содержащими серу (замещенные тиогликолевой кислоты и др.). Однако использование таких электродов ограничено из-за склонности серосодержащих соединений к окислению и взаимодействию с ионами водорода.
К электродам с анионной функцией относятся мембраны, которые в качестве ионитов содержат комплексы положительно заряженных переходных металлов с нейтральными органическими лигандами, например с о-фенантролином. Комплексные соли типа ML3(NO3)2, где L - лиганд, функционируют как анионообменники. На их основе разработаны электроды, селективные к ионам С1O4-, NO3-, BF4-, Сl-. В частности, электрод на основе трис-фенантролиновых комплексов Ni2+ применяется для определения нитрат-ионов. Абсолютная величина градиента ионной функции такого электрода соответствует теоретическому значению, рассчитанному по уравнению Нернста для электродов, обратимых по отношению к однозарядным ионам:
![]() (30)
(30)

заметного влияния на потенциал электрода. В таком комплексе положительный заряд иона металла рассредоточен из-за наличия в лиганде ароматических колец. Поэтому наиболее прочные ассоциаты комплексный катион никеля образует с крупными поляризуемыми анионами С1O4-, BF4-, I- и NO3-, тогда как «жесткие» ионы типа ОН- и F- менее склонны к образованию соответствующих ионных ассоциатов.
Известны электроды на основе фенантролиновых комплексов Со для определения ионов С1O4-, Вr- и I-.
В качестве активных компонентов мембран для определения нитрат-ионов используются также четвертичные аммониевые и фосфониевые соли. Электроды характеризуются крутизной электродной функции, близкой к теоретической, в диапазоне концентраций от 10-1 до 10-5 моль/л. Коэффициенты селективности по отношению к ионам Сl-, NO2-, SO42- не превышают 10-2. Ионообменники на основе солей тетраалкиламмония находят применение для изготовления хлоридных электродов. В качестве органического катиона в них используется диметилдистеариламмоний. Электроды можно применять для измерения активности ионов хлора в присутствии сульфид-ионов, которые оказывают значительное влияние на показания твердых хлоридных электродов. Основные характеристики электродов с жидкостными мембранами приведены в табл. 1. В электродах, селективных к НСO3-, СO32-, С1O4- , С1O3- , также применяются четвертичные аммониевые соли.
Разработан ряд ИСЭ для определения ионных поверхностно-активных веществ (ПАВ). Мембраны таких электродов состоят из ионов соответствующих ПАВ и подходящего ионообменника. В форме анионных комплексов можно определять катионы ряда тяжелых металлов, например AuCl4-, Ag(CN)2- и др.
Интерес представляют комплексные соединения макроциклических лигандов, в том числе циклических антибиотиков, с катионами щелочных и щелочноземельных металлов. Прочность комплексов, состав которых обычно отвечает соотношению 1:1, определяется тем, что в них катион металла, попадая во внутреннюю полость (рис. 6, II), удерживается в ней электростатическим притяжением атомов кислорода, электронные пары которых ориентированы внутрь цикла. Основное условие для образования таких комплексов - соответствие внутримолекулярной полости лиганда размерам иона металла. Это не означает, что когда такого соответствия нет, комплекс вообще не образуется. Если полость для катиона мала, то возможно образование комплексов сандвичевого типа с двумя молекулами лиганда. Когда же макроцикл слишком велик, внутрь него могут войти два иона металла, то есть комплекс будет иметь состав 1:2. Кроме того, большой макроцикл может как бы обернуться вокруг катиона. В любом из этих случаев прочность комплексов существенно ниже, чем при оптимальном соответствии размеров катиона и лиганда. Увеличение дипольных моментов полярных групп повышает устойчивость комплексов и избирательность реакций комплексообразования для двухзарядных ионов в присутствии однозарядных того же размера.
ТАБЛИЦА 1. Основные характеристики электродов с подвижными носителями
-
Определяемый
ион
Диапазон
концентрации,
моль/л
Диапазон
РН
Коэффициент
cелективности
Са2+
1 – 10-5
6-8
Mg2+ 0,01; Sr2+ 0,02; Cu2+ 0,27; Pb2+ 0,63; Fe3+ 0,8; Zn2+ 3,2;
К+
1 – 10-5
3-10
Li+ 0,001; Na+ 0,002; H+ 0,01; Ag+ 0,001; NH4+ 0,03; Cs+ 1,0
BF4-
10-1 – 10-5
3-10
N03- 0,1; AcO- 0,004; Н2СО3- 0,004; Br- 0,04
N03-
10-1 – 10-5
3-10
F- 0,0009; HCO32- 0,02; Br- 0,9; SO42- 0,0006; Сl- 0,006
СlO4-
10-1 – 10-5
3-10
Cl- 0,00022; Br- 0,00056; NO3- 0,0015; I- 0,012;
Сl-
10-1 – 10-5
2-11
F- 0,10; SO42- 0,14; NO3- 4,2; HCO3 0,19; Br- 1,6; I- 17
Благодаря хорошей растворимости макроциклов в неводных средах они способны переводить катионы щелочных и щелочноземельных металлов из водной фазы в органическую. При этом макроциклические соединения можно уподобить челноку, снующему через границу раздела мембрана/анализируемый раствор. Подобные соединения называют еще мембрано-активными комплексонами (МАК) или нейтральными переносчиками.
Для ионоселективных электродов наиболее подходят те соединения, которые при образовании комплексов способны заместить гидратную оболочку определяемого иона и достаточно растворимы в фазе мембраны. К нейтральным переносчикам относят и соединения с открытой цепью - поданды (рис. 6, III, IV). Хотя по комплексообразующей способности они уступают циклическим аналогам, относительная простота синтеза и доступность подандов явились причиной их распространения в ионометрии.

Рис. 6. Структурные формулы валиномицина (II) и некоторых
соединений с открытой цепью (III, IV), являющихся
нейтральными переносчиками
При выборе мембраноактивных комплексов учитывают следующие требования:
молекула должна иметь стабильную конформацию с пространственной полостью из полярных групп, необходимых для связывания катиона;
неполярные группы должны образовывать вокруг иона гидрофобную оболочку;
координационные центры должны быть распределены в лиганде таким образом, чтобы при комплексообразовании образовывались пятичленные хелатные циклы;
для катионов щелочных и щелочноземельных металлов предпочтительными являются соединения, содержащие атомы кислорода.
Перечисленным требованиям в наибольшей степени отвечает циклический антибиотик валиномицин (см. рис. 6, II), который относится к депсипептидам (цикл образуют аминокислоты и а-оксикислоты жирного ряда). Характерной особенностью валиномицина является то, что гидрофильные полярные группы входят во внутреннюю полость антибиотика, что позволяет им участвовать в образовании комплексов с ионами металлов. Гидрофобные углеводородные радикалы образуют внешнюю оболочку и обеспечивают растворимость комплексов в органической фазе мембраны. Валиномицин образует устойчивые комплексы с калием и гораздо более слабые - с натрием. Различие обусловлено размерами полости, которая точно соответствует диаметру негидратированного иона калия.
Раствор валиномицина в дифениловом эфире является основой мембраны калий-селективного электрода. При определении калия в присутствии натрия такая мембрана характеризуется коэффициентом селективности < 10-4. Электрод позволяет определять калий в диапазоне концентраций от 10-1 до 10-5 моль/л. Единственным ионом, оказывающим влияние на показания калиевого электрода, является ион аммония.
Известны специфические нейтральные переносчики (депсипептиды, макротетролиды, полиэфиры, диамиды карбоновых кислот и др.), которые используются в электродах, селективных к ионам Li+ , Na+, Cs+, Са2+, Ba2+, Sr2+. В частности, природным ионофором на ионы кальция является антибиотик А 23187. Для определения бария применяют электрод с мембранным переносчиком на основе нонилфеноксиполи(этиленокси)этанола.
Однако механизм возникновения катионной функции у мембран с нейтральными переносчиками до конца не выяснен. Заметим также, что такие электроды в большей степени подвержены воздействию посторонних веществ, чем электроды с кристаллическими мембранами, поскольку липофильные анионы из анализируемого раствора могут экстрагироваться в объем мембраны. Этот процесс протекает медленнее, чем межфазный, и приводит к изменениям в составе мембраны. Соответственно может замедлиться установление равновесия и будет наблюдаться дрейф потенциала электрода. Кроме того, липофильные анионы вносят свой вклад в межфазный потенциал и создают помехи при измерениях. Их влияние нейтрализуют введением в состав мембран солей, содержащих липофильные анионы, которые компенсируют заряд комплексных катионов с нейтральными переносчиками, например тет-ракис-(«-хлорфенил)борат-ионы. Такие соли называют анионоподавляющими реагентами.
Выпускаемые в настоящее время электроды на основе мембран с подвижными носителями снабжены модульными насадками, которые навинчиваются на корпус электрода. Модули содержат отдельно органическую и водную фазы в пористых пластмассовых резервуарах вместе с внутренними хлоридсеребряными электродами сравнения и пористой мембраной и не требуют дополнительной подготовки к работе.
Основным недостатком таких электродов является истечение раствора ионообменника в исследуемый раствор, что заставляет постоянно подпитывать мембрану с ее краев. Другой источник проблем связан с трудностями в заполнении всех пор мембраны раствором ионообменника.
От указанных недостатков свободны электроды на основе пластифицированных полимерных мембран. Они аналогичны электродам на основе мембран с подвижными носителями, за исключением того, что жидкий ионообменник находится в гомогенной полимерной пленке (матрице); во многих случаях один и тот же ионообменник можно использовать в электродах обоих типов. Для получения достаточно прочной и эластичной пленки растворитель ионообменника должен быть одновременно пластификатором полимера. В качестве матрицы чаще всего применяют пленки из поливинилхлорида, пластифицированного эфирами фталевой, фосфорной и других кислот. Для изготовления мембраны к тетрагидрофурану добавляют жидкий ионообменник и в полученном растворе растворяют поливинилхлорид. Далее раствор помещают стеклянное кольцо на стеклянную пластинку и дают тетрагидрофу-рану медленно (при комнатной температуре) испариться. Толщина получаемой мембраны составляет около 0,2 мм. Затем из мембраны вырезают диск диаметром 3-4 мм и прикрепляют его к корпусу электрода. Таким же образом можно изготовить твердоконтактные электроды, погружая платиновую проволоку или графитовый стержень в соответствующие растворы (электроды с нанесенным покрытием). Выпускаются также миниатюрные ИСЭ для клинических анализов. Вместо тетрагидрофурана иногда используют цик-логексанон.
Хотя электроды на основе пластифицированных полимерных мембран имеют меньший срок службы, чем электроды на основе мембран с подвижными носителями, они более удобны в работе. Лучше всего такие электроды работают в нейтральных или слабокислых растворах; ограничение связано с ионообменником, а не с материалом матрицы. Во избежание загрязнения или растворения активной фазы анализируемые растворы не должны содержать органических соединений.
В настоящее время выпускаются нитрат-, тетрафторборат-, перхлорат-селективные электроды с пластифицированными мембранами, которые позволяют измерять концентрацию соответствующих ионов в диапазоне от 1 до 10-5 моль/л при температурах от 0 до 40 °С. Разработаны также электроды для определения Са2+, Na+, K+. Так, например, поливинилхлоридная матрица, пластифицированная трибутилфосфатом, селективна к ионам Са2+. Та же мембрана, пластифицированная дибутилфосфатом, реагирует на изменение концентрации ионов К+ в присутствии Na+. Следует помнить, что в основе действия всех этих мембран лежат те же принципы, что и рассмотренные выше. Необходимым условием отклика мембраны является равновесие реакции определяемого иона с комплексообразующим реагентом или с ионообменником.
Для определения ионных ПАВ применяют твердоконтактные ИСЭ с графитовым или серебряным токоотводом, покрытым пленкой поливинилхлорида, пластифицированного дибутил-, диоктилфталатом или нитрофенилоктиловым эфиром. В качестве электродно-активных веществ в них используются ионные ассоциаты метилового зеленого, тетрадециламмония или цетилпиридиния с додецилсульфатом. Для таких электродов в растворах ПАВ характерны как анионная, так и катионная функции. Линейность электродной функции на ионные ПАВ наблюдается в диапазоне концентраций от 10-6 до 10-2 моль/л при рН 2-10.
Кроме поливинилхлорида для изготовления мембран используются и другие полимерные материалы, но они не получили широкого распространения, так как несовместимы с большинством ионообменников. В качестве второго полуэлемента, как правило, применяют хлоридсеребряный электрод.