
- •1.2. Прямая потенциометрия. Ионометрия.
- •1.2.1. Ионоселективные мембранные электроды и их классификация
- •1.2.2. Ионоселективные электроды с твердыми мембранами
- •1.2.3. Электроды с жесткой матрицей. Стеклянный электрод
- •1.2.4. Ионоселективные электроды с жидкими мембранами
- •1.2.5. Газочувствительные электроды
- •1.2.6. Потенциометрические биосенсоры
- •1.2.7. Ионоселективные полевые транзисторы
- •1.2.8. Ионоселективные микроэлектроды
1.2. Прямая потенциометрия. Ионометрия.
Прямая потенциометрия основана на точном измерении величины равновесного электродного потенциала и нахождению по уравнению Нернста активности потенциалопределяющего иона в растворе. Прямая потенциометрия на основе металлических электродов кроме аналитических целей широко применяется для определения таких важнейших характеристик, как коэффициенты активности электролитов, энтальпия, энтропия и свободная энергия реакций, константы различных равновесий (ионизации, комплексообразования, произведение растворимости), число электронов, участвующих в электрохимической реакции.
Ионометрия - важное направление в развитии потенциометрического метода анализа. Она основана на применении ионоселективных мембранных электродов, работающих по механизму переноса ионов через межфазную границу, и находит широкое применение в аналитической химии, контроле технологических процессов и чистоты окружающей среды, биологии, медицине и геологии.
1.2.1. Ионоселективные мембранные электроды и их классификация
Первым представителем мембранных электродов является стеклянный электрод, открытый и изученный как Н+ - селективный электрод в начале 20-го столетия (Габер, Кольтгофф, Никольский). В 1934 г. на основе стеклянной мембраны предложен Na+-селективный электрод, а в 1961 появляется первое упоминание об осадочных мембранных электродах (Е. Пунгор), промышленное изготовление которых начинается с 1966 г. Первые работы по жидким мембранам относятся к 1967 -1970 гг. Исследования по созданию новых мембран и ионселективных электродов продолжаются до настоящего времени.
Ионоселективные электроды (ИСЭ) изготавливают на основе полупроницаемых мембран, обладающих повышенной избирательностью по отношению к определенному типу ионов. Это свойство позволяет определить активность анализируемого иона прямым методом. В электрохимии мембраной (membrana - пергамент) называют слой из твердого или жидкого электролита, разделяющий два раствора одного и того же качественного состава. Если мембрана одинаково проницаема для всех компонентов системы, то ее называют диафрагмой. Мембрана, которая в различной степени задерживает переход разных по природе ионов, называется полупроницаемой.
Проницаемость мембраны для ионов определенного типа может быть обусловлена различными причинами:
ион не диффундирует через мембрану, потому что его размеры (вместе с сольватной оболочкой) превосходят диаметр пор мембраны, в этом случае мембрана работает как молекулярное сито;
мембрана проницаема только для катионов или анионов из-за наличия заряда поверхности пор, который обусловлен т.н. фиксированными ионами, входящими в состав кристаллической решетки;
мембрана из труднорастворимого электролита проницаема для ионов входящих в состав этого соединения или способных внедряться в кристаллическую решетку;
мембрана из жидкой фазы, не смешивающейся с водой, проницаема только для тех ионов, которые образуют с активными компонентами мембраны достаточно прочные соединения, способные к диффузии через фазу мембраны.
Важное свойство электрохимических мембран заключается в том, что они обеспечивают возникновение скачка потенциала между двумя растворами, который называется мембранным потенциалом. Возникновение мембранного потенциала не связано с окислительно-восстановительными процессами на границе раздела фаз, а обусловлено только переносом ионов через эту границу.
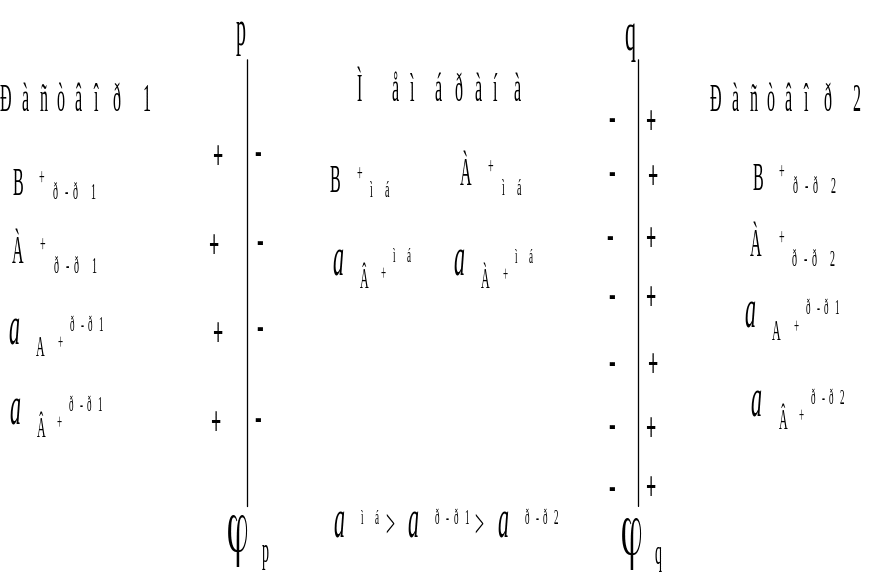
Рассмотрим подробнее явления, происходящие на границе раздела мембрана −раствор на примере катионитовой мембраны, которая избирательно пропускает катионы В+ и А+, но не проницаема для анионов. Если допустить, что справедливо неравенство амб>ар-р1>ар-р2 (т.е. активность ионов в растворе 1 больше активности ионов в растворе 2, а активность ионов в мембране выше, чем в растворах), тогда при контакте мембраны с растворами начнется переход катионов из мембраны в растворы. В результате поверхность мембраны относительно растворов будет заряжаться отрицательно. Так как ар-р1>ар-р2, вероятность выхода катионов в раствор с поверхности p меньше, чем с поверхности q, что и отражено различной концентрацией зарядов на этих поверхностях. Таким образом, на каждой из границ появится разность потенциалов, которая будет тормозить переход ионов. В результате скорости перехода катионов В+ и А+ через межфазную границу в обоих направлениях сравняются и установится динамическое состояние равновесия, которому будут отвечать равновесные скачки потенциалов φp и φq, называемые доннановскими потенциалами.
Мембранные потенциалы характерны для многих представляющих интерес электрохимических систем. В частности, широко применяются мембранные ионоселективные электроды, специфичные к различным ионам. Большинство из них отличается друг от друга только отдельными деталями процесса переноса ионов через мембрану. В то же время механизм возникновения мембранного потенциала для всех электродов практически одинаков.
Потенциал Доннана описывается выражением, аналогичным уравнению Нернста:
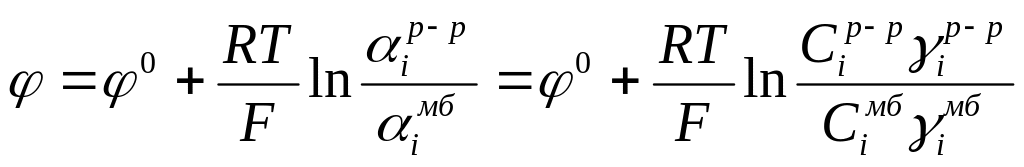 ,
(1)
,
(1)
где aiмб и aiр-р - активности ионов в фазе мембраны и раствора; Сiмб и Сiр-р - концентрации ионов в фазе мембраны и раствора; γiмб и γiр-р - соответствующие коэффициенты активности ионов.
Например, возникающий на границе р потенциал φр связан с активностями иона К+ в контактирующих фазах уравнением
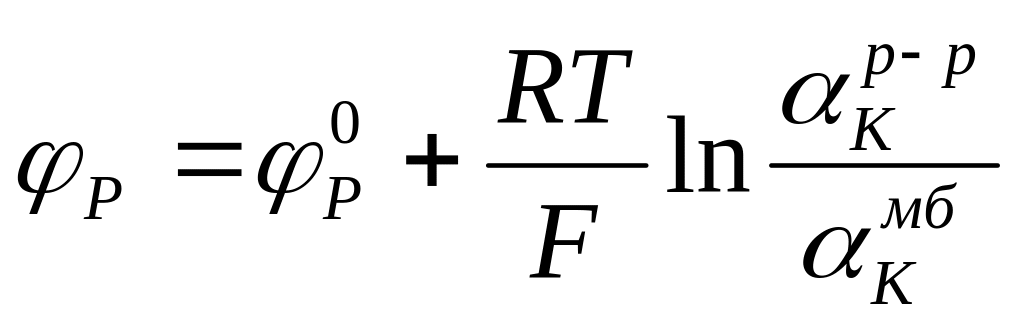 .
.
Из уравнения (1) следует, что доннановские потенциалы зависят от активности ионов в фазе мембраны и раствора, однако эти межфазные потенциалы нельзя измерить. Экспериментально можно зарегистрировать только так называемый мембранный потенциал, погрузив в разделяемые мембраной растворы два одинаковых электрода и измерив разность потенциалов между ними. Т.е. составляют элемент с мембраной, разделяющей растворы 1 и 2
![]()
ЕМ = Е1 −Е2 + ЕD . (2)
Измеряют мембранные потенциалы с помощью электродов сравнения, которые помещают в растворы по обе стороны мембраны. Величины мембранных потенциалов зависят от природы мембраны, концентрации ионов, входящих в растворы 1 и 2, и от применяемых электродов сравнения. В аналитической практике электроды сравнения, стандартный раствор (один из растворов, разделяемых мембраной с постоянной концентрацией определяемого иона) и сама мембрана в серии измерений остаются одними и теми же, меняется только активность ионов в исследуемом растворе. Поэтому изменение измеряемого мембранного потенциала связано только с изменением доннановского потенциала на границе мембрана − исследуемый раствор, величина которого в свою очередь обусловлена активностью определяемых ионов.
Важно отметить, что возникновение мембранного потенциала не связано с окислительно-восстановительными процессами на границе раздела фаз, а обусловлено только переносом ионов через эту границу.
Применяемые в электрохимических измерениях мембраны могут принадлежать к различным типам. Классификация ионоселективных электродов, важнейшей частью которых является полупроницаемая мембрана, по предложению ИЮПАК (IUPAC - Международный Союз чистой и прикладной химии) проводится по типу мембраны.
ИСЭ с твердыми мембранами, которые подразделяются на:
гомогенные мембраны (монокристаллическая, из сплава солей, спресованная из порошков солей, стеклянная);
гетерогенные мембраны (электродноактивное вещество введено в инертную матрицу).
ИСЭ с жидкими мембранами. В таких электродах водная фаза отделяется диафрагмой от неводной фазы мембраны, в которой растворены отрицательно или положительно заряженные, или нейтральные переносчики ионов. В связи с этим существуют:
электроды, обладающие катионными функциями (Ca2+, Ba2+), которые содержат в несмешивающемся с водой органическом растворителе мембраноактивные частицы - крупные анионы (например, алкилфосфорной кислоты или тетра-n-хлорфенилборатный анион);
электроды, обладающие анионными функциями (NO3-, Br-, Cl- ClO4- и др.), которые содержат в органическом растворителе мембраноактивные частицы - крупные катионы (например, катионы солей четвертичных аммониевых оснований, комплексных солей переходных металлов и др.);
электроды с мембраной на основе нейтральных лигандов (антибиотики, циклические и ациклические макромолекулы). Примером этого типа электродов является K+ - электрод на основе валиномицина.
Особые ИСЭ:
газочувствительные электроды, в которых используется газопроницаемая мембрана или воздушный зазор, выполняющий роль мембраны, а также соответствующий индикаторный электрод;
ферментные электроды, в которых ионоселективный электрод (например, стеклянный) имеет покрытие содержащее фермент. Этот фермент (например, уреаза) катализирует реакцию анализируемого органического соединения (мочевины), достигающего поверхности электрода. Ионоселективный электрод реагирует на продукт реакции (ион аммония) и по изменению его потенциала можно судить о концентрации исходного органического вещества;
ионселективные полевые транзисторы.
