
0.75, Что соответствует наиболее плотной упаковке сфер. Тем не менее, структуру белка
нельзя считать жесткой. Исследования методом ЯМР и расчеты молекулярной динамики
приводят к представлению, что положения отдельных аминокислотных остатков не строго
фиксированы, так что структура как бы "дышит", при этом подвижность некоторых
аминокислотных остатков настолько велика, что их положение, найденное методами
рентгеноструктурного анализа, становится непоказательным. Эти результаты объясняют
также способность некоторых малых молекул проникать вглубь белка.
Некоторые белки состоят не из одной, а из нескольких полипептидных цепей. Каждая
такая цепь называется субъединицей белка, а сам составной белок - олигомерным. Такие
белки имеют еще один структурный уровень, уровень ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ.
Под четвертичной структурой понимают взаимное расположение субъединиц, т.е. способ их совместной укладки и упаковки с образованием нативной структуры олигомерного белка. Отдельные субъединицы соединяются между собой либо водородными связями, либо "слипаются" своими гидрофобными поверхностями. Обычно олигомерные белки состоят из 3 - 6 субъединиц, но встречаются также содержащие 10 - 12 субъединиц, и как крайний пример известен пируватдегидрогеназный комплекс, состоящий из 72 субъединиц.
Процесс укладки полипептидной цепи во вторичную и третичную структуру, и для определенных белков, в четвертичную, обозначают термином фолдинг. Расшифровка механизмов фолдинга – это одна из величайших задач современной биологии. До не давнего времени было принято считать, что после образования полипептидной цепи на рибосоме белок автоматически сворачивается в трехмерную структуру за счет взаимодействия аминокислотных остатков. Однако в полипептидной цепи есть практически безграничные возможности ассоциации аминокислот друг с другом, огромное число вариантов комбинаций аминокислот. Если бы в процессе укладки случайным образом перебирались все возможные конформации цепи, то этот процесс занимал бы миллионы лет. В клетке, в ходе биосинтеза белка процесс укладки полипептидных цепей в глобулы занимает несколько минут. Таким образом, аминокислотная последовательность лишь определяет, какая трехмерная структура возможна, но никак не объясняет, каким образом возникает это структура.
Как уже отмечали, механизмы фолдинга белков in vivo пока детально не выяснены, однако определены некоторые молекулярные факторы, участвующие в этом процессе. К таким молекулам относятся ферменты фолдинга и шапероны. Первый фермент- протеин-дисульфидизмераза, перемещает дисульфидные связи в полипептидной цепи. Она может разрушать «неправильные» S – S –связи и вновь образовывать их в «нужных» местах. Высокие концентрации этого фермента выявлены в ЭПР, где происходит сворачивание синтезированных секреторных белков. Другой фермент, пептидилпролин-изомераза – катализирует цис-,транс - изомеризацию пептидных связей, образованных остатками пролина, что помогает белковой молекуле принять правильную конфигурацию. В клетках выявлен целый класс белков, обладающих пролинизомеразной активностью, названных циклофилинами.
Кроме ферментов, в клетках существуют специализированные белки, обеспечивающие нахождение правильной пространственной конфигурации (белки-шапероны).


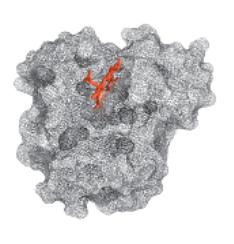



Рис. 8. Различные способы отображения третичной структуры молекулы белка (миоглобин спермы кита).
(а) области организации вторичной структуры в виде лент, отчетливо различаются 6 спиральных участков;
(б) «плоское» изображение поверхности молекулы;
(с) контурное изображение поверхности молекулы с визуализацией «карманов», т.е участков где потенциально могут присоединятся другие молекулы.
(г) Изображение аминокислотных остатков в соединительных петлях;
(е) пространственная модель со всеми атомами боковых цепей аминокислот лежащих на поверхности. Атомы представлены в виде сфер размерами в соответствии с Ван-дер-Ваальсовыми радиусами. Красным цветом выделены атомы гемовой группы, синим цветом – остатки гидрофобных аминокислот Leu, Ile, Val, и фенилаланин





А. Б. В.
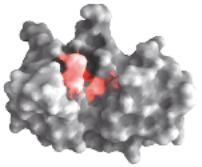
Рис. 9. Изображения трехмерные структур небольшие белков. А. цитохром С ; Б- лизоцим; В – рибонуклеаза.
Каждый белок показан в виде контура поверхности (верхний рисунок) и в форме ленточного изображения вторичных структур (нижний рисунок) . Основные функциональные группы (гема цитохрома С, аминокислоты в активном центре лизоцима и рибонуклеазы) показаны красным цветом. Дисульфидные связи показаны желтым цветом.


1 2


3. 4.
Рис. Изображения третичной структуры молекул некоторых белков: 1. миоглобина 2. миозин 3. инсулин 4. рибонуклеаза А.
