
Первичная структура.
Как уже отмечали, пептиды и белки представляют собой полимеры , построенные из остатков α – аминокислот. Условно считается, сто пептиды содержат в молекуле до 100 аминокислотных остатков, что соответствует молекулярной массе до 10 000 Да. К белкам относят полипептиды, содержащие свыше 100 аминокислотных остатков м.м. от 103 до нескольких миллионов Да. Низкомолекулярные полипептиды (не более 10 аминокислотных остатков) называют олигопептидами.
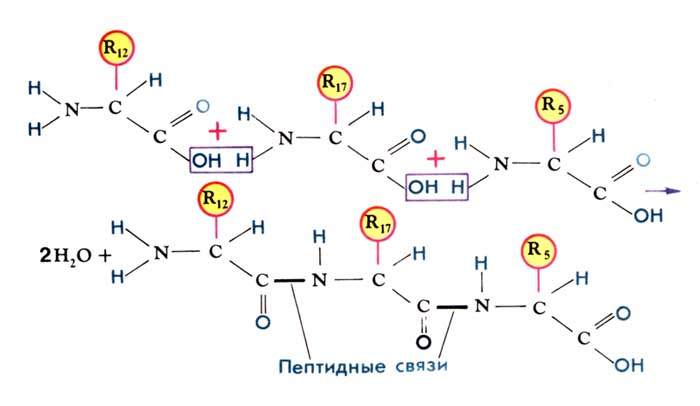
С химической точки зрения, пептидная (белковая) молекула формально представляет собой продукт реакции поликонденсации α – аминокислот, протекающей с образованием амидной (пептидной) связи между мономерами (аминокислотами). Конструкция полиамидной (полипептидной) цепи одинакова для всего многообразия пептидов и белков. Это цепь имеет неразветвленное строение и состоит из чередующихся амидных (СОNH) и метиновых ( CH) групп. Один конец цепи, на котором находится аминокислота со свободной NH2-группой называют N-концом, другой, на котором находится аминокислота с СООН- группой – С-концом. Полипептидные цепи принято записывать с N-конца.
Аминокислоты в пептидной цепи связаны между собой через карбоксильную группу одной и аминогруппу другой аминокислоты ( рис.3). Пептидная связь имеет некоторые черты двойной связи: вокруг нее нет свободного вращения, и она короче других С—N-связей. Все четыре атома пептидной связи (С, Н, N, О) и два α-углеродных атома лежат в одной плоскости. Кислород карбоксильной группы и водород NH-группы чаще всего находятся в транс-положении. Группа, связанная с α-углеродным атомом, обладает свободным вращением.
|
|
Рис. 3. Образование пептидных связей при синтезе молекул белка из аминокислот


Рис. 4. Параметры пептидной связи в в молекулах полипептидов
Форма пептидной молекулы определяется углами между плоскостями, в которых лежат атомы пептидной связи, разделенными друг от друга -СН—R-группами, что и ведет к возникновению определенных вторичных структур.
В пептидной группе –СОNH - атом углерода находится в состоянии SP2 – гибридизации. Неподеленная пара электронов атома азота вступает в сопряжение с π-электронами двойной связи С = О. С позиций электронного строения пептидная группа представляет собой трехцентровую сопряженную систему, электронная плотность в которой смещена в сторону более электроотрицательного атома кислорода. В результате сопряжения происходит некоторое выравнивание длин связей. Двойная связь С = О удлиняется до 0,124 нм против обычной длины 0,121 нм, а связь С- N становится короче – 0,132 нм по сравнению с обычной длиной этой связи (0,147 нм). Наличие такой плоской сопряженной системы является причиной снижения возможности вращения по оси С- N- связи (барьер вращения составляет 63-84 кДж/моль). Таким образом, электронное строение предопределяет достаточно жесткую плоскую структуру пептидной группы. При этом, α-углеродные атомы аминокислотных соседних остатков располагаются по разные стороны от связи С- N- , т.е. в более выгодном транс-положении: боковые радикалы аминокислотных остатков в этом случае будут наиболее удалены друг от друга в пространстве. Как видно, полипептидная цепь имеет удивительно однотипное строение и она представлена в виде расположенных под углом к друг другу плоскостей пептидных групп, соединенных через α-углеродные атомы связями Сα- N- и Сα- С-. Вращение вокруг этих связей весьма ограничено вследствие затруднений в пространственном расположении боковых радикалов аминокислотных остатков. Таким образом, электронное и пространственное пептидной группы во многом предопределяет структуру полипептидной цепи в целом.

