
- •1. Природа поверхні
- •1.1. Типи поверхонь
- •1.2. Електронні стани на ідеальній поверхні
- •1.3. Атомарно чиста поверхня
- •1.4. Реальна поверхня
- •1.4.1. Загальна характеристика реальної поверхні
- •1.4.2. Механічна обробка
- •1.4.3. Хімічна обробка
- •1.4.4. Термічне травлення
- •1.4.5. Електронні стани на реальній поверхні
- •1.5. Адсорбція молекул на поверхні напівпровідників
- •Контрольні запитання
1.5. Адсорбція молекул на поверхні напівпровідників
Наявність на поверхні напівпровідника адсорбованих молекул призводить до зміни електронних властивостей поверхні. Адсорбція молекул змінює поверхневий заряд і таким чином впливає на фотопровідність напівпровідника, змінює час релаксації фотопровідності, феноменологічний квантовий вихід внутрішнього фотоефекту й інші параметри, які визначають об’ємні властивості напівпровідника.
Фізична і хімічна адсорбція. При вивченні процесу адсорбції молекул на поверхні твердого тіла розрізняють фізичну і хімічну адсорбцію. Основна різниця між цими типами адсорбції полягає в характері сил взаємодії між адсорбованою частинкою (адсорбатом) і поверхнею твердого тіла (адсорбентом). У випадку, коли сили взаємодії між частинками адсорбата і адсорбента є силами електростатичного походження, така адсорбція називається фізичною. При фізичній адсорбції молекули адсорбата знаходяться на “великих” віддалях від молекул адсорбента і зберігають свою індивідуальність1.
Сили зв’язку між частинками в цьому випадку подібні до сил Ван-дер-Ваальса в реальних газах.
Якщо взаємодія між молекулами адсорбата і адсорбента є сильною обмінного типу, то така адсорбція називається хімічною або хемосорбцією. Хімічна адсорбція відбувається при малих відстанях, коли молекули адсорбата утворюють хімічну сполуку з молекулами адсорбента. При цьому відбувається обмінна взаємодія, яка включає йонну взаємодію.
Фізичній і хімічній адсорбції відповідають дві різні потенціальні криві, які характеризують залежність потенціальної енергії між молекулами адсорбента і адсорбата (рис. 1.4).
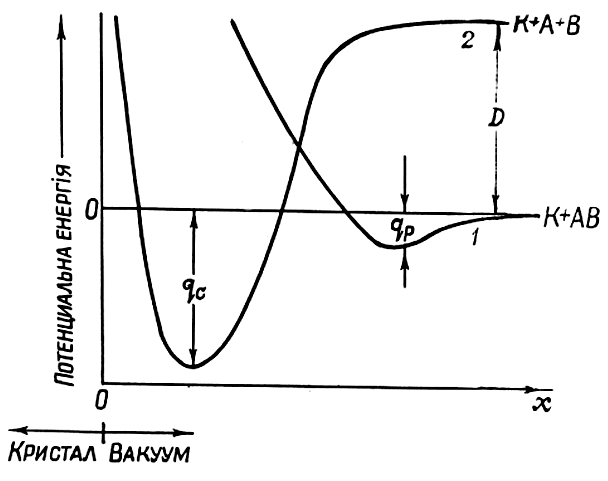
Рис. 1.4. Залежність потенціальної енергії системи, що складається з кристала К та адсорбованої молекули АВ, від відстані між поверхнею кристала і молекулою для фізичної (крива 1) та хімічної адсорбцій (крива 2). D – енергія дисоціації молекули; х – відстань до поверхні
Крива 1 характеризує енергію взаємодії між молекулами адсорбата і адсорбента у випадку фізичної адсорбції, крива 2 – у випадку хемосорбції. У випадку фізичної адсорбції величина енергії зв’язку адсорбованої молекули з поверхнею твердого тіла qp завжди менша, ніж у випадку хемосорбції (qp < qc), при цьому x1 > x2. Величина qp становить 0,01 – 0,10 еВ, а qc 1 еВ.
Якщо на поверхні твердого тіла адсорбуються молекули АВ, то у випадку фізичної адсорбції взаємодія адсорбованої молекули з молекулами (атомами) твердого тіла значно слабкіша, ніж взаємодія між частинками А і В самої молекули. Таку взаємодію можна умовно записати у вигляді К + АВ, де К – кристал. У випадку хемосорбції внаслідок сильної взаємодії з атомами адсорбента, молекула адсорбата розпадається на окремі складові і взаємодію можна записати у вигляді К + А + В.
При розгляді фізичної адсорбції адсорбовану молекулу і адсорбент розглядають як дві незалежні системи, які слабо взаємодіють між собою. При хемосорбції тверде тіло і тісно пов’язана з ним адсорбована молекула розглядаються як єдина квантово-механічна система з сильною взаємодією між частинками. У цьому випадку адсорбована газова молекула утворює хімічну сполуку з твердим тілом.
Необхідно зазначити, що в одному і тому ж стані не може бути одночасно фізичної і хімічної адсорбції, тобто не може бути двох мінімумів на одній і тій же потенціальній кривій.
Як правило, хімічна адсорбція є активованою, тобто для її здійснення необхідна певна енергія активації. У цьому випадку ймовірність f закріплення адсорбованої молекули на центрі адсорбції експоненційно залежить від температури f~exp(Ea/kT), де Ea – енергія активації процесу хемосорбції. При активованій адсорбції рівновага між газовою фазою і твердим тілом встановлюється повільно і процес адсорбції прискорюється з підвищенням температури.
Неактивована адсорбція характеризується практично миттєвим встановленням рівноваги між газовою фазою і твердим тілом. Слід мати на увазі, що наявність енергії активації не є свідченням наявності хемосорбції, так само як і її відсутність не є свідченням фізичної адсорбції. Хемосорбція, яка є реакцією утворення хімічної сполуки, може протікати і без активації, якщо при цьому не потрібно розривати зв’язки в середині молекули, яка адсорбується. У випадку фізичної адсорбції енергія активації може не дорівнювати нулеві (Ea 0), якщо між адсорбованими частинками діють сили відштовхування.
Вважають, що хемосорбція викликає зміну електропровідності матеріалу, а фізична не викликає такої зміни. Але й цей критерій не є однозначним. Тому слід мати на увазі, що строгих експериментальних критеріїв розділення фізичної і хімічної адсорбції поки що не існує.
Поверхневі стани адсорбційного походження. При адсорбції молекул на ідеальній поверхні напівпровідника можливе утворення локальних електронних станів. Механізм утворення поверхневих рівнів, пов’язаних з адсорбцією, пояснює електронна теорія хемосорбції, розроблена Ф. Волькенштейном. Згідно з цією теорією, при хемосорбції на поверхні кристала утворюється електронний стан, аналогічний домішковому стану в глибині кристала. Енергетичне розташування у забороненій зоні локального рівня, пов’язаного з хемосорбцією, визначається як природою адсорбованої частинки, так і властивостями гратки адсорбента.
Адсорбована частинка може або захоплювати електрони, виступаючи як поверхневий акцептор, або віддавати електрони у кристал, будучи донором. У залежності від форми зв’язку між частинкою і кристалом (йонний, ковалентний, проміжний), ступінь локалізації електрона в області адсорбованої частинки може бути різним.
Адсорбовані частинки, які характеризуються високою спорідненістю до електрона, виступають у ролі акцептора. Вони можуть перебувати у двох зарядових станах – нейтральному або негативно зарядженому. При підвищеній спорідненості адсорбованих частинок до дірок вони виступають в ролі донорних центрів. Такі центри можуть бути або нейтральними або позитивно зарядженими.
Типовим прикладом частинок, адсорбція яких призводить до утворення на поверхні Gе акцепторних центрів, є кисень. Адсорбовані на поверхні Ge молекули води утворюють донорні центри.
Ймовірність зарядження поверхні напівпровідника при адсорбції у стані термодинамічної рівноваги визначається ймовірністю заповнення електроном (діркою) поверхневого рівня, утвореного внаслідок адсорбції, тобто описується функцією Фермі-Дірака
![]()
де ЕА – енергетичне положення поверхневого рівня адсорбційної природи, F – рівень Фермі (хімпотенціал) у квантово-механічній системі кристал-адсорбована частинка.
Положення рівня F на поверхні і в глибині кристала в стані рівноваги однакове. Тому ймовірність зарядження поверхні напівпровідника при адсорбції залежить від об’ємних властивостей (тип і концентрація легуючих домішок, концентрація власних дефектів). Окрім цього, ймовірність зарядження поверхні залежить від температури.
У залежності від зарядового стану адсорбованих на поверхні напівпровідника частинок, розрізняють сильну і слабку форми хемосорбції. Якщо адсорбована частинка перебуває в зарядженому стані, то така форма хемосорбції називається сильною (або міцною). В цьому випадку вільні носії заряду об’єму кристала беруть безпосередню участь у хемосорбційному зв’язку. Якщо адсорбована частинка залишається нейтральною, то така форма хемосорбції називається слабкою. При даній формі хемосорбції зв’язок між адсорбованою частинкою і кристалом здійснюється без участі електронів кристала.
Отже, в розробленій Волькенштейном сучасній теорії хемосорбції вважається, що перехід адсорбованої на поверхні твердого тіла частинки із зарядженого стану в нейтральний не означає її десорбції, а лише зміну форми зв’язку між частинкою і твердим тілом. Нейтралізація адсорбованої частинки означає лише перехід від сильнішого зв’язку до слабшого.
Вплив адсорбції на фізичні властивості напівпровідників. Наявність на поверхні напівпровідників адсорбованих молекул різних речовин істотно впливає на фізичні властивості матеріалу (робота виходу, електропровідність та ін.). Дослідження впливу адсорбції різних газів на властивості напівпровідників проводились на Ge, Si, Cu2O, CuO, ZnO, PbS та ін. Найповніше дослідження виконані на Ge i Si.
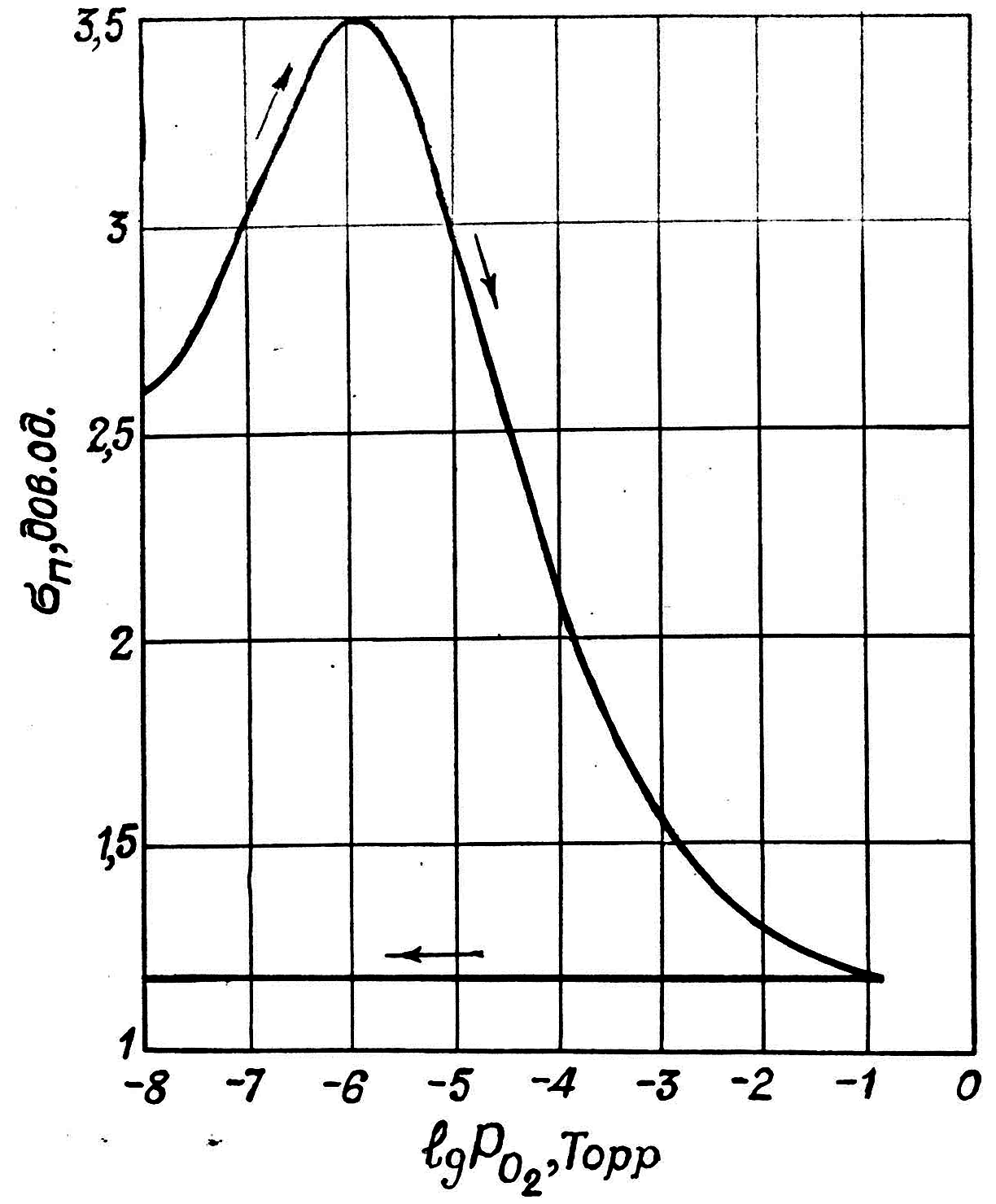
Встановлено, що при адсорбції молекул кисню на поверхні Ge в умовах низького тиску O2 (p 10-8 – 10-6 Торр) величина поверхневої провідності п при 300 К спочатку збільшується зі збільшенням тиску O2, а потім при p > 10-6 Торр – зменшується. При р 10-3 Торр величина досягає значення меншого, ніж для чистої поверхні германію (рис. 1.5, а).
а б
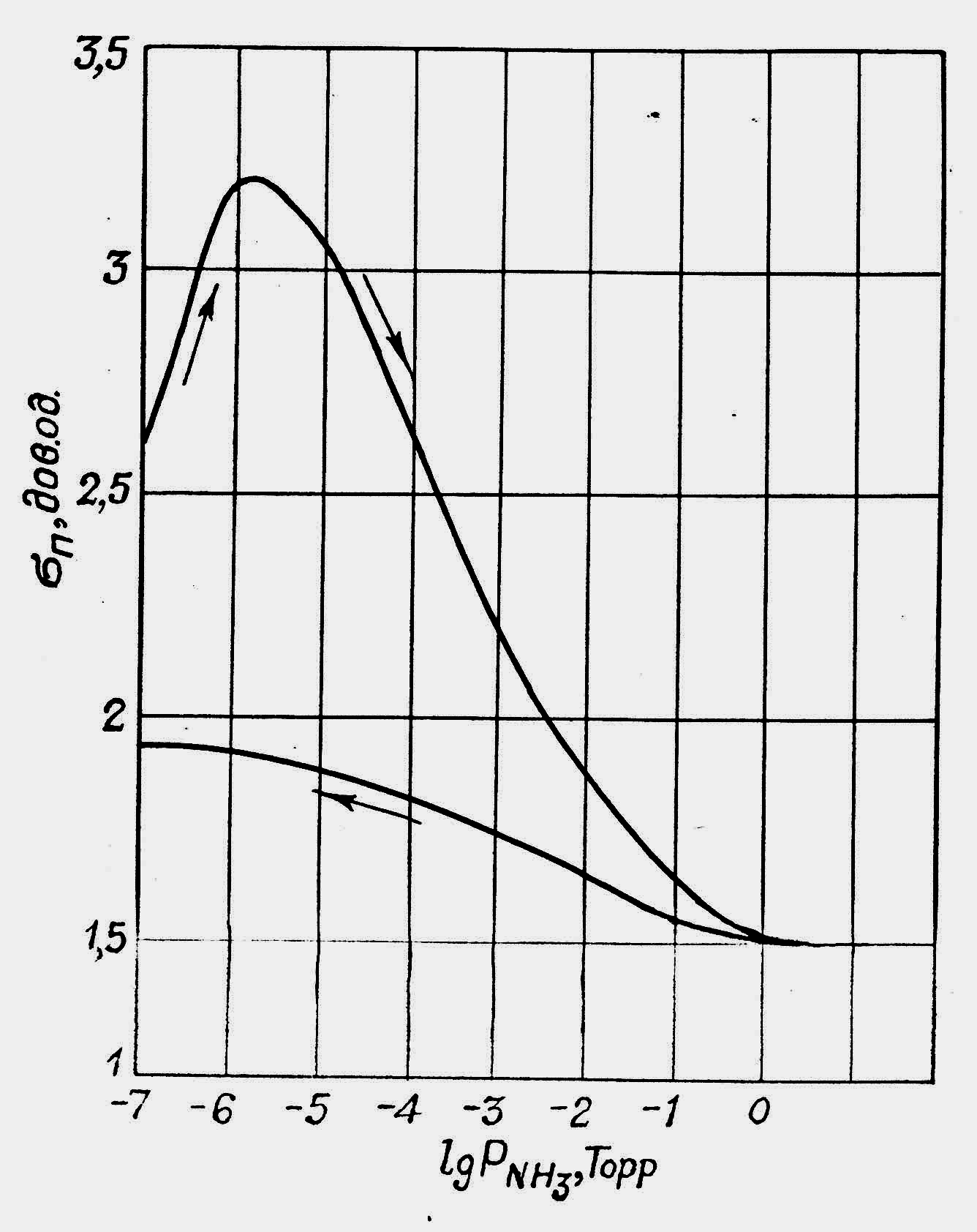
Рис. 1.5. Залежність поверхневої провідності германію від тиску пари:
а – кисню; б – аміаку
Зменшення тиску O2 до 10-8 Торр і тривала витримка зразка в цих умовах не впливала на величину п. Подібна зміна п спостерігалась і при адсорбції інших газів, наприклад, аміаку (рис. 1.5, б). Ряд газів (Ar, Kr, H2, N2) не впливали на величину п, а адсорбція молекул окису вуглецю (СО) призводила лише до збільшення п.
Очевидно, на величину п впливають лише ті гази, які хімічно взаємодіють з поверхнею германію.
Вплив
адсорбції молекул О2
на величину п
кристалів Ge
можна пояснити так. Чиста поверхня Ge
характеризується наявністю ненасичених
валентних зв’язків поверхневих атомів,
що може призвести до утворення поверхневих
станів акцепторного типу, які частково
заповнені електронами захопленими iз
приповерхневих атомів Ge. Для забезпечення
умови електронейтральності на поверхні
повинна бути відповідна кількість не
зв’язаних дірок. Тому провідність такої
поверхні є дірковою. Адсорбція молекул
O2,
які характеризуються великою
електронегативністю, призводить до
збільшення п.
В області максимальних значень поверхневої
провідності кількість адсорбованих
молекул кисню відповідає умові утворення
моно-атомного шару, коли один атом кисню
припадає на один поверхневий атом
германію. Подальше збільшення кількості
адсорбованого кисню призводить до
утворення поверхневих станів донорного
типу і тому п
зменшується. Залежність п= f(![]() )
характеризується незначним збільшенням
провідності при зменшенні тиску аміаку
(рис. 1.5, б),
що свідчить про слабку зворотність
процесу адсорбції NH3
на поверхні германію. Подібна залежність
п
від тиску спостерігається і для інших
газів, до складу молекул яких не входить
кисень. Очевидно,
на величину п
впливають лише ті гази, які хімічно
взаємодіють з поверхнею Ge.
)
характеризується незначним збільшенням
провідності при зменшенні тиску аміаку
(рис. 1.5, б),
що свідчить про слабку зворотність
процесу адсорбції NH3
на поверхні германію. Подібна залежність
п
від тиску спостерігається і для інших
газів, до складу молекул яких не входить
кисень. Очевидно,
на величину п
впливають лише ті гази, які хімічно
взаємодіють з поверхнею Ge.
Дослідження впливу адсорбції різних газів на роботу виходу і провідність дозволили встановити наявність кореляції між знаком зміни роботи виходу і провідності для різних напівпровідників р- і n-типу.
Адсорбція пари води, спирту, ацетону і ряду інших речовин, як правило, призводить до вигину зон вниз, що впливає як на провідність, так і на роботу виходу.
Кисень звичайно збільшує роботу виходу і провідність кристалів р-типу, тобто поверхня заряджається негативно. При адсорбації однієї і тієї ж речовини на різних адсорбентах знак заряду на поверхні може бути різним (табл. 1.2).
З вимірів зміни провідності при зміні вигину зон за допомогою адсорбції можна одержати кількісні дані про величину поверхневого потенціалу при адсорбції даного газу, а також про тип рівнів, які утворюються при адсорбції, їх концентрацію та енергетичне положення.
Таблиця 1.2
Залежність знака заряду поверхні від природи адсорбента
при адсорбції деяких газів
Адсор-бат |
А д с о р б е н т |
|||||
Cu2O |
CuO |
NiO |
MnO2 |
Ge |
ZnO |
|
O2 |
- |
- |
- |
- |
- |
- |
CO |
+ |
|
+ |
- |
+ |
0 |
CO2 |
|
- |
- |
|
+ |
0 |
H2O |
+ |
|
|
- |
+ |
|
Примітка. Через “0” позначена відсутність впливу хемосорбції на заряд поверхні.
