
- •Содержание
- •Введение
- •1 Инженерное образование
- •1.1 Овладение знаниями
- •1.2 Фактические знания инженера
- •1.3 Техническое образование в России
- •1.4 Подготовка инженера в высшем учебном заведении
- •1.4.1 Основные умения инженера
- •1.4.2 Требования к основной образовательной программе
- •1.5 Научные и инженерные основы технологии
- •1.5.1 Инженерное дело
- •1.5.2 Роль инженерного дела
- •1.5.3 Различие между наукой и инженерным делом
- •1.5.4 Специализация в инженерном деле
- •1.6 Основные свойства инженера
- •1.6.1 Представление
- •1.6.1.1 Моделирование
- •1.6.1.2 Упрощения, предположения, идеализация
- •1.6.1.3 Оптимизация
- •1.6.2 Формулировка задачи
- •1.6.3 Поиски возможных решений
- •1.6.4 Принятие решения
- •1.6.5 Спецификация решений
- •1.7 Квалификация инженера
- •1.7.1 Квалификационная характеристика выпускника по направлению подготовки «Химическая технология
- •1.7.2 Виды профессиональной деятельности выпускника
- •1.7.3 Квалификационные требования
- •1.8 Инженерные задачи
- •1.9 Инженерное дело на практике
- •1.10 Учебный план подготовки инженеров
- •2 Производство энергонасыщенных материалов и изделий
- •2.1 История возникновения и развития энергонасыщенных материалов и изделий
- •2.2 Открытие бризантных взрывчатых веществ
- •2.2.1 Применение бризантных взрывчатых веществ в артиллерии
- •2.2.2 Развитие отечественного производства бризантных взрывчатых веществ
- •2.3 История создания отечественных ракетных зарядов
- •2.3.1 Ракетные заряды из пироксилинотротилового пороха
- •2.3.2 Разработка нитроглицериновых баллиститных порохов для ствольной артиллерии
- •2.4 История развития и совершенствования производства отечественных боеприпасов
- •2.4.1 Стрелковые боеприпасы
- •2.4.2 Артиллерийские боеприпасы
- •2.5 История высшей школы по подготовке специалистов для отечественной пороховой промышленности
- •2.5.1 Бийский технологический институт Алтайского государственного университета им. И.И. Ползунова
- •2.5.2 История создания кафедры «Химическая технология высокомолекулярных соединений» Бийского технологического института
- •2.5.3 История создания кафедры «Технология химического машиностроения» Бийского технологического института
- •2.6 Классификация взрывчатых веществ
- •2.6.1 Инициирующие взрывчатые вещества
- •2.6.2 Бризантные взрывчатые вещества
- •2.6.2.1 Азотнокислые эфиры (нитраты)
- •2.6.2.2 Нитросоединения
- •2.6.3 Взрывчатые смеси, содержащие окислители
- •2.6.4 Метательные вв
- •2.6.4.1 Дымный порох
- •2.6.4.2 Нитроцеллюлозные пороха
- •2.7 Химия и технология получения бризантных вв
- •2.7.1 Технология получения основных ароматических
- •2.7.1.1 Тринитротолуол
- •2.7.1.2 Тринитрофенол
- •2.7.2 Технология получения нитросоединений алифатического ряда (нитропарафины)
- •2.7.2.1 Нитрометан
- •2.7.2.2 Тринитрометан
- •2.7.3 Технология получения алифатических
- •2.7.3.1 Гексоген
- •2.7.3.2 Октоген
- •2.7.4.1 Глицеринтринитрат
- •2.7.4.2 Пентаэритриттетранитрат
- •Литература
2.7.1.2 Тринитрофенол
Нитропроизводные фенолов, а также их соли находят применение в качестве ВВ, полупродуктов органического синтеза и гербицидов. Гидроксильные группы в фенолах сильно активируют ароматическое ядро в реакциях электрофильного замещения. В результате сильного эффекта сопряжения происходит повышение электронной плотности в орто- и параположениях ароматического ядра. Поэтому нитрование фенола можно осуществлять даже очень слабой кислотой. Однако на практике, как правило, предпочитают использовать для нитрования фенолов крепкие кислоты, что позволяет проводить процесс в аппаратах из черных металлов.
Тринитрофенол (пикриновая кислота) был получен Вульфом в 1771 г. В 1873 г. Шпренгель открыл способность пикриновой кислоты взрываться от гремучертутного капсюля-детонатора. Однако объем производства пикриновой кислоты уже в начале ХХ в. начал уменьшаться вследствие таких ее отрицательных свойств, как взаимодействие с оболочкой снаряда, приводящее к образованию высокочувствительного к удару пикрата железа, и непригодность для приготовления аммонитов. В настоящее время тротил почти полностью вытеснил пикриновую кислоту как ВВ и выпуск ее в мирное время ограничивается потребностью для производства красителей и хлорпикрина. В военное же время значение пикриновой кислоты как ВВ сохраняется.
При нитровании динитрофенола получают тринитрофенол. Основной изомер 2,4,6-тринитрофенол, или пикриновая кислота, представляет собой кристаллическое вещество, существующее в двух полиморфных формах; при кристаллизации из спиртового раствора образуются кристаллы орторомбической структуры, светло-желтого цвета, с температурой затвердевания 121,3°С и температурой плавления 122,5оС. Плотность кристаллической пикриновой кислоты 1,763 г/см3, жидкой 1,580 г/см3 (при температуре 124°С). Пикриновая кислота растворяется в ацетоне, диэтиловом эфире, метиловом спирте, глицерине, хлороформе, сероуглероде. Для производственной практики интерес представляет растворимость пикриновой кислоты в воде и серной кислоте.
Пикриновая кислота чувствительнее к удару, чем тротил. Она взрывается при падении груза массой 2 кг с высоты 80 см.
Взрывчатые свойства пикриновой кислоты:
расширение в бомбе Трауцля – 350 мл;
бризантность по Гессу – 16 мм;
скорость детонации – 7350 м/с;
объем газообразных продуктов взрыва – 730 л/кг;
теплота взрыва – 4020 кДж/кг;
температура взрыва – 33000С.
Для снаряжения боеприпасов применяют как пикриновую кислоту, так и ее сплавы, например, с динитронафталином. Такие сплавы обладают более низкой чувствительностью к механическим воздействиям, чем пикриновая кислота, и пониженной температурой плавления. Это позволяет снаряжать ими боеприпасы больших калибров. Применение находят сплавы из 60 % пикриновой кислоты и 40 % динитрофенола и из 40 % пикриновой кислоты и 60 % тринитрокре-зола.
При применении пикриновой кислоты для снаряжения боеприпасов особое внимание должно быть уделено полной изоляции ее от корпуса снаряда и взрывателя.
Получение пикриновой кислоты из фенола. Фенол можно непосредственно нитровать лишь очень разбавленными кислотами, что технически трудно и невыгодно. Нитрование же фенола кислотной смесью, даже средней крепости, почти невозможно, так как высокая скорость реакции и, следовательно, интенсивное выделение теплоты вызывает его окисление и осмоление. Для предотвращения этих процессов фенол предварительно сульфируют, получая менее реакционноспособное соединение – фенолсульфокислоту. Процесс сульфирования сопровождается выделением воды, разбавляющей серную кислоту, и является обратимым:
С6Н5ОН
+ H2SО4
![]() С6H4(ОН)
(SО3Н)
+ H2О
С6H4(ОН)
(SО3Н)
+ H2О
При действии на фенолсульфокислоту азотной кислотой в присутствии избытка концентрированной серной кислоты водород в ядре замещается нитрогруппой; в присутствии разбавленной серной кислоты сульфогруппы замещаются нитрогруппами:
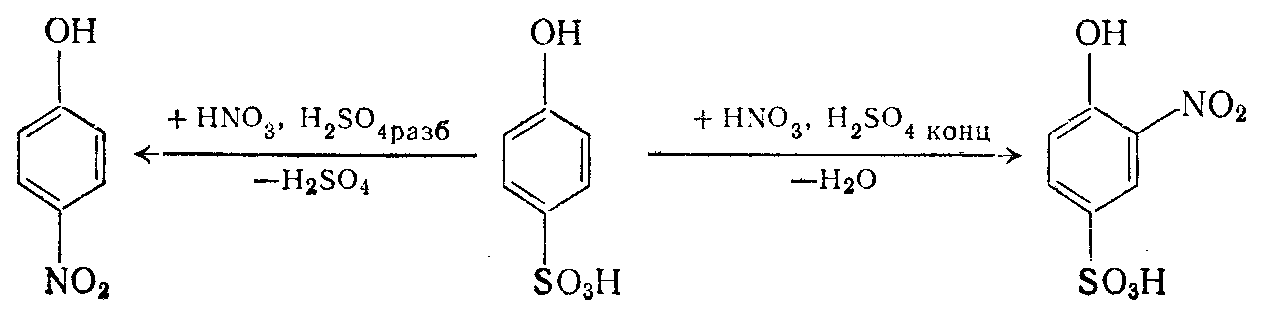
Следовательно, при введении трех нитрогрупп в молекулу фенола наиболее целесообразно проводить процесс в следующем порядке:

В этом случае при получении пикриновой кислоты из фенолсульфокислоты не требуется применения кислотооборота. Наиболее концентрированная кислотная смесь здесь нужна в начале процесса для введения первой нитрогруппы, в последующем нитросмесь разбавляется выделяющейся водой, что делает среду пригодной для замены сульфогруппы нитрогруппой. Нитрование протекает в наиболее благоприятных условиях – в гомогенной среде, так как сульфокислоты и их нитропроизводные хорошо растворяются в серной кислоте. В конце процесса выпадают кристаллы значительно менее растворимого тринитрофенола.
Схема процесса получения пикриновой кислоты из фенола в аппаратах периодического действия представлена на рисунке 2.9. Фенол подвозят на вагонетках 1 и с помощью лифта 2 поднимают на верхний этаж здания. Барабан помещают в плавитель 3, откуда расплавленный фенол стекает в мерник 4. В сульфуратор 5 через мерник 6 загружают олеум и при работающей мешалке медленно, в течение 1 ч, приливают фенол при постепенном повышении температуры от 20 до 90 °С. Затем массу выдерживают 3 ч при температуре 100 °С и передают в сборник 7 и далее в мерник 8. Раствор дисульфофенола загружают в нитратор 11 и из мерника 10 приливают отработанную кислоту для разбавления нитромассы, чтобы облегчить выход окислов азота и предотвратить вспенивание. Нитрование проводят азотной кислотой, подаваемой из мерника 9 из расчета 3,75 моль НNО3 на 1 моль фенола. Все необходимое количество азотной кислоты делят на три части в отношении 4:4:5, которые приливают при разных температурах: от 40 до 60°С, от 60 до 80°С и от 80 до 100°С соответственно.

По окончании слива дают выдержку 1 ч при температуре 100°С, затем содержимое аппарата охлаждают до температуры 30°С и через сборник 12 переводят в воронку 13 для отстаивания продукта от кислоты и механических примесей. После отстаивания из воронки спускают часть (от 60 до 65 %) отработанной кислоты в сборник 16, а остальную массу передают на центрифугу 14, где отработанная кислота отжимается от нитропродукта. Нитропродукт выгружают в декантатор 15, куда предварительно из сборника 17 наливают кислую промывную воду. Содержимое декантатора 15 перемешивают, затем сливают кислую воду и добавляют чистую воду, после чего массу переводят на центрифугу 18, где пикриновую кислоту промывают еще раз чистой холодной водой. Промывную воду собирают в сборник 17 и используют для предварительной промывки. Пикриновая кислота после промывки должна иметь кислотность не более 0,1 % и влажность не более 10 %. Сушат ее в барабанной сушилке 21. Выход пикриновой кислоты составляет 85 % от теоретического.
Промывная вода содержит в растворенном и взвешенном состоянии до 1,8 % пикриновой кислоты, поэтому перед спуском в водоемы ее очищают обычно путем восстановления пикриновой кислоты до триаминофенола железными стружками. Триаминофенол в дальнейшем окисляется кислородом воздуха с разрушением бензольного ядра.
