
- •Металлы, их положение в периодической системе химических элементов д. И. Менделеева, строение атомов (на примере натрия, алюминия). Характерные физические и химические свойства металлов.
- •Электролитическая диссоциация кислот, оснований, солей.
- •Задача. Вычислите массовую долю кислорода в карбонате кальция СаСо3.
- •Строение атома: ядро, электронная оболочка. Химический элемент. Схемы строения атомов на примере химических элементов третьего периода.
- •Углерод, его положение в периодической системе химических элементов д. И. Менделеева, строение атома, аллотропные видоизменения углерода. Оксиды углерода.
- •Железо, его положение в периодической системе химических элементов д. И. Менделеева, взаимодействие с серой, хлороводородной кислотой, растворами солей.
- •Водород, его положение в периодической системе химических элементов д. И. Менделеева, строение атома и молекулы, физические и химические свойства, получение, применение.
- •Аммиак, состав его молекулы, физические и химические свойства (отношение к воде, кислороду, кислотам), применение.
- •Воздух, его состав. Основные загрязнители атмосферы и способы их устранения.
- •Круговорот химических элементов в природе (на примере одного из элементов: углерода или кислорода). Роль живых существ в круговороте химических элементов.
- •Задача. Определите количество вещества осадка гидроксида меди (II), образующегося при взаимодействии хлорида меди (II) и 10 г раствора гидроксида натрия, с массовой долей 8%.
Аммиак, состав его молекулы, физические и химические свойства (отношение к воде, кислороду, кислотам), применение.
Ответ
можно начать с того, что для неметаллов
характерно существование газообразных
соединений с водородом. У азота таким
соединением является аммиак NH3, который
состоит из атома азота и трех атомов
водорода.
В молекуле аммиака три химических связи,
образованных по ковалентному полярному
механизму:
![]() Далее можно перейти к описанию .физических
свойств аммиака.
Аммиак (NH3) — газ, без цвета, с резким
запахом, легче воздуха (Мг = 17), хорошо
растворим в
в t°. «кип = -33,4 C°
Рассматривая химические свойства
аммиака, следует остановиться на
следующих группах реакций,
протекающих:
1. Без изменения степени окисления.
а) Взаимодействие с водой:
Далее можно перейти к описанию .физических
свойств аммиака.
Аммиак (NH3) — газ, без цвета, с резким
запахом, легче воздуха (Мг = 17), хорошо
растворим в
в t°. «кип = -33,4 C°
Рассматривая химические свойства
аммиака, следует остановиться на
следующих группах реакций,
протекающих:
1. Без изменения степени окисления.
а) Взаимодействие с водой:
![]() В результате растворения аммиака в воде
образуются гидроксид-ионы ОН и ионы
аммония NH. Раствор аммиака в воде называют
аммиачной водой или гидроксидом
аммония.
Следует отметить также, что раствор
аммиака в воде имеет щелочную реакцию
среды, что говорит об основном характере
гидроксида аммония.
б) Взаимодействие с кислотами:
В результате растворения аммиака в воде
образуются гидроксид-ионы ОН и ионы
аммония NH. Раствор аммиака в воде называют
аммиачной водой или гидроксидом
аммония.
Следует отметить также, что раствор
аммиака в воде имеет щелочную реакцию
среды, что говорит об основном характере
гидроксида аммония.
б) Взаимодействие с кислотами:
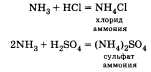 2. С изменением степеней окисления.
Взаимодействие с кислородом (при этом
продук ты реакции зависят от условий
ее проведения):
а) Горение в кислороде:
2. С изменением степеней окисления.
Взаимодействие с кислородом (при этом
продук ты реакции зависят от условий
ее проведения):
а) Горение в кислороде:
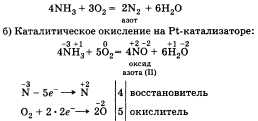 И в том и в другом случае аммиак за счет
атома азота проявляет свойства
восстановителя.
При описании получения и применения
аммиака важно подчеркнуть, что основной
способ связывания азота воздуха — это
соединение его с водородом — синтез
аммиака:
И в том и в другом случае аммиак за счет
атома азота проявляет свойства
восстановителя.
При описании получения и применения
аммиака важно подчеркнуть, что основной
способ связывания азота воздуха — это
соединение его с водородом — синтез
аммиака:
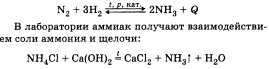 Используя аммиак, получают различные
соединения, например азотные удобрения,
азотную кислоту, нашатырный спирт.
Используя аммиак, получают различные
соединения, например азотные удобрения,
азотную кислоту, нашатырный спирт.
Воздух, его состав. Основные загрязнители атмосферы и способы их устранения.
Воздух
— смесь газов. Основные компоненты его
— азот (78,16% по объему), кислород (20,9%) и
инертные газы (0,94%). Переменные составные
части воздуха — углекислый газ и водяной
пар. Пыль и различные газы, например
SO2, H2S, оксиды азота и др., — примеси,
наличие которых в воздухе зависит от
местных условий, времени года, близости
промышленных предприятий и др.
Основное назначение воздуха — это
обеспечение дыхания живых организмов;
кроме того, воздух используется для
получения азота и кислорода, благородных
газов (из сжиженного воздуха), при его
наличии происходит горение топлива и
многие другие природные процессы.
Воздух — среда обитания всего живого
на Земле, поэтому охрана воздуха —
важнейшая задача человека. Первым шагом
на пути к этому должно стать увеличение
количества зеленых насаждений. Ведь
именно растения являются основными
поставщиками кислорода в атмосферу.
Происходит это в процессе фотосинтеза
:
![]() Далее важно остановиться на источниках
загрязнения атмосферы: химические
производства, продукты сжигания топлива,
выхлопные газы автомобилей, продукты
сжигания бытовых отходов (полиэтиленовые
пакеты, пластик, поливинилхлорид-ные
материалы и т. д.). Основные загрязнители
воздуха: пыль, оксиды азота (II), (IV), оксиды
серы (IV), (VI), сероводород, оксид углерода
(II). Следует отметить, что большая
загазованность крупных городов
отрицательно сказывается на экологической
обстановке, что в свою очередь влияет
на самочувствие людей, флору и
фауну.
В настоящее время основные экологические
проблемы атмосферы: а) образование
озоновых дыр;б) парниковый эффект
(выбросы СО2); в) увеличение
выбросов ионов тяжелых металлов (РЬ2+,
Hg2+, Cd2+ и др.); г) выпадение кислотных
дождей.
На сегодняшний день экологические
бедствия приняли широкие масштабы,
особенно в местах скопления крупных
промышленных производств (Центр России,
Урал).
Можно выделить несколько способов
очистки атмосферы: установка очистных
устройств на предприятиях (фильтры,
улавливатели газов, дегазаторы и т. д.),
создание малоотходных экологически
чистых производств, а также разработка
новых экологически чистых
материалов.
Задача.
Вычислите, какой объем ацетилена С2Н2
(при н. у.) образуется в результате
взаимодействия с водой 100 г технического
карбида кальция (СаС2), содержащего 4%
примеси. Уравнение реакции процесса:
СаС2 + 2Н2О = Са(ОН)2 + С2Н2.
Далее важно остановиться на источниках
загрязнения атмосферы: химические
производства, продукты сжигания топлива,
выхлопные газы автомобилей, продукты
сжигания бытовых отходов (полиэтиленовые
пакеты, пластик, поливинилхлорид-ные
материалы и т. д.). Основные загрязнители
воздуха: пыль, оксиды азота (II), (IV), оксиды
серы (IV), (VI), сероводород, оксид углерода
(II). Следует отметить, что большая
загазованность крупных городов
отрицательно сказывается на экологической
обстановке, что в свою очередь влияет
на самочувствие людей, флору и
фауну.
В настоящее время основные экологические
проблемы атмосферы: а) образование
озоновых дыр;б) парниковый эффект
(выбросы СО2); в) увеличение
выбросов ионов тяжелых металлов (РЬ2+,
Hg2+, Cd2+ и др.); г) выпадение кислотных
дождей.
На сегодняшний день экологические
бедствия приняли широкие масштабы,
особенно в местах скопления крупных
промышленных производств (Центр России,
Урал).
Можно выделить несколько способов
очистки атмосферы: установка очистных
устройств на предприятиях (фильтры,
улавливатели газов, дегазаторы и т. д.),
создание малоотходных экологически
чистых производств, а также разработка
новых экологически чистых
материалов.
Задача.
Вычислите, какой объем ацетилена С2Н2
(при н. у.) образуется в результате
взаимодействия с водой 100 г технического
карбида кальция (СаС2), содержащего 4%
примеси. Уравнение реакции процесса:
СаС2 + 2Н2О = Са(ОН)2 + С2Н2.

