
Химические реакции по количеству исходных веществ и продуктов реакции можно разделить на группы:
Тип химической реакции |
Определение |
Пример |
Соединения |
Реакции между двумя простыми веществами, или между несколькими сложными, при этом образуется одно сложное или более сложное вещество. |
CaO+H2O=Ca(OH)2 PbO+SiO2=PbSiO3 2Na+Cl2=2NaCl |
Разложения |
Реакции, при которых из одного вещества образуется несколько простых или сложных веществ. |
Cu(OH)2=CuO+H2O CaCO3=CaO+CO2 NH4Cl=NH3+HCl |
Замещения |
Реакции между сложным и простым веществами, при которых атомы простого вещества замещают один из атомов сложного |
CuSO4+Fe=FeSO4+Cu 2KBr+Cl2=2KCl+Br2 |
Обмена |
Реакции между двумя сложными веществами, при которых они обмениваются своими составными частями |
AgNO3+KBr=AgBr NaOH+HCl=NaCl+H2O |
Немного скажу об окислительно-восстановительных реакциях, т.е. реакциях при которых происходит изменение степенй окисления:
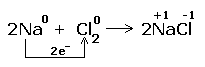
В этой реакции изменились степени окисления у хлора и натрия, следовательно она является окислительно - восстановительной. Натрий отдаёт электроны хлору, он является восстановителем; хлор принимает электроны, является окислителем. Процесс отдачи электронов называется окислением, процесс присоединения - восстановлением. С данными реакциями и процессами познакомимся в разделе" Окислительно-восстановительные реакции"
Познакомимся с основными классами неорганических веществ, которые более подробно изучим позже. В следующих разделах будут встречаться вещества, относящиеся к одному из классов. Данный материал носит ознакомительный характер.
Оксиды.. |
Оксиды-сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2 . |
CO2-оксид углерода (IV), H2O-оксид водорода |
Основания. |
Основания- сложные вещества, состоящие из атома металла , связанного с одной или несколькими гидроксогруппами -ОН |
NaOH- гидроксид натрия, Fe(OH)2- гидроксид железа(II) |
Кислоты. |
Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атомы металла, и кислотных остатков. |
HCl-соляная, или хлороводородная, H2SO4-серная кислота, H3PO4-фосфорная кислота |
Соли. |
Соли-сложные вещества, состоящие из атомов металла и кислотного остатка. |
NaCl-хлорид натрия, MgSO4-сульфат магния, FePO4-фосфат железа (III) |
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый М.В.Ломоносов. Основные положения этого учения изложены в работе "Элементы математической химии" (1741) и ряде других. Сущность учения Ломоносова можно свести к следующим положениям.
1. Все вещества состоят из "корпускул" (так Ломоносов называл молекулы).
2. Молекулы состоят из "элементов" (так Ломоносов называл атомы).
3. Частицы - молекулы и атомы - находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц.
4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ - из различных атомов.
Молекула - это наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее составом и химическим строением.
Атом - наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства элемента определяются строением его атома. Отсюда следует определение атома, соответствующее современным представлениям:
Атом - это электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов.
3) Квантовомеханическая теория строения атома. Периодический закон и периодическая система Д.И. Менделеева Квантовомеханическая теория строения атома. Квантовые числа. Форма и ориентация граничных поверхностей s-, p-, d- и f- орбиталей. Энергетические уровни электрона в атоме. Принцип Паули. Правило Хунда. Электронные структуры атомов элементов. Периодический закон и периодическая система элементов Д.И.Менделеева. Положение элемента в периодической системе как его важнейшая характеристика. Физический смысл периодического закона. Периодические и непериодические свойства элементов. Особенности электронного строения атомов элементов главных и побочных подгрупп.
Квантовые числа — энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями, l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m), l = 2 – d-орбиталями (5 типов), l = 3 – f-орбиталями (7 типов).
Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +l до -l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы:
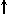 и
и 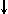 .
.
4) Принцип Паули, правило Хунда
Для изображения конфигурации атома (строения электронных оболочек) необходимо знать:
Место элемента в периодической таблице Д.И. Менделеева.
Общее число электронов в атоме (равно порядковому номеру).
Максимальное число электронов на уровне (2n2).
Порядок заполнения электронами подуровней и орбиталей, т. е. последовательность атомных орбиталей в порядке повышения энергии.
5)

6) Периодическая система химических элементов — естественная классификация химических элементов, которая является графическим (табличным) выражением периодического закона химических элементов. Структура ее, во многом сходная с современной, разработана Д. И. Менделеевым на основе периодического закона в 1869-1871 гг. Дмитрий Иванович Менделеев любил рассказывать, что идея периодической системы пришла ему во сне. Как и многие химики середины XIX века, он пытался как-то систематизировать огромное количество открываемых химических элементов. Менделеев тогда работал над книгой «Основы химии», и ему все время казалось, что для веществ, которые он описывал, непременно должен существовать какой-то способ упорядочивания, который сделает их больше чем просто случайным набором элементов. Именно такой способ упорядочивания, такой закон он и увидел во сне.
В своей таблице (сегодня мы ее называем периодической таблицей, или системой, элементов) Менделеев расположил химические элементы по рядам в порядке возрастания их массы, подобрав длину рядов таким образом, чтобы химические элементы в одной колонке имели похожие химические свойства. Так, например, правая крайняя колонка таблицы содержит гелий, неон, аргон, криптон, ксенон и радон. Это благородные газы* — вещества, которые неохотно реагируют с другими элементами и проявляют низкую химическую активность. В противоположность этому, элементы самой левой колонки — литий, натрий, калий и др. — реагируют с другими веществами бурно, процесс носит взрывной характер. Аналогичные утверждения можно сделать и о химических свойствах элементов в других колонках таблицы — внутри колонки эти свойства подобны, но варьируются при переходе от одной колонки к другой.
Нельзя не отдать дань смелости мысли Менделеева, решившегося опубликовать свои результаты. С одной стороны, таблица в первоначальном виде содержала много пустых клеток. Элементы, о существовании которых мы сейчас знаем, тогда еще только предстояло открыть. (Действительно, открытие этих элементов, включая скандий и германий, стало одним из величайших триумфов периодической системы.) С другой стороны, Менделееву пришлось допустить, что атомные веса некоторых элементов были измерены неправильно, так как в противном случае они не вписались бы в систему. И опять оказалось, что он был прав.
Периодическая система в своем первом варианте просто отражала существующее в природе положение дел. Как и в случае с кеплеровскими законами движения планет, таблица никак не объясняла, почему это должно быть именно так. И только с появлением квантовой механики и, в особенности,принципа запрета Паули стал понятен истинный смысл расположения элементов в периодической таблице.
Сегодня мы смотрим на периодическую таблицу с точки зрения того, как электроны заполняют электронные слои в атоме (см. Принцип Aufbau). Химические свойства атома (то есть то, какого рода связи будут образованы с другими атомами) определяются числом электронов в наружном слое. Так, у водорода и лития только по одному внешнему электрону, поэтому в химических реакциях они ведут себя похоже. В свою очередь, гелий и неон оба имеют заполненные внешние оболочки, и тоже ведут себя похоже, но совершенно не так, как водород и литий.
Химические элементы вплоть до урана (содержит 92 протона и 92 электрона) встречаются в природе. Начиная с номера 93 идут искусственные элементы, созданные в лаборатории. Пока самый большой заявленный учеными номер — 118.
7) Электроны в атоме занимают ряд вложенных слоев (см. Атом Бора), при этом воздействию другого атома могут подвергаться, как правило, только электроны, находящиеся во внешнем слое (он называется валентным слоем). Когда электроны в двух атомах выстраиваются так, что возникает сила, удерживающая вместе эти два атома, мы говорим, что образуется химическая связь. Различают несколько видов химической связи.
Ионная связь
Когда внешние электронные слои полностью заполнены, общая энергия атомов понижается. Например, атом натрия, имеющий на внешнем слое один электрон, охотно отдает этот электрон. И наоборот, атом хлора, которому не хватает одного электрона для заполнения внешнего слоя, стремится присоединить электрон для завершения уровня. Когда атомы натрия и хлора оказываются рядом, натрий отдает электрон, а хлор его принимает. При этом атом натрия, потеряв отрицательный заряд, становится положительно заряженным ионом натрия, а атом хлора, получив дополнительный электрон, становится отрицательно заряженным ионом хлора. По закону Кулона между двумя ионами возникает электростатическое притяжение, приводящее к образованию химической связи, которая и удерживает атомы вместе (см. также Правило октета).
С этой реакцией связано одно из чудес химии: бурно реагирующее вещество натрий и сильно ядовитый газ хлор, соединяясь, образуют обычную поваренную соль, широко применяемую в питании.
Ковалентная связь
Некоторые атомы, в основном это касается углерода, образуют связи по-другому. Когда два таких атома достаточно приближаются друг к другу, между ними возникает взаимодействие, которое можно рассматривать как длительный взаимный обмен электронами. Как будто атом бросает один из своих внешних электронов другому атому, затем ловит электрон другого атома и снова бросает его обратно в бесконечной игре в мяч. В соответствии с законами квантовой механики, такой обмен электронами вызывает силу притяжения, которая и удерживает атомы вместе.
Дело в том, что такой атом как углерод, имеющий четыре электрона во внешнем слое, может дополнить этот валентный слой до восьми электронов, образуя ковалентные связи с четырьмя другими атомами. Поэтому атомы углерода способны образовывать молекулы с длинными цепями, какие мы наблюдаем в биологических системах). Некоторые ученые (и я в том числе) даже утверждают, что вследствие этого свойства атома углерода вся жизнь во Вселенной, как и жизнь на Земле, должна быть углеродной.
Металлическая связь
В металлах образуется химическая связь еще одного вида. Каждый атом в металле отдает один или два подвижных электрона, как бы делясь этими электронами со всеми соседними атомами металла. Эти квазисвободные электроны образуют что-то вроде желе, в котором располагаются тяжелые положительные ионы металла. Все это напоминает трехмерную пространственную решетку из стеклянных шариков в вязкой патоке — если толкнуть один из таких шариков, он слегка сдвинется, но сохранит свое положение относительно других. Точно так же атомы металла, потревоженные внешним механическим воздействием, останутся связанными друг с другом благодаря «электронному желе» (или «электронному газу»). Вот почему, если ударить по металлу молотком, останется вмятина, но сам кусок металла, скорее всего, не разломится. Именно «электронное желе» делает металлы хорошими проводниками электричества (см. Электронная теория проводимости).
Водородная связь
Строго говоря, это не химическая связь в том смысле, в каком мы рассматривали предыдущие три типа связи. Это, скорее, притяжение между отдельными молекулами. Многие молекулы, хотя и являются в целом нейтральными (то есть имеют одинаковое количество отрицательных электронов и положительных протонов в своем ядре), оказываютсяполяризованными. Это значит, что некоторые части таких молекул имеют суммарный отрицательный заряд, в то время как другие части — положительный. Конечно, суммарный заряд молекулы нейтрален, но положительный и отрицательный заряды распределены неравномерно.
Представим, что полярная молекула, как ее называют, приближается своей отрицательной областью к молекуле-мишени. Электростатическая сила со стороны этой отрицательной области больше, чем со стороны положительной, т. к. положительная область расположена дальше. Эта электростатическая сила вызывает в молекуле-мишени передвижение электронов прочь от точки контакта, тем самым создавая в этом месте молекулы-мишени незначительный положительный заряд. В результате между двумя молекулами возникает сила притяжения и, следовательно, образуется связь.
Самая известная полярная молекула — это молекула воды. Отрицательный заряд собирается вокруг атома кислорода, приводя к образованию слабого положительного заряда около атомов водорода. Благодаря такой поляризации вода является хорошим растворителем. Ее молекулы способны создавать связи более прочные, чем те, которые удерживают молекулы-мишени вместе. Связи, создаваемые посредством положительно заряженных атомов водорода, называются водородными связями. Поскольку молекул водорода очень много в биологических молекулах, водородные связи в них образуются достаточно часто. В частности, именно водородные связи удерживают вместе две спирали молекулы ДНК.
8) кинетика – движение.. скорость химической реакции
Когда на экзамене абитуриента просят перечислить факторы, влияющие на скорость химической реакции, то обычно ожидают такого ответа: - природа реагирующих веществ, - концентрация реагентов, - температура, - наличие катализатора.
** На самом деле этот перечень шире: мы уже знаем, что на скорость гетерогенных реакций сильное влияние оказывает площадь поверхности раздела фаз и диффузия. Однако полезно обобщить перечисленные выше четыре фактора, понимая при этом, что они имеют отношение главным образом к гомогеннымреакциям.
Различают гомогенные и гетерогенные системы. Гомогенной называется система, состоящая из одной фазы. Гетерогенной — система, состоящая из нескольких фаз. Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства системы изменяются скачком. Примером гомогенной системы может служить любая газовая смесь (все газы при не очень высоких давлениях неограниченно растворяются друг в друге), хотя бы смесь азота с кислородом. Другим примером гомогенной системы может служить раствор хлорида натрия, сульфата магния, азота и кислорода в воде. В каждом из этих двух случаев система состоит только из одной фазы: из газовой фазы в первом примере и из водного раствора во втором. Если реакция протекает в гомогенной системе, то она идет во всем объеме этой системы.
Если реакция протекает между веществами, образующими гетерогенную систему, то она может идти только на поверхности раздела фаз, образующих систему. Например, растворение металла в кислоте: Fe+2HCl=FeCl2 + H2 может протекать только на поверхности металла, потому что только здесь соприкасаются друг с другом оба реагирующих вещества. В связи с этим4скорость гомогенной реакции и скорость гетерогенной реакции определяются различно, Скорость гомогенной реакции определяется количеством вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объёма системы.
Константа скорости реакции - является коэффициентом пропорциональности в кинетическом уравнении. Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или их произведение равно единице. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
9) Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации с, температуры t , присутствия катализаторов, а также от некоторых других факторов (например, от давления - для газовых реакций, от измельчения - для твердых веществ, от радиоактивного облучения).
Влияние концентраций реагирующих веществ. Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число же столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ:
Cкорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Влияние температуры .
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа:
При повышении температуры на каждые 10о скорость большинства реакций увеличивается в 2-4 раза.
10) Принцип Ле Шателье
При известных ΔH реакции или при Δn ≠ 0 на химическое равновесие можно воздействовать изменением температуры или давления. Химическое равновесие может быть смещено изменением концентраций реагентов. Другими словами, равновесие можно сместить внешним воздействием, руководствуясь принципом Ле Шателье: если на равновесную систему оказывать внешнее воздействие, то равновесие смещается в сторону, противодействующую этому воздействию.
Влияние температуры. Для реакций, идущих с уменьшением энтальпии (экзотермических), повышение температуры будет препятствовать протеканию прямого процесса, то есть смещать реакцию в сторону исходных веществ. Эндотермические реакции при этом будут смещаться в сторону конечных продуктов. Например, при обычных условиях реакция N2 + O2 не идет (ΔH > 0), но повышение температуры может сделать эти реакцию осуществимой. Реакция CO + 1/2O2 = CO2, ΔH < 0 с повышением температуры будут смещаться в сторону исходных веществ.
Влияние давления. Если реагируют газообразные вещества, то при неизменном числе молей начальных и конечных реагентов повышение общего давления не приведет к смещению равновесия. Если число молей при реакции меняется, то изменение общего давления приведет к смещению равновесия. В частности, реакция 2CO + O2 = 2CO2, протекающая с уменьшением Δn, при повышении общего давления сместится в сторону образования СO2.
Влияние концентраций. В тех реакциях, в которых лучше оперировать концентрациями (реакции в растворах), увеличение концентраций исходных веществ приводит к смещению равновесия в сторону конечных продуктов и наоборот. Так, в реакции этерификации (образование сложного эфира)
11) Растворы - однородная многокомпонентная система, состоящая из растворителя, растворённых веществ и продуктов их взаимодействия.
Могут существовать растворы твердых, жидких и газообразных веществ в жидких растворителях, а также однородные смеси (растворы) твердых, жидких и газообразных веществ. Как правило, вещество, взятое в избытке и в том же агрегатном состоянии, что и сам раствор, принято считать растворителем, а компонент, взятый в недостатке - растворенным веществом.
В зависимости от агрегатного состояния растворителя различают газообразные, жидкие и твердые растворы.
Газообразными растворами являются воздух и другие смеси газов.
К жидким растворам относят гомогенные смеси газов, жидкостей и твердых тел с жидкостями.
Твердыми растворами являются многие сплавы, например, металлов друг с другом, стёкла. Наибольшее значение имеют жидкие смеси, в которых растворителем является жидкость. Наиболее распространенным растворителем из неорганических веществ, конечно же, является вода. Из органических веществ в качестве растворителей используют метанол, этанол, диэтиловый эфир, ацетон, бензол, четыреххлористый углерод и др.
Читайте лекции, в инете воды много..
12) (слишком много и непонятно.. всё что было..) Растворение веществ сопровождается тепловым эффектом: выделением или поглощением теплоты - в зависимости от природы вещества. При растворении в воде, например, гидроксида калия, серной кислоты наблюдается сильное разогревание раствора, т.е. выделение теплоты, а при растворении нитрата аммония - сильное охлаждение раствора, т.е. поглощение теплоты. В первом случае осуществляется экзотермический процесс (∆H < 0), во втором - эндотермический (∆H > 0). Теплота растворения ∆H - это количество теплоты, выделяющееся или поглощающееся при растворении 1 моль вещества. Так, для гидроксида калия ∆H ° = -55,65 кДж/моль, а для нитрата аммония ∆H ° = +26,48 кДж/моль.
В результате химического взаимодействия растворенного вещества с растворителем образуются соединения, которые называют сольватами (или гидратами, если растворителем является вода). Образование таких соединений роднит растворы с химическими соединениями.
Великий русский химик Д.И. Менделеев создал химическую теорию растворов, которую он обосновал многочисленными экспериментальными данными, изложенными в его книге «Исследования водных растворов по их удельному весу», вышедшей в 1887 г. «Растворы суть химические соединения, определяемые силами, действующими между растворителем и растворенным веществом», - писал он в этой книге. Теперь известна природа этих сил. Сольваты (гидраты) образуются за счет донорно-акцепторного, ион-дипольного взаимодействий, за счет водородных связей, а также дисперсионного взаимодействия (в случае растворов родственных веществ, например бензола и толуола).
Особенно склонны к гидратации (соединению с водой) ионы. Ионы присоединяют полярные молекулы воды, в результате образуютсягидратированные ионы; поэтому, например, в растворе ион меди (II) голубой, в безводном сульфате меди он бесцветный. Многие из таких соединений непрочны и легко разлагаются при выделении их в свободном виде, однако в ряде случаев образуются прочные соединения, которые можно легко выделить из раствора кристаллизацией. При этом выпадают кристаллы, содержащие молекулы воды.
Кристаллические вещества, содержащие молекулы воды, называютя кристаллогидратами, а вода, входящая в состав кристаллогидратов, называется кристаллизационной. Кристаллогидратами являются многие природные минералы. Ряд веществ (в том числе и органические) получаются в чистом виде только в форме кристаллогидратов. Д.И. Менделеев доказал существование гидратов серной кислоты, а также ряда других веществ.
Таким образом, растворение - не только физический, но и химический процесс. Растворы образуются путем взаимодействия частиц растворенного вещества с частицами растворителя. Ученик Д.И. Менделеева Д.П. Коновалов всегда подчеркивал, что между химическими соединениями и растворами нет границ.
Жидкие растворы занимают промежуточное положение между химическими соединениями постоянного состава и механическими смесями. Как и химические соединения, они однородны и характеризуются тепловыми явлениями, а также часто наблюдающейся концентрацией - сокращением объема при смешивании жидкостей. С другой стороны, в отличие от химических соединений растворы не подчиняются закону постоянства состава. Они, как и смеси, могут быть легко разделены на составные части. Процесс растворения есть физико-химический процесс, а растворы - физико-химические системы.
Насыщенным называется раствор, который находится в динамическом равновесии с избытком растворённого вещества. Поместив в 100 г воды при 200C меньше 36 г NaCl мы получим ненасыщенный раствор. При нагревании смеси соли с водой до 1000C произойдёт растворение 39,8 г NaCl в 100 г воды. Если теперь удалить из раствора нерастворившуюся соль, а раствор осторожно охладить до 200C, избыточное количество соли не всегда выпадает в осадок. В этом случае мы имеем дело сперенасыщенным раствором. Перенасыщенные растворы очень неустойчивы. Помешивание, встряхивание, добавление крупинок соли может вызвать кристаллизацию избытка соли и переход в насыщенное устойчивое состояние.
Ненасыщенный раствор - раствор, содержащий меньше вещества, чем в насыщенном.
Перенасыщенный раствор - раствор, содержащий больше вещества, чем в насыщенном.
В лекция тоже самое, там понятнее
13) Дисперсные системы, образования из двух или большего числа фаз (тел) с сильно развитой поверхностью раздела между ними. В Дисперсные системы по крайней мере одна из фаз - дисперсная фаза - распределена в виде мелких частиц (кристалликов, нитей, плёнок или пластинок, капель, пузырьков) в другой, сплошной, фазе - дисперсионной среде.
Дисперсными системами называются механические смеси, коллоидные системы и растворы
Диспе́рсная систе́ма — это образованная из двух или более фаз (тел), которые совершенно или практически не смешиваются и не реагируют друг с другом химически. Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда). Если фаз несколько, их можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т. д.
Классификация дисперсных систем по агрегатному состоянию фаз
Дисперсионная среда |
Дисперсная фаза< |
||
газовая |
жидкая |
твёрдая |
|
Газовая |
Дисперсные систе- мы не образуются |
Туманы |
Дымы, пыль |
Жидкая |
Пены |
Эмульсии |
Суспензии |
Золи (коллоидные «растворы»)* |
|||
Твёрдая |
Аэрогели (пористые тела) |
Жидкие включения в твёрдых телах |
Твёрдые золи (рубиновое стекло) |
дисперсная система с относительно крупными по сравнению с молекулами газов и обычных жидкостей частицами (0,001—0,1 мкм); то же что коллоид. Влияние электролитов и влагосодержания на коллоидные системы почв. Коллоидный фосфат кальция малорастворим в воде и в молоке образует типичную неустойчивую коллоидную систему с гидрофобной дисперсной фазой
14) СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ при растворении в воде практически полностью диссоциируют на ионы. У таких электролитов ЗНАЧЕНИЕ СТЕПЕНИ диссоциации стремится К ЕДИНИЦЕ в разбавленных растворах. К сильным электролитам относят: 1) практически все соли; 2) сильные кислоты, например: H2SO4 (серная к-та), HCl (соляная к-та), HNO3 (азотная к-та); 3) все щёлочи, например: NaOH (гидроксид натрия), KOH (гидроксид калия). СЛАБЫЕ ЭЛЕКТРОЛИТЫ при растворении в воде почти не диссоциируют на ионы. У таких электролитов ЗНАЧЕНИЕ СТЕПЕНИ диссоциации стремится К НУЛЮ. К слабым электролитам относят: 1) слабые кислоты - H2S (сероводородная к-та), H2CO3 (угольная к-та), HNO2; 2) водный раствор аммиака NH3 * H2O СТЕПЕНЬ ДИССОЦИАЦИИ - это отношение числа частиц, распавшихся на ионы (Nд), к общему числу растворённых частиц (Nр), (обозначается греческой буквой альфа): a= Nд / Nр . Электролитическая диссоциация - процесс обратимый для слабых электролитов. Электролиты надеюсь знаешь,что такое, раз спрашиваешь. Это по-проще, если по-сложней, то смотри выше (по ряду ЭО). Электролитическая диссоциация - процесс обратимый для слабых электролитов.
15) Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц.
Гидролиз, дословно, - это разложение водой. Давая такое определение реакции гидролиза солей, мы подчеркиваем, что соли в растворе находятся в виде ионов, и что движущей силой реакции является образование малодиссоциирующих частиц (общее правило для многих реакций в растворах)
Какие типы гидролиза возможны? Поскольку соль состоит из катиона и аниона, то возможно три типа гидролиза:
гидролиз по катиону (в реакцию с водой вступает только катион);
гидролиз по аниону (в реакцию с водой вступает только анион);
совместный гидролиз (в реакцию с водой вступает и катион, и анион);
на всякий случай, вдруг, Внезапно! “Приведи пример” – вуаля..
Гидролиз солей Взаимодействие ионов соли с водой, приводящее к образованию молекул слабого электролита, называют гидролизом солей. Различают несколько вариантов гидролиза солей: 1. Гидролиз соли слабой кислоты и сильного основания: Na2CO3 + Н2О = NaHCO3 + NaOH CO32- + H2O = HCO3- + OН- (раствор имеет щелочную реакцию, реакция протекает обратимо) 2. Гидролиз соли сильной кислоты и слабого основания: СuСl2 + Н2О = CuOHCl + HCl Cu2+ + Н2О = CuOH+ + Н+ (раствор имеет кислую реакцию, реакция протекает обратимо) 3. Гидролиз соли слабой кислоты и слабого основания: Al2S3 + 6H2O = 2Al(OН)3 + 3H2S 2Аl3+ + 3S2- + 6Н2О = 2Аl(OН)3 + ЗН2S (Гидролиз в этом случае протекает практически полностью, так как оба продукта гидролиза уходят из сферы реакции в виде осадка или газа). Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
16) окислительно-восстановительные реакции (ОВР) (реакции окисления-восстановления) происходят с изменением степени окисления атомов, входящих в состав реагирующих веществ. При окислении веществ степень окисления элементов возрастает, при восстановлении - понижается.
Первоначально окислением называли только реакции веществ с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует.
В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого (окислителя)
Электронный баланс
Подбор коэффициентов в уравнениях окислительно-восстановительных реакций. Метод электронного баланса В простых уравнениях коэффициенты подбирают поэлементно в соответствии с формулой конечного продукта
“Приведи пожалуйста пример!” – Вуаля..
2Al + 3S = Al2S3
В более сложных уравнениях окислительно-восстановительных реакций подбор коэффициентов проводят методом электронного баланса.
Метод электронного баланса складывается из следующих этапов:
а) записывают схему реакции (формулы реагентов и продуктов), а затем находят элементы, которые повышают и понижают свои степени окисления, и выписывают их отдельно:
MnCO3 + KClO3 → MnO2 + KCl + CO2 ClV → Cl−I MnII → MnIV
б) составляют уравнения полуреакций восстановления и окисления, соблюдая законы сохранения числа атомов и заряда в каждой полуреакции:
полуреакция восстановления ClV + 6e− = Cl−I полуреакция окисления MnII − 2e− = MnIV
в) подбирают дополнительные множители для уравнения полуреакций так, чтобы закон сохранения заряда выполнялся для реакции в целом, для чего число принятых электронов в полуреакциях восстановления делают равным числу отданных электронов в полуреакции окисления:
ClV + 6e− = Cl−I * 1 MnII − 2e− = MnIV * 3
г) проставляют (по найденным множителям) стехиометрические коэффициенты в схему реакции (коэффициент 1 опускается):
3MnCO3 + KClO3 = 3MnO2 + KCl + CO2
д) уравнивают числа атомов тех элементов, которые не изменяют своей степени окисления при протекании реакции (если таких элементов два, то достаточно уравнять число атомов одного из них, а по второму провести проверку). Получают уравнение химической реакции:
3MnCO3 + KClO3 = 3MnO2 + KCl + 3CO2
е) проводят проверку по элементу, который не менял свою степень окисления (чаще всего это кислород):
слева 9 + 3 = 12 атомов O справа 6 + 6 = 12 атомов O
Подбор коэффициентов проведен правильно.
Другие примеры подбора коэффициентов:
а) (NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O 2CrVI + 6e− = 2CrIII * 1 2N−III − 6e− = N20 * 1
(для реакций внутримолекулярного окисления-восстановления, когда в одном и том же веществе атомы одного элемента окисляются, а атомы другого элемента восстанавливаются, расчет ведут на число атомов в одной формульной единице реагента - 2N−III и 2CrVI; простые вещества указывают формулами молекул - N20).
б) 2H2O2 = 2H2O + O2 O−I + e− = O−II * 2 2 O−I − 2e− = O20 * 1
(для реакций дисмутации, или диспропорционирования, самоокисления самовосстановления, в которых атомы одного и того же элемента в реагенте окисляются и восстанавливаются, дополнительные множители проставляют вначале в правую часть уравнения, а затем находят коэффициент для реагента).
в) 2H2S + SO2 = 3S + H2O S−II − 2e− = S0 * 2 SIV + 4e− = S0 * 1
(в случае реакций конмутации, или синпропорционирования, в которых атомы одного и того же элемента разных реагентов в результате их окисления и восстановления получают одинаковую степень окисления, дополнительные множители проставляют вначале в левую часть уравнения).
г) 3Zn + 8HNO3 = 3Zn(NO3)2 + 2NO + 4H2O Zn0 − 2e− = ZnII * 3 NV + 3e− = NII * 2
(коэффициенты для HNO3 находят суммированием числа атомов азота N в правой части уравнения) д) Zn + 2H2O + 2NaOH = Na2[Zn(OH)4] + H2 Zn0 − 2e− = ZnII 1 2HI + 2e− = H20 1
(здесь Zn - восстановитель, H2O - окислитель; в молекуле воды восстанавливается один атом водорода из двух: HIOH → H0).
Следует подчеркнуть, что подбор коэффициентов не предполагает установления вида продукта; наоборот, вначале составляют схему реакции, то есть устанавливают формулы продуктов, исходя из химических свойств реагентов, а затем подбирают коэффициенты в уравнении реакции.
Восстановители |
Окислители |
Металлы, водород, уголь. Окись углерода (II) (CO). Сероводород (H2S); оксид серы (IV) (SO2); сернистая кислота H2SO3 и ее соли. Галогеноводородные кислоты и их соли. Катионы металлов в низших степенях окисления:SnCl2, FeCl2, MnSO4, Cr2(SO4)3. Азотистая кислота HNO2; аммиак NH3; гидразин NH2NH2; оксид азота(II) (NO). Катод при электролизе. |
Галогены. Перманганат калия(KMnO4); манганат калия (K2MnO4); оксид марганца (IV) (MnO2). Дихромат калия (K2Cr2O7); хромат калия (K2CrO4). Азотная кислота (HNO3). Серная кислота (H2SO4) конц. Оксид меди(II) (CuO); оксид свинца(IV) (PbO2); оксид серебра (Ag2O); пероксид водорода (H2O2). Хлорид железа(III) (FeCl3). Бертоллетова соль (KClO3). Анод при электролизе. |
17) 18) 19) 20) Все сдавали уже, у всех всё есть..
21) Фазой называется макроскопическая физическая однородная часть вещества, отделенная от остальных частей системы границами раздела, так что она может быть извлечена из системы механическим путем.Эти три фазы (например, твёрдая, жидкая и газообразная).
Существует три состояния вещества, отличающиеся между собой силами взаимодействия атомов и молекул: твердое, жидкое и газообразное. Переход вещества из одного состояния в другое сопровождается большими затратами энергии, прикладываемой извне. Для твердого и жидкого состояния характерны небольшие расстояния между молекулами, между которыми действуют силы взаимного притяжения. По мере перехода вещества в жидкое, а затем в газообразное состояние эти расстояния увеличиваются, а силы их взаимодействия снижаются. Этот процесс наглядно представлен во время сварки, когда металл плавится, частично переходит в газообразное состояние, а затем возникают обратные процессы, именуемые кристаллизацией.
Процесс плавления металла в зоне сварочного шва приводит к возникновению сложных физико-химических процессов и к образованию характерного соединения, отличающегося по своей структуре от основного металла.
Химические процессы меняют свойства основного металла, в результате чего получаются новые соединения, имеющие отличные свойства. К основным химическим процессам относятся:
химические реакции, возникающие в газовой и жидкой фазах и на их границах;
образование оксидов, шлаков и других соединений, отличающихся своими химическими свойствами от основного металла.
