
- •Металлы, их положение в периодической системе химических элементов д. И. Менделеева, строение атомов (на примере натрия, алюминия). Характерные физические и химические свойства металлов.
- •Электролитическая диссоциация кислот, оснований, солей.
- •Задача. Вычислите массовую долю кислорода в карбонате кальция СаСо3.
- •Строение атома: ядро, электронная оболочка. Химический элемент. Схемы строения атомов на примере химических элементов третьего периода.
- •Углерод, его положение в периодической системе химических элементов д. И. Менделеева, строение атома, аллотропные видоизменения углерода. Оксиды углерода.
- •Железо, его положение в периодической системе химических элементов д. И. Менделеева, взаимодействие с серой, хлороводородной кислотой, растворами солей.
- •Водород, его положение в периодической системе химических элементов д. И. Менделеева, строение атома и молекулы, физические и химические свойства, получение, применение.
- •Аммиак, состав его молекулы, физические и химические свойства (отношение к воде, кислороду, кислотам), применение.
- •Воздух, его состав. Основные загрязнители атмосферы и способы их устранения.
- •Круговорот химических элементов в природе (на примере одного из элементов: углерода или кислорода). Роль живых существ в круговороте химических элементов.
- •Задача. Определите количество вещества осадка гидроксида меди (II), образующегося при взаимодействии хлорида меди (II) и 10 г раствора гидроксида натрия, с массовой долей 8%.
Железо, его положение в периодической системе химических элементов д. И. Менделеева, взаимодействие с серой, хлороводородной кислотой, растворами солей.
В
периодической таблице гимических
элементов Д. И. Менделеева железо Fe
расположено в 4-м периоде VIII группы
побочной подгруппы.
Распределение электронов по электронным
слоям в атоме железа выглядит так:
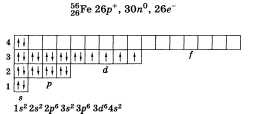
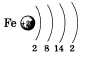 По желанию учащийся может привести
состав, графическую схему и электронную
формулу железа:
По желанию учащийся может привести
состав, графическую схему и электронную
формулу железа:
 Физические свойства железа известны
из повседневной жизни: металл, темно-серого
цвета, пластичный, электро- и теплопроводный,
тяжелый, притягивается магнитом.
Далее целесообразно отметить, что железо
— после алюминия — самый распространенный
в природе металл (общее содержание в
земной коре — 4,65% по массе). Известно
большое число минералов, в состав которых
входит железо: магнетит (магнитный
железняк) — Fe3O4, гематит (красный железняк)
— Fe2O3, железный шпат (сидерит) — FeCO3,
железный колчедан — FeS2 и др.
Железо проявляет химические свойства,
характерные для всех металлов. Оно
взаимодействует:
Физические свойства железа известны
из повседневной жизни: металл, темно-серого
цвета, пластичный, электро- и теплопроводный,
тяжелый, притягивается магнитом.
Далее целесообразно отметить, что железо
— после алюминия — самый распространенный
в природе металл (общее содержание в
земной коре — 4,65% по массе). Известно
большое число минералов, в состав которых
входит железо: магнетит (магнитный
железняк) — Fe3O4, гематит (красный железняк)
— Fe2O3, железный шпат (сидерит) — FeCO3,
железный колчедан — FeS2 и др.
Железо проявляет химические свойства,
характерные для всех металлов. Оно
взаимодействует:
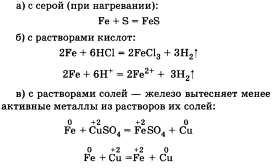 Получают железо восстановлением
(водородом, оксидом углерода (II), алюминием)
его из оксидов, а также при прохождении
электрического тока через растворы
солей. Можно привести примеры таких
реакций:
Получают железо восстановлением
(водородом, оксидом углерода (II), алюминием)
его из оксидов, а также при прохождении
электрического тока через растворы
солей. Можно привести примеры таких
реакций:
![]() При ответе следует обратить внимание,
что основное применение находят сплавы
железа с углеродом — чугун и сталь. Друг
от друга они отличаются различным
содержанием углерода: в чугуне его более
2%, а в стали 0,5—1,5%. Кроме того, для придания
особых свойств могут вводиться и другие
элементы (Si, Mn, Cr, Ni).
При ответе следует обратить внимание,
что основное применение находят сплавы
железа с углеродом — чугун и сталь. Друг
от друга они отличаются различным
содержанием углерода: в чугуне его более
2%, а в стали 0,5—1,5%. Кроме того, для придания
особых свойств могут вводиться и другие
элементы (Si, Mn, Cr, Ni).
Водород, его положение в периодической системе химических элементов д. И. Менделеева, строение атома и молекулы, физические и химические свойства, получение, применение.
Характеризуя
водород по положению в периодической
системе химических элементов Д. И.
Менделеева, следует обратить внимание
на особенности строения атома водорода
— самого простейшего из химических
элементов (состоит из ядра, представляющего
собой один протон, и одного электрона).
Такое строение обусловливает разнообразие
свойств водорода, его двойственное
положение в системе Д. И. Менделеева —
в I и VII группах (об этом можно рассказать
по желанию)*.
Наиболее распространенная степень
окисления водорода +1. Водороду свойственна
валентность, равная единице.
Молекула водорода двухатомная, связь
ковалент-ная неполярная. Схема образования
молекулы водорода:
![]() Водород — газ без цвета и запаха, плохо
растворим в воде, в 14,5 раз легче
воздуха.
л Так же как и у щелочных металлов (Li,
Na, К и др.), у Н на внешнем электронном
слое один электрон, с другой стороны,
так же как и элементам VII группы, водороду
не хватает одного электрона до его
завершения.
Водород — самый распространенный
элемент во Вселенной. На Земле водород
содержится в воде, природном газе,
нефти.
Получение водорода следует выразить
уравнениями химических реакций. Например,
в лаборатории водород получают при
взаимодействии металлов с растворами
кислот, например соляной:
Водород — газ без цвета и запаха, плохо
растворим в воде, в 14,5 раз легче
воздуха.
л Так же как и у щелочных металлов (Li,
Na, К и др.), у Н на внешнем электронном
слое один электрон, с другой стороны,
так же как и элементам VII группы, водороду
не хватает одного электрона до его
завершения.
Водород — самый распространенный
элемент во Вселенной. На Земле водород
содержится в воде, природном газе,
нефти.
Получение водорода следует выразить
уравнениями химических реакций. Например,
в лаборатории водород получают при
взаимодействии металлов с растворами
кислот, например соляной:
![]() В промышленности водород получают из
водяного пара при взаимодействии его
с коксом, который в основном состоит из
углерода, из природного газа метана СН4
и др.
При характеристике химических свойств
водорода необходимо записать уравнения
соответствующих реакций.
Водород может быть как восстановителем,
так и окислителем:
В промышленности водород получают из
водяного пара при взаимодействии его
с коксом, который в основном состоит из
углерода, из природного газа метана СН4
и др.
При характеристике химических свойств
водорода необходимо записать уравнения
соответствующих реакций.
Водород может быть как восстановителем,
так и окислителем:
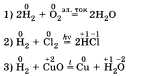 В этих реакциях водород проявляет
свойства восстановителя, его атомы
повышают степень окисления до
4-1.
В этих реакциях водород проявляет
свойства восстановителя, его атомы
повышают степень окисления до
4-1.
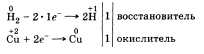 По
желанию учащийся может рассказать об
окислительных свойствах водорода,
которые он проявляет, например, при
взаимодействии с металлами:
По
желанию учащийся может рассказать об
окислительных свойствах водорода,
которые он проявляет, например, при
взаимодействии с металлами:
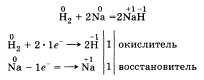 Говоря о применении водорода, стоит
рассказать о его использовании в синтезе
НСl и NH3, а также резке, сварке и получении
металлов, в переработке нефти и жиров.
Говоря о применении водорода, стоит
рассказать о его использовании в синтезе
НСl и NH3, а также резке, сварке и получении
металлов, в переработке нефти и жиров.
Задача. Какой объем кислорода и воздуха (н. у.) потребуется для сжигания 448 л метана СН4?


Вода, ее состав, строение молекулы, физические и химические свойства (разложение, отношение к натрию, оксидам кальция, серы (IV)). Основные загрязнители природной воды, очистка природных и сточных вод.
Вода
— самое распространенное в природе
соединение. Молекула ее состоит из двух
атомов водорода и одного атома кислорода
(Н2О).
Молекула воды имеет угловую форму и
образована по типу ковалентной полярной
химической связи:
![]() В ходе рассказа о физических свойствах
воды можно подчеркнуть, что это
единственное соединение, которое в
природных условиях существует в трех
агрегатных состояниях (твердом, жидком
и газообразном).
Рассказ о химических свойствах воды
целесообразно сопровождать записями
уравнений реакций.
В ходе рассказа о физических свойствах
воды можно подчеркнуть, что это
единственное соединение, которое в
природных условиях существует в трех
агрегатных состояниях (твердом, жидком
и газообразном).
Рассказ о химических свойствах воды
целесообразно сопровождать записями
уравнений реакций.
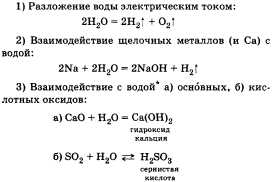 Далее следует рассказать о значении
воды в природе и жизнедеятельности
человека. Вода составляет 2/3 от массы
человеческого организма.
Рассказ будет выглядеть более полным,
если в нем удастся раскрыть важность
использования воды как универсального
растворителя в природе, быту, промышленности,
сельском хозяйстве. Основные источники
природной воды — лед, дождь, снег,
вода рек и озер. Из 10в18cт т. воды на Земле
лишь 3% приходится на пресную воду, из
которых 80% недоступно для использования.
По теоретическим расчетам максимальное
количество пресной воды, до-
Способность реагировать и с основными,
и с кислотными оксидами говорит об
амфотерных свойствах воды (об этом
учащийся говорит по желанию). ступной
для использования, составляет 40 000 км3
в год. Отсюда следует важность экономного
и разумного использования запасов
пресной воды, необходимость очистки
загрязненных природных и сточных вод.
К основным загрязнителям воды относятся:
промышленные и бытовые стоки, твердые
отходы, отходы сельского хозяйства
(удобрения), естественные примеси,
радиоактивные и тепловые
загрязнители.
Очистка воды производится в промышленных
масштабах на очистных сооружениях. В
общем случае очистка воды включает три
стадии: 1) первичная очистка проводится
с целью удаления механических примесей;
2) вторичная очистка, при которой
происходит разложение содержащихся
органических веществ под действием
микроорганизмов или хлора; 3) третичная
очистка включает биологическую,
химическую и физическую обработку вод.
Эта стадия позволяет довести сточные
и природные воды до такого уровня
чистоты, что она отвечает стандартам
на питьевую воду. Особое внимание в
последнее время уделяется чистоте
питьевой воды.
Далее следует рассказать о значении
воды в природе и жизнедеятельности
человека. Вода составляет 2/3 от массы
человеческого организма.
Рассказ будет выглядеть более полным,
если в нем удастся раскрыть важность
использования воды как универсального
растворителя в природе, быту, промышленности,
сельском хозяйстве. Основные источники
природной воды — лед, дождь, снег,
вода рек и озер. Из 10в18cт т. воды на Земле
лишь 3% приходится на пресную воду, из
которых 80% недоступно для использования.
По теоретическим расчетам максимальное
количество пресной воды, до-
Способность реагировать и с основными,
и с кислотными оксидами говорит об
амфотерных свойствах воды (об этом
учащийся говорит по желанию). ступной
для использования, составляет 40 000 км3
в год. Отсюда следует важность экономного
и разумного использования запасов
пресной воды, необходимость очистки
загрязненных природных и сточных вод.
К основным загрязнителям воды относятся:
промышленные и бытовые стоки, твердые
отходы, отходы сельского хозяйства
(удобрения), естественные примеси,
радиоактивные и тепловые
загрязнители.
Очистка воды производится в промышленных
масштабах на очистных сооружениях. В
общем случае очистка воды включает три
стадии: 1) первичная очистка проводится
с целью удаления механических примесей;
2) вторичная очистка, при которой
происходит разложение содержащихся
органических веществ под действием
микроорганизмов или хлора; 3) третичная
очистка включает биологическую,
химическую и физическую обработку вод.
Эта стадия позволяет довести сточные
и природные воды до такого уровня
чистоты, что она отвечает стандартам
на питьевую воду. Особое внимание в
последнее время уделяется чистоте
питьевой воды.
