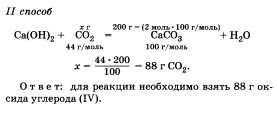- •Металлы, их положение в периодической системе химических элементов д. И. Менделеева, строение атомов (на примере натрия, алюминия). Характерные физические и химические свойства металлов.
- •Электролитическая диссоциация кислот, оснований, солей.
- •Задача. Вычислите массовую долю кислорода в карбонате кальция СаСо3.
- •Строение атома: ядро, электронная оболочка. Химический элемент. Схемы строения атомов на примере химических элементов третьего периода.
- •Углерод, его положение в периодической системе химических элементов д. И. Менделеева, строение атома, аллотропные видоизменения углерода. Оксиды углерода.
- •Железо, его положение в периодической системе химических элементов д. И. Менделеева, взаимодействие с серой, хлороводородной кислотой, растворами солей.
- •Водород, его положение в периодической системе химических элементов д. И. Менделеева, строение атома и молекулы, физические и химические свойства, получение, применение.
- •Аммиак, состав его молекулы, физические и химические свойства (отношение к воде, кислороду, кислотам), применение.
- •Воздух, его состав. Основные загрязнители атмосферы и способы их устранения.
- •Круговорот химических элементов в природе (на примере одного из элементов: углерода или кислорода). Роль живых существ в круговороте химических элементов.
- •Задача. Определите количество вещества осадка гидроксида меди (II), образующегося при взаимодействии хлорида меди (II) и 10 г раствора гидроксида натрия, с массовой долей 8%.
Строение атома: ядро, электронная оболочка. Химический элемент. Схемы строения атомов на примере химических элементов третьего периода.
В
результате экспериментов, посвященных
изучению строения атома, было установлено,
что атом состоит из положительно
заряженного ядра и электронной
оболочки.
Ядро образовано протонами и
нейтронами.
Протон — это частица, имеющая положительный
заряд (+1).
Нейтрон — это нейтральная частица,
заряд ее равен 0.
Из определений следует, что величина
заряда ядра атома равна числу протонов
и имеет положительное значение.
Электронная оболочка образована
электронами, заряд у которых отрицательный.
Число электронов равно числу протонов,
поэтому заряд атома в целом равен 0 (т.
е. атом электронейтральная частица).
Число протонов, а следовательно, заряд
ядра и число электронов численно равны
порядковому номеру химического
элемента.
Далее следует отметить, что практически
вся масса атома сосредоточена в ядре.
Это связано с тем, что масса электрона
настолько меньше массы протона или
нейтрона, что ею пренебрегают (не
учитывают).
Электроны двигаются вокруг ядра атома,
не беспорядочно, а в зависимости от
энергии, которой они обладают, образуя
так называемый электронный слой.
На каждом электронном слое может
располагаться определенное число
электронов: на первом — не больше двух,
на втором — не больше восьми, на третьем
— не больше восемнадцати.
Число электронных слоев определяется
по номеру периода, в котором расположен
химический элемент.
Число электронов на последнем (внешнем)
слое определяется по номеру группы
рассматриваемого элемента.
Так, например, кислород расположен во
втором периоде VI группы. Из этого следует,
что у него два электронных слоя и на
внешнем (втором) расположено шесть
электронов.
Электронные слои заполняются у атомов
постепенно, по мере увеличения общего
числа электронов, которое соответствует
порядковому номеру химического элемента.
В сумме на первых двух электронных слоях
может располагаться не более 10 электронов,
т. е. элементом, завершающим второй
период, является неон (Ne).
У атомов третьего периода в атоме
находится три электронных слоя. Первый
и второй электронные слои заполнены
электронами до предела. Для первого
представителя элементов третьего
периода натрия схема расположения
электронов в атоме выглядит так:
 Из схемы видно, что атом натрия имеет
заряд ядра +11. Электронную оболочку
атома составляют 11 электронов. На первом
электронном слое находится два электрона,
на втором — восемь, а на третьем — один
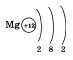
электрон. У магния, как элемента II группы
этого периода, на внешнем электронном
слое находится уже два электрона:
Из схемы видно, что атом натрия имеет
заряд ядра +11. Электронную оболочку
атома составляют 11 электронов. На первом
электронном слое находится два электрона,
на втором — восемь, а на третьем — один
электрон. У магния, как элемента II группы
этого периода, на внешнем электронном
слое находится уже два электрона:
 Для остальных элементов периода изменение
строения атома происходит аналогично.
У каждого последующего элемента, в
отличие от предыдущего, заряд ядра
больше на одну единицу и на внешнем
электронном слое расположено на один
электрон больше. Число электронов,
располагающихся на внешнем электронном
слое, равно номеру группы.
Завершает период аргон. Заряд его ядра
+18. Это элемент VIII группы, поэтому на
внешнем электронном слое его атома
находится восемь электронов:
Для остальных элементов периода изменение
строения атома происходит аналогично.
У каждого последующего элемента, в
отличие от предыдущего, заряд ядра
больше на одну единицу и на внешнем
электронном слое расположено на один
электрон больше. Число электронов,
располагающихся на внешнем электронном
слое, равно номеру группы.
Завершает период аргон. Заряд его ядра
+18. Это элемент VIII группы, поэтому на
внешнем электронном слое его атома
находится восемь электронов:
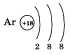 Далее можно сделать выводы и об изменении
свойств элементов в периоде.
Любой период (кроме первого) начинается
типичным металлом. В третьем периоде
это натрий Na. Далее следует магний Mg,
также обладающий ярко выраженными
металлическими свойствами. Следующий
элемент в периоде — алюминий А1. Это
ам-фотерный элемент, проявляющий
двойственные свойства (и металлов и
неметаллов). Остальные элементы в периоде
— неметаллы: кремний Si, фосфор Р, хлор
С1. И заканчивается период инертным
газом аргоном Аг.
Таким образом, в периоде происходит
постепенное ослабление металлических
свойств и возрастание свойств неметаллов.
Такое изменение свойств объясняется
увеличением числа электронов на внешнем
электронном слое: от 1 — 2, характерных
для металлов, и заканчивая 5 — 8 электронами,
соответствующими элементам-неметаллам.
Натрий, его положение
в периодической системе химических
элементов Д. И. Менделеева, строение
атома. Физические и химические свойства;
взаимодействие с неметаллами, водой.
Далее можно сделать выводы и об изменении
свойств элементов в периоде.
Любой период (кроме первого) начинается
типичным металлом. В третьем периоде
это натрий Na. Далее следует магний Mg,
также обладающий ярко выраженными
металлическими свойствами. Следующий
элемент в периоде — алюминий А1. Это
ам-фотерный элемент, проявляющий
двойственные свойства (и металлов и
неметаллов). Остальные элементы в периоде
— неметаллы: кремний Si, фосфор Р, хлор
С1. И заканчивается период инертным
газом аргоном Аг.
Таким образом, в периоде происходит
постепенное ослабление металлических
свойств и возрастание свойств неметаллов.
Такое изменение свойств объясняется
увеличением числа электронов на внешнем
электронном слое: от 1 — 2, характерных
для металлов, и заканчивая 5 — 8 электронами,
соответствующими элементам-неметаллам.
Натрий, его положение
в периодической системе химических
элементов Д. И. Менделеева, строение
атома. Физические и химические свойства;
взаимодействие с неметаллами, водой.
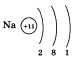
В
периодической таблице химических
элементов натрий Na расположен в третьем
периоде I группы главной подгруппы.
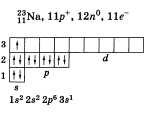
Рассказывая о строении атома натрия,
учащийся должен изобра-зить распределение
электронов по электронным слоям:
Однако по желанию учащийся может
расширить свой ответ информацией о
составе атома графической схемой и
электронной формулой:
 Натрий — металл. Основная степень
окисления +1. Натрий образует оксид Na2O
и гидроксид NaOH, которые проявляют
основные свойства.
При освещении вопроса о нахождении
натрия и его соединений в природе
необходимо отметить, что как простое
вещество натрий в природе не встречается
из-за высокой химической активности.
Получают натрий из расплава хлорида
или гидроксида натрия при прохождении
через него электрического тока.
Натрий — серебристо-белый металл, с
небольшой плотностью, легкоплавкий,
легко окисляется на воздухе.
При характеристике химических свойств
необходимо отметить, что натрий, как и
другие щелочные металлы, чрезвычайно
активный металл. Это происходит потому,
что он легко отдает единственный
электрон, находящийся на внешнем
электронном слое.
Далее можно рассмотреть его взаимодействие:
а) с простыми веществами; б) со сложными
веществами.
Натрий — металл. Основная степень
окисления +1. Натрий образует оксид Na2O
и гидроксид NaOH, которые проявляют
основные свойства.
При освещении вопроса о нахождении
натрия и его соединений в природе
необходимо отметить, что как простое
вещество натрий в природе не встречается
из-за высокой химической активности.
Получают натрий из расплава хлорида
или гидроксида натрия при прохождении
через него электрического тока.
Натрий — серебристо-белый металл, с
небольшой плотностью, легкоплавкий,
легко окисляется на воздухе.
При характеристике химических свойств
необходимо отметить, что натрий, как и
другие щелочные металлы, чрезвычайно
активный металл. Это происходит потому,
что он легко отдает единственный
электрон, находящийся на внешнем
электронном слое.
Далее можно рассмотреть его взаимодействие:
а) с простыми веществами; б) со сложными
веществами.
 При записи уравнений реакций со сложными
веществами необходимо помнить, что в
растворах кислот натрий сначала реагирует
с водой (см. реакцию выше), а потом уже
идет реакция между щелочью и
кислотой:
При записи уравнений реакций со сложными
веществами необходимо помнить, что в
растворах кислот натрий сначала реагирует
с водой (см. реакцию выше), а потом уже
идет реакция между щелочью и
кислотой:
![]() Закончить ответ можно рассказом о
применении натрия.
Применение натрия как металла связано
с его восстановительными свойствами;
он используется в качестве катализатора
в органической химии, газа-наполнителя
в светильниках, в виде сплава с калием
— как хладагент в ядерных
реакторах-размножителях на быстрых
нейтронах. Мировое ежегодное потребление
натрия и его соединений превосходит
100 млн т.
Наиболее важные соединения натрия,
применяемые в быту и на производстве,
— бикарбонат натрия NaHCO3, карбонат натрия
Na2CO3, гидроксид натрия NaOH, раствор силиката
натрия Na2SiO3 (жидкое стекло) — силикатный
клей.
Задача.
Какую массу оксида углерода (IV) необходимо
взять для получения 2 моль карбоната
кальция?
Закончить ответ можно рассказом о
применении натрия.
Применение натрия как металла связано
с его восстановительными свойствами;
он используется в качестве катализатора
в органической химии, газа-наполнителя
в светильниках, в виде сплава с калием
— как хладагент в ядерных
реакторах-размножителях на быстрых
нейтронах. Мировое ежегодное потребление
натрия и его соединений превосходит
100 млн т.
Наиболее важные соединения натрия,
применяемые в быту и на производстве,
— бикарбонат натрия NaHCO3, карбонат натрия
Na2CO3, гидроксид натрия NaOH, раствор силиката
натрия Na2SiO3 (жидкое стекло) — силикатный
клей.
Задача.
Какую массу оксида углерода (IV) необходимо
взять для получения 2 моль карбоната
кальция?