
- •Альтернативне джерело енергії
- •1 Огляд наукової літератури
- •1.1 Фізичні основи для створення теплового акумулятора
- •1.2 Рідинні теплові акумулятори
- •1.3 Акумулятори тепла, засновані на фазових переходах
- •Конструкція та фазового переходу
- •2 Експериментальна частина
- •2.1 Вивчення процесу гідратації глауберової солі
- •Висновки
- •Перелік посилань
2 Експериментальна частина
2.1 Вивчення процесу гідратації глауберової солі
![]()
∆Hутв.(Na2SO4*10H2O) = -4324 кДж/моль
∆Hутв.(Na2SO4) = -1387 кДж/моль
∆Hутв.(H2O) = -286 кДж/моль
∆Hр-ї = ∆Hутв.(Na2SO4*10H2O) – (∆Hутв.(Na2SO4) + 10*∆Hутв.(H2O))
∆Hр-ї = -4324 кДж/моль – ((-1387 кДж/моль) + 10*(-286 кДж/моль)) = -77 кДж/моль
Рекція плавлення кристалогідрату відбувається при 32˚C, розрахуємо для нього енергію Гібса(∆G):
∆G = ∆Hр-ї - T∆Sр-ї
∆Sутв.(Na2SO4*10H2O) = -4324 кДж/моль
∆Sутв.(Na2SO4) = -1387 кДж/моль
∆Sутв.(H2O) = -286 кДж/моль
∆Sр-ї = ∆Hутв.(Na2SO4*10H2O) – (∆Hутв.(Na2SO4) + 10*∆Hутв.(H2O))
∆Sр-ї = -4324 кДж/моль – ((-1387 кДж/моль) + 10*(-286 кДж/моль)) = -77 кДж/моль
∆G = (-77 кДж/моль) – 305 * () =
Глауберова сіль продається в збезводненому виді. Я взяв 2 літра гарячої води й почав розчиняти в ній сульфат натрію до стану насиченого розчину ( тобто доти, поки сіль не перестане розчинятися). В 2-х літрах розчинилося приблизно 600-650 мол солі. Щільність сульфату - приблизно 1,5 Кг/літр, тобто в літрі розчинилося приблизно 450-480 грам (що близько до довідкових показників - максимальна його розчинність у воді при 32,4° С, яка становить 49,8 г в 100 г води ( розраховуючи на безводну сіль). Після ретельного подвійного проціджування розчину через фільтрувальний папір, я приступив до досвідів.
Важливо було максимальне точно відтворити умови, у яких буде «працювати» розчин сульфату натрію в умовах теплового акумулятора. Як то: абсолютна нерухомість ( у підвалі каністри з розчином ніхто турбувати не буде); досить повільні процеси нагрівання й охолодження, тому охолодження здійснюється природно, а нагрівання - дуже малопотужною електричною грілкою, якої я обертав пляшку з розчином.
Контроль температури проводився за допомогою лабораторного ртутного термометра. Що б вимірювати температуру розчину, і при цьому не втручатися в розчин, довелося збоку пляшки прилаштувати спеціальну П-Образну «капсулу» з пінополістиролу, у яку вставлявся термометр так, що б своєю колбою із ртуттю стосуватися стінки пляшки. Для поліпшення теплопередачі від пляшки до термометра я туди наштовхав алюмінієвої фольги. Втім, важливо було відстежити динаміку температур у різних умовах, а не її абсолютні значення.
Проведення експериментів.
Нагрівання за допомогою електричної грілки розчин до 45 градусів (приблизно до такої температури я розраховую заряджати свій теплоаккумулятор в эко-будинку) я встановив її місце, де вона на зазнала вібраціям, додатковому нагріванню або охолодженню й досить прохолодне місце. Т.е. у льосі (фактично - підвал будинку й буде льохом, так що умови схожі). Температура навколишнього повітря +10 градусів.
Результати проведених випробувань ви бачите на графіку:
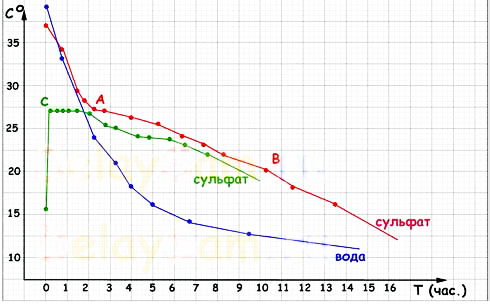
Синій графік – графік остигання води. Вода остигає по зворотній експоненті, прагнучи до температури навколишнього її повітря. І чим менше різниця температури між водою й повітрям, тем повільніше йде остигання.
Графік остигання розчину солі БЕЗ ініціалізації кристалізації зовсім повторює графік остигання води.
Червоний графік - графік остигання насиченого розчину із внесеним затравки. Справа в тому, що для того, що б почалася природня кристалізація в розчині, необхідна наявність якої-небудь неоднорідності. Звичайно нею слугує деяка кількість нерозчиненої солі на дні посудини. Т.е. розчин небагато пересичений. У міру остигання розчину, у крапці «А» почалася кристалізація солі в пляшці й процес остигання різко сповільнився. Тепло, що виділяється при кристалізації нагрівало сам розчин і компенсувало тепловтрати. Так тривало до крапки «В».
Слід ураховувати, що я фактично вимірював не температуру розчину, а температуру поверхні пляшки. Але саме це й важливо, оскільки повітря в теплоакккумуляторе буде контактувати не з розчином, а саме з поверхнею каністр, у яких буде перебуває теплоаккумулирующее речовина, вода або розчин сульфату натрію.
У крапці «В» кристали зайняли приблизно 4/5 об'єму пляшки й виділення тепла сповільнилося, хоча її верхня частина усе ще була на дотик відчутне тепліше тієї зони, у якій перебував термометр. Очевидно, що просто передача тепла усередині самої пляшки сповільнилася й термометр перестав фіксувати її.
Зелений графік - графік поведінки переохолодженого розчину. Розчин без затравки був просто охолоджений до +15, а на наступну добу в ньому була викликана кристалізація (фактично – дотиком до пляшки). Відразу почали рости кристали по всьому об'єму пляшки, а пляшка фактично миттєво розігрілася до 27 градусів (зовнішня температура поверхні). Після розігріву частина кристалів знову «розплавилася» і розчин перейшов у рівноважний стан. Т.е. кристалізувалася тільки та частина розчину, необхідна на підтримку температури рівноваги.
