
- •БиооргаНическая химия
- •Содержание
- •1. Строение и номенклатура органических соединений. Химическая связь. Электронные эффекты
- •1.1 Введение
- •1.2 Теории строения органических соединений
- •Основные положения теории строения органических соединений а.М. Бутлерова
- •Алкены Алкадиены Алкины
- •1.4 Номенклатура органических соединений
- •1.5 Изомерия органических соединений
- •1.6 Электронное строение атома углерода, гибридизация
- •1.7 Сопряженные системы
- •1.8 Электронные эффекты (индуктивный и мезомерный)
- •1.9 Кислотность и основность органических соединений
- •2. Общая характеристика реакций органических соединений.
- •2.1 Общая характеристика химических реакций
- •2.2 Радикальные реакции
- •2.3 Реакции электрофильного присоединения
- •2.5 Нуклеофильные реакции
- •2.6 Окислительно-восстановительные реакции (овр)
- •3. Поли- и гетерофункциональные соединения, участвующие в процессах жизнедеятельности
- •3.5. Классы гетерофункциональных соединений
- •3.6 Гетерофункциональные производные бензола как лекарственные средства
- •4. Биологически важные гетероциклические соединения
- •5. Аминокислоты, пептиды, белки
- •5.3 Пептиды.
- •5.5 Пространственное строение полипептидов и белков
- •6. Углеводы: моно, ди- и полисахариды
- •6.4 Олиго- и полисахариды
- •7. Нуклеотиды и нуклеиновые кислоты
- •7.1. Нуклеозиды.
- •7.2. Нуклеотиды.
- •8. Липиды и низкомолекулярные биорегуляторы
- •8. 1 Простые омыляемые липиды
- •8.2. Сложные омыляемые липиды
- •8.3 Неомыляемые липиды или низкомолекулярные биорегуляторы
- •9. Практикум лабораторный
- •9.1. Правила техники безопасности при работе в химической лаборатории
- •9.2. Общие закономерности реакционной способности органических соединений
- •3. Строение и свойства биополимеров
- •Литература
- •Биоорганическая химия Учебное пособие
1.7 Сопряженные системы
Различают два типа сопряженных систем (и сопряжений).
1 .
,
-Сопряжение
— электроны делокализованы между двумя
(и более) кратными связями. Например, в
делокализации электронов в молекуле
бензола участвуют 6 атомов углерода, у
бутадиена – четыре атома углерода:
СН2=СН–СН=СН2
СН2–СН–СН–СН2
.
,
-Сопряжение
— электроны делокализованы между двумя
(и более) кратными связями. Например, в
делокализации электронов в молекуле
бензола участвуют 6 атомов углерода, у
бутадиена – четыре атома углерода:
СН2=СН–СН=СН2
СН2–СН–СН–СН2
2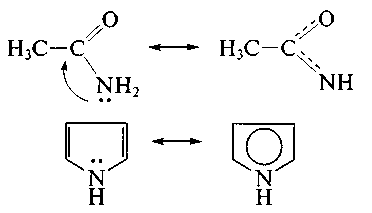 .
р, -Сопряжение
— в делокализации принимают участие
электроны -связи
и р-орбитали гетероатома; например, в
молекулах ацетамида и пиррола:
.
р, -Сопряжение
— в делокализации принимают участие
электроны -связи
и р-орбитали гетероатома; например, в
молекулах ацетамида и пиррола:
В случае молекулы ацетамида в делокализации участвуют три атома (С, О, N); в случае молекулы пиррола — пять атомов (4 атома С и атом N). Чем длиннее система сопряжения, тем более она устойчива. Ароматическая система представляет собой устойчивую плоскую циклическую сопряженную полиеновую структуру, содержащую (4п + 2) -электронов (п = 1, 2, 3, ...). Например, бензол — ароматическая структура (6 -электронов), а 1,3,5,7-циклооктатетраен — нет (8 -электронов). Делокализация электронов является одним из важных факторов повышения устойчивости молекул и ионов, поэтому это явление широко распространено в биологически важных молекулах (витамины, гем, хлорофилл, гемоглобин и др.).
Типы атомов углерода. Атомы, соединенные с одним углеродным атомом называются первичными, соответственно называются первичными и три атома водорода у первичного углеродного атома. Атом углерода, соединенный с двумя атомами углерода называется вторичным, и два атома водорода у него называются вторичными атомами водорода. Атом, соединенный с тремя другими атомами С, называется третичным, как и единственный атом водорода при нем; а атом углерода, связанный с четырьмя атомами С — четвертичным.
1.8 Электронные эффекты (индуктивный и мезомерный)
Поляризация молекулы обусловлена различным влиянием атомов, входящих в состав молекулы. Атомы с большой электроотрицательностью притягивают к себе электроны -связей. Такой вид поляризации (сдвиг электронной плотности -связи под действием разности в электроотрицательности связанных атомов) называется индуктивным эффектом (обозначается заглавной латинской буквой I и прямой стрелкой ()). Если в связи СХ электронная плотность сдвинута в сторону заместителя Х по сравнению со связью СН, то такое влияние заместителя называют отрицательным индуктивным эффектом (I). Если же смещение происходит в сторону атома С по сравнению со связью СН, то такое действие заместителя называют положительным индуктивным эффектом (+I). При передаче по цепи индуктивный эффект затухает.
 Н
Н
Н
Н

 Н
С+2
С+1
Сl +2
< +1
Н
С+2
С+1
Сl +2
< +1
Н Н
+I- Эффектом характеризуются алкильные радикалы, -I эффектом– атомы галогенов, функциональные группы, содержащие кислород, азот, серу, кратные связи, а также группы, несущие положительный заряд.
Если в молекуле имеются системы сопряженных простых и кратных связей или атомы с неподеленными электронными парами, включенными в систему сопряжения, они могут участвовать в образовании общего -электронного облака. Участие групп в сопряжении и влияние их на состояние -электронного облака молекулы называют мезомерным эффектом (сдвиг электронной плотности сопряжённых -связей) , или эффектом сопряжения (обычно обозначается заглавной буквой М; редко — заглавной буквой С). Для его обозначения используется изогнутая стрелка. У атомов азота, кислорода, фтора внешняя электронная оболочка заполнена, и они способны смещать p-электроны неподеленной электронной пары в сторону бензольного ядра или ненасыщенного углеродного атома (+М-эффект):

 СН3
О
СН = СН2
СН3
О
СН = СН2
Е сли
в систему сопряжения входит кратная
связь между разнородными атомами, то
общее -электронное
облако смещается в сторону более
электроотрицательного атома (–М-эффект):
сли
в систему сопряжения входит кратная
связь между разнородными атомами, то
общее -электронное
облако смещается в сторону более
электроотрицательного атома (–М-эффект):
O
СН2 = СНC+
Н
Положительный мезомерный эффект проявляют группы: –ОН; –OR; –NH2; NR2; –SH; галогены (смещение электронной плотности от гетероатома функциональной группы к -системе углеводородного радикала); отрицательный: группы NO2, CN, СООН, SО3Н (смещение электронной плотности от -системы углеводородного радикала к гетероатому функциональной группы). Наличие индуктивного и мезомерного эффектов приводит к перераспределению электронной плотности в молекуле. В результате на одних атомах концентрируется частичный отрицательный, а на других — частичный положительный заряды. В свою очередь, это перераспределение зарядов определяет реакционную способность соединений, их кислотно-основные свойства, дипольный момент молекул, силу межмолекулярных связей (а значит и такие свойства как темперутуры кипения и плавления, растворимость).
