
- •БиооргаНическая химия
- •Содержание
- •1. Строение и номенклатура органических соединений. Химическая связь. Электронные эффекты
- •1.1 Введение
- •1.2 Теории строения органических соединений
- •Основные положения теории строения органических соединений а.М. Бутлерова
- •Алкены Алкадиены Алкины
- •1.4 Номенклатура органических соединений
- •1.5 Изомерия органических соединений
- •1.6 Электронное строение атома углерода, гибридизация
- •1.7 Сопряженные системы
- •1.8 Электронные эффекты (индуктивный и мезомерный)
- •1.9 Кислотность и основность органических соединений
- •2. Общая характеристика реакций органических соединений.
- •2.1 Общая характеристика химических реакций
- •2.2 Радикальные реакции
- •2.3 Реакции электрофильного присоединения
- •2.5 Нуклеофильные реакции
- •2.6 Окислительно-восстановительные реакции (овр)
- •3. Поли- и гетерофункциональные соединения, участвующие в процессах жизнедеятельности
- •3.5. Классы гетерофункциональных соединений
- •3.6 Гетерофункциональные производные бензола как лекарственные средства
- •4. Биологически важные гетероциклические соединения
- •5. Аминокислоты, пептиды, белки
- •5.3 Пептиды.
- •5.5 Пространственное строение полипептидов и белков
- •6. Углеводы: моно, ди- и полисахариды
- •6.4 Олиго- и полисахариды
- •7. Нуклеотиды и нуклеиновые кислоты
- •7.1. Нуклеозиды.
- •7.2. Нуклеотиды.
- •8. Липиды и низкомолекулярные биорегуляторы
- •8. 1 Простые омыляемые липиды
- •8.2. Сложные омыляемые липиды
- •8.3 Неомыляемые липиды или низкомолекулярные биорегуляторы
- •9. Практикум лабораторный
- •9.1. Правила техники безопасности при работе в химической лаборатории
- •9.2. Общие закономерности реакционной способности органических соединений
- •3. Строение и свойства биополимеров
- •Литература
- •Биоорганическая химия Учебное пособие
2.2 Радикальные реакции
Хлор реагирует с предельными углеводородами только под влиянием света, нагревания или в присутствии катализаторов, причем последовательно замещаются хлором все атомы водорода:
СН4 + С12 СН3С1 + НС1
СН3С1 + С12 СН2С12 + НС1
СН2С12 + С12 CHC13 + HC1
СНС13 + С12 СС14 + НС1
Наиболее легко замещается водород у третичного атома углерода. Соотношение между скоростями замещения (при 300 °С) водородных атомов при первичном, вторичном и третичном атомах углерода 1 : 3,25 : 4,3.
Реакция протекает по цепному радикальному механизму.
С12 2С1. зарождение цепи
СН3 – Н + C1. CH3. + HC1 рост, развитие цепи
СН3. + С12 СН3С1 + C1. рост, развитие цепи
2С1. С12 обрыв цепи
СН3. + С1. СН3С1 обрыв цепи
СН3. + СН3. С2Н6 обрыв цепи
Фотохимическое бромирование обычно проходит строго избирательно (селективно) — легче всего замещаются атомы водорода у третичного атома углерода, скорость замещения у которого в 1600 раз выше, чем у первичного атома углерода.
Существуют три общих пути генерирования радикальных частиц: расщепление ковалентной связи за счет тепловой энергии (термолиз); расщепление связи при помощи лучистой энергии (фотолиз) и образование радикалов в окислительно-восстановительных процессах.
Радикальные реакции распространены в живых системах, так как молекулярный кислород является одним из самых распространенных радикалов и сам способен инициировать радикальные реакции. Когда молекулярный кислород принимает электрон, он превращается в анион-радикал О2–, называемый супероксидом (superoxide). Этот радикал способен участвовать как в полезных, так и в нежелательных физиологических процессах. Например, иммунная система живого организма использует супероксид в своей борьбе с патогенами — чужеродными болезнетворными телами. Супероксид может быть вовлечен в некоторые процессы, вызывающие окислительное повреждение здоровых клеток, что ведет к дегенерации и старению живого организма. Нормальное функционирование системы ферментов предотвращает эти нежелательные процессы.
В живых организмах ингибиторами (замедлителями) окислительных реакций могут выступать природные антиоксиданты — гидрокси- и полигидроксисоединения.
Например, -токоферол (витамин Е) действует как ловушка радикалов и ингибирует нежелательные радикальные процессы в организме, способные вызвать повреждение клеток. Витамин С также является антиоксидантом, эффективно работающим в живых системах.
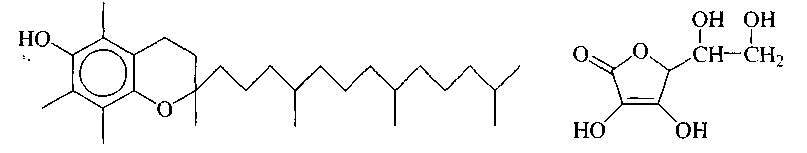
витамин Е (-токоферол) витамин С
2.3 Реакции электрофильного присоединения
Ненасыщенные углеводороды — алкены, циклоалкены, алкадиены и алкины — проявляют способность к реакциям присоединения, так как содержат двойные или тройные связи. Более важной in vivo является двойная связь.
За счет электронов -связи в молекулах алкенов имеется область повышенной электронной плотности. Поэтому они представляют собой нуклеофилы и, следовательно, склонны подвергаться атаке электрофильным реагентом.
Механизм реакции. Присоединение к алкенам галогеноводородов и родственных соединений протекает по гетеролитическому электрофильному механизму ае. Электрофильной частицей в данном процессе часто служит простейший электрофил — протон Н+. В реакции выделяют две основные стадии: 1) электрофильная атака протоном алкена с образованием карбокатиона — медленная стадия, определяющая скорость процесса в целом; 2) атака образовавшегося карбокатиона нуклеофилом Х—, приводящая к конечному продукту (быстрая стадия).
Присоединение галогеноводородов и воды (гидратация) происходит по правилу Марковникова: атомы водорода присоединяются преимущественно к наиболее гидрогенизированному атому углерода (наиболее богатому водородом), а атом галогена или гидроксигруппа присоединяются к наименее гидрогенизированному.
Н3С–СН = СН2 + НCl Н3С–СНCl–СН3
Образуется преимущественно 2-хлорпропан, а не 1-хлорпропан.
Но такая формулировка правила Марковникова не объясняет направление реакций гипогалогенирования и реакций присоединения к алкенам, в состав которых входят группы, обладающие отрицательным мезомерным или индуктивным эффектами.
Существует и другая более общая формулировка правила Марковникова: присоединение несимметричного реагента к несимметричному алкену по ионному механизму протекает в направлении образования более устойчивого катиона. Так, в результате присоединения катиона водорода к двойной связи пропена могут возникнуть два карбокатиона:
СН3СН2+СН2 (I) и СН3+СНСН3 (II)
Ни в том, ни в другом катионе положительный заряд на выделенном атоме углерода не равен, а меньше +1 из-за смещения к нему электронной плотности от соседних атомов. Но в первичном катионе (I) донором этой плотности является один, а во вторичном (II) — два соседних атома углерода. Кроме того, в первичном катионе (I) метильная группа находится дальше, ее индуктивный эффект по цепи затухает. Это значит, что распределение заряда во вторичном карбокатионе (II) более равномерное; такая частица оказывается более устойчивой, реакция идет по пути, направляемому ее образованием.
Присоединение против правила Марковникова идет в том случае, если реакцию проводят в присутствии перекисей. Тогда реакция протекает по другому механизму (свободнорадикальное присоединение):
Н 3С–СН=СН2
+ НBr
ROOR
Н3С–СН2–СН2Br
3С–СН=СН2
+ НBr
ROOR
Н3С–СН2–СН2Br
2.4 Реакции электрофильного замещения. Для ароматических соединений бензольного ряда, конденсированных и гетероциклических ароматических соединений характерны реакции, не приводящие к нарушению ароматической системы, т. е. реакции замещения. Они не склонны вступать в реакции присоединения или окисления, ведущие к нарушению ароматичности.
Для соединений ароматического характера, имеющих замкнутую - электронную систему, наиболее характерны реакции электрофильного замещения, позволяющие охранить ароматическую ситему.
Доказано, что большинство реакций электрофильного замещения в ароматическом ряду протекает по двухстадийному механизму. На первой, медленной, стадии происходит взаимодействие электрофила с -электронами ароматической системы (образование -комплекса) и последующее нарушение ароматической системы и переход атакуемого атома углерода ядра в состояние sp3-гибридизации (образование -комплекса). Вторая, быстрая, стадия сопровождается восстановлением ароматической структуры и вследствие выигрыша энергии протекает легко и быстро.

Рисунок 4 – Механизм реакции электрофильного замещения SEAr
-Комплексы представляют собой координационные соединения, в которых донором являются ароматические соединения, имеющие легко поляризуемые -электроны, а акцепторами — электрофильные частицы.
-Комплексы не являются истинными химическими соединениями. В отличие от -комплексов, -комплексы представляют собой истинно химические соединения, в которых электрофил Е+ образует ковалентную связь за счет двух -электронов одной из связей бензольного кольца. В -комплексе один из атомов углерода бензольного кольца переходит в состояние sp 3-гибридизации, в котором все четыре связи направлены под углом 109°. При этом нарушается симметрия бензольного кольца, а группа Е+ и атом водорода оказываются в положении, перпендикулярном плоскости кольца.
Реакции электрофильного замещения завершаются отщеплением от -комплекса протона и восстановлением ароматической системы. Как правило, этот процесс происходит при участии обладающего основными свойствами аниона А–, присутствующего в реакционной среде, и сопровождается выделением энергии.
К реакциям электрофильного замещения относятся реакции:

Заместители в кольце делят на ориентанты I рода и II рода. Ориентанты I рода: алкильные радикалы, группы –ОН, –OR, –NH2, –NHR, –NR2, –SH, атомы галогенов направляют второй заместитель в орто- и пара-положения. Все заместители I рода, кроме галогенов, обладают электронодонорными свойствами по отношению к бензольному кольцу и ускоряют реакции электрофильного замещения по сравнению с незамещённым бензолом.
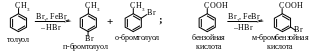
Ориентанты II рода: карбонильные и сложноэфирные группы, группы –СООН, –SO3H, –NO2, –CN направляют второй заместитель в мета- положение. Все заместители II рода обладают электроноакцепторными свойствами по отношению к бензольному кольцу и замедляют реакции электрофильного замещения по сравнению с незамещённым бензолом.
