
- •БиооргаНическая химия
- •Содержание
- •1. Строение и номенклатура органических соединений. Химическая связь. Электронные эффекты
- •1.1 Введение
- •1.2 Теории строения органических соединений
- •Основные положения теории строения органических соединений а.М. Бутлерова
- •Алкены Алкадиены Алкины
- •1.4 Номенклатура органических соединений
- •1.5 Изомерия органических соединений
- •1.6 Электронное строение атома углерода, гибридизация
- •1.7 Сопряженные системы
- •1.8 Электронные эффекты (индуктивный и мезомерный)
- •1.9 Кислотность и основность органических соединений
- •2. Общая характеристика реакций органических соединений.
- •2.1 Общая характеристика химических реакций
- •2.2 Радикальные реакции
- •2.3 Реакции электрофильного присоединения
- •2.5 Нуклеофильные реакции
- •2.6 Окислительно-восстановительные реакции (овр)
- •3. Поли- и гетерофункциональные соединения, участвующие в процессах жизнедеятельности
- •3.5. Классы гетерофункциональных соединений
- •3.6 Гетерофункциональные производные бензола как лекарственные средства
- •4. Биологически важные гетероциклические соединения
- •5. Аминокислоты, пептиды, белки
- •5.3 Пептиды.
- •5.5 Пространственное строение полипептидов и белков
- •6. Углеводы: моно, ди- и полисахариды
- •6.4 Олиго- и полисахариды
- •7. Нуклеотиды и нуклеиновые кислоты
- •7.1. Нуклеозиды.
- •7.2. Нуклеотиды.
- •8. Липиды и низкомолекулярные биорегуляторы
- •8. 1 Простые омыляемые липиды
- •8.2. Сложные омыляемые липиды
- •8.3 Неомыляемые липиды или низкомолекулярные биорегуляторы
- •9. Практикум лабораторный
- •9.1. Правила техники безопасности при работе в химической лаборатории
- •9.2. Общие закономерности реакционной способности органических соединений
- •3. Строение и свойства биополимеров
- •Литература
- •Биоорганическая химия Учебное пособие
1.5 Изомерия органических соединений
Если два или больше индивидуальных веществ имеют одинаковый количественный состав (молекулярную формулу), но отличаются друг от друга последовательностью связывания атомов или расположением их в пространстве, то в общем случае они называются изомерами. Раз строение этих соединений разное, то и химические или физические свойства изомеров отличаются (за исключением энантиомеров).
Типы изомерии: структурная (изомеры строения) и стереоизомерия (пространственная).
Структурная изомерия может быть трёх видов:
– изомерия углеродного скелета (изомеры строения углеродной цепи): например, бутан и 2-метилпропан;
– изомеры положения функциональных групп (или кратных связей):
например, 1-бутанол и 2-бутанол или 1-бутен и 2-бутен;
– изомеры функциональной группы (межклассовая):
например, 1-бутанол и диэтиловый эфир или пропанон и пропаналь.
Стереоизомерия подразделяется на конформационную и конфигурационную.
Конформации молекулы представляют собой различные её геометрические формы, возникающие в результате вращения частей молекулы вокруг простых -связей.
Конфигурация – это порядок расположения атомов в пространстве без учёта различий, возникающих из-за вращения вокруг простых -связей.
Конформации органических молекул
Поворот вокруг -связи углерод — углерод совершается сравнительно легко, углеводородная цепь может принимать разные формы. Конформационные формы легко переходят друг в друга и поэтому не являются различными соединениями — это разные неустойчивые динамические формы одной и той же молекулы. Разность энергий между конформерами имеет тот же порядок, что и энергия теплового движения (несколько кДж/моль). Поэтому при обычных температурах нельзя выделить отдельные конформеры, в результате теплового движения молекулы испытывают непрерывные конформационные превращения.
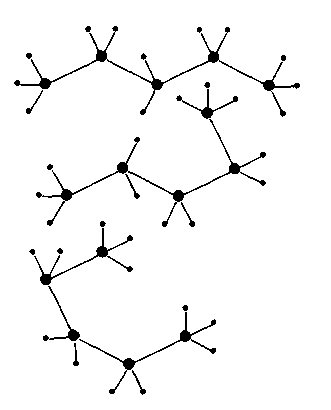
а) б) в)
Рисунок 2 — Конформеры пентана: а) возможное расположение в пространстве; б) заслонённая конформация, в) заторможенная конформация.
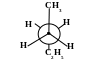
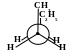
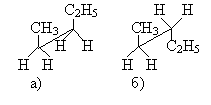
а) б)
Рисунок 3 — Проекционные формулы Ньюмена: а) заслонённая конформация, б) заторможенная конформация.
Заслоненная и заторможенная конфигурации отличаются взаимным расположением заместителей у атомов углерода, вращающихся друг относительно друга. Молекулы алканов и других соединений, имеющих алкановые фрагменты, представляют собой смеси конформеров.
Для изображения конформаций используют проекционные формулы Ньюмена, получающиеся при проецировании на плоскость молекулы С–С- связи. В качестве примера на рисунке 3 показаны конформации пентана относительно связи С2–С3. Ближайший к наблюдателю атом углерода (С2) обозначают точкой в центре круга; круг при этом символизирует удаленный атом углерода (С3). Три связи от атома изображают в виде линий, расходящихся из центра круга — для ближнего атома (С2) или «высовывающихся» из-за круга — для удаленного атома (С3).Если атомы и группы, связанные с рассматриваемыми атомами углерода как бы заслоняют друг друга, конформация так и называется заслонённой (рис. 3а), при повороте одного из атомов относительно другого на 60 получаем энергетически более выгодную заторможенную конформацию (рис. 3б). В заторможенной конформации дальше расстояние между заместителями, вследствие чего не так сильны силы оттатлкивания в этой конформации по сравнению с заслонённой.
Конфигурационные изомеры
Это стереоизомеры с различным расположением вокруг определенных атомов других атомов, радикалов ;или функциональных групп в пространстве относительно друг друга.
Различают понятия диастереомерии и энантиомерии.
Диастереомерами называются оптически активные изомеры — соединения, способные изменять плоскость поляризации плоскополяризованного света. Свет представляет собой электромагнитные волны, в которых частицы колеблются во всех направлениях во взаимноперпендикулярных плоскостях и перпендикулярно направлению распространения волны. В плоскополяризо-ванном свете колебания частиц лежат в одной и той же плоскости. Если луч проходит через прозрачное вещество, которое способно повернуть плоскость колебаний электрического поля на некоторый угол и придать им новое направление, то говорят, что вещество обладает оптической активностью.
Можно сформулировать 2 признака химической активности органических соединений: наличие асимметрического атома углерода и отсутствие в молекуле элементов симметрии.
Асимметрический атом углерода — атом, связанный с четырьмя различными атомами или группами.
Для различных молекул могут быть характерны оси или плоскости симметрии. Так, в молекуле трихлорметана (хлороформа) плоскость симметрии проходит через фрагмент Н–С–С1. Существуют, однако, молекулы, не обладающие плоскостью симметрии, которые оказываются несовместимыми со своим зеркальным изображением. Это свойство называется хиральностью, а сами молекулы – хиральными.
Термин «хиральность» означает, что два предмета находятся в таком отношении друг к другу, как левая и правая руки (от греч. cheir — рука), т.е. представляют собой зеркальные изображения, не совпадающие при попытке совместить их в пространстве. В нашем окружении часто встречаются хиральные объекты: пара ботинок, пара перчаток и др. Наглядным примером несовместимости предмета и его зеркального изображения служит невозможность надеть на левую руку правую перчатку, соответствующую пространственному расположению правой руки. Хиральность в первую очередь понятие геометрическое, а не химическое.
Оптически активные изомеры, являющиеся зеркальными отражениями друг друга, называются энантиомерами. Энантиомеры обладают одинаковыми физическими и химическими свойствами, вращают плоскость поляризации плоскополяризованного света на один и тот же угол, но в противоположные стороны. Смесь равных мольных количеств энантиомеров, называется рацемической смесью (рацематом). Рацемат оптически не активен.
Называют энантиомеры по R,S или D,L – номенклатурам. R,S- номенклатура описывает абсолютную конфигурацию изомеров, D,L номенклатура – относительную (относительно конфигурации глицеринового альдегида).
Диастереомеры
В отличие от энантиомеров, диастереомеры обладают заметным различием в физических и химических свойствах. Понятие диастереомерии охватывает широкий круг стереоизомеров. Среди них следует выделить две группы: -диастереомеры и -диастереомеры.
 -Диастереомеры
содержат
в молекуле более одного центра хиральности,
в
них
заместители связаны с центром хиральности
-связями.
Такие диастереомеры называют
-диастереомерами.
Например, D-рибоза,
D-арабиноза,
D-ксилоза
и D-ликсоза
– это -диастереомеры,
а D-ликсоза
и L-ликсоза
– энантиомеры.
-Диастереомеры
содержат
в молекуле более одного центра хиральности,
в
них
заместители связаны с центром хиральности
-связями.
Такие диастереомеры называют
-диастереомерами.
Например, D-рибоза,
D-арабиноза,
D-ксилоза
и D-ликсоза
– это -диастереомеры,
а D-ликсоза
и L-ликсоза
– энантиомеры.
-Диастереомеры (геометрические или цис- транс- изомеры)
К ним относят конфигурационные изомеры, содержащие -связь. Этот вид диастереомерии характерен, в частности, для алкенов. Относительно плоскости -связи одинаковые заместители у двух атомов углерода могут располагаться по одну (цис-) или по разные (транс-) стороны. Основная причина существования цис- и транс-изомеров заключается в невозможности вращения вокруг -связи без ее нарушения.
Цис- и транс-изомеры имеют одинаковую последовательность связывания атомов, но отличаются друг от друга пространственным расположением заместителей и потому являются стереоизомерами. С другой стороны, их молекулы ахиральны (в них нет хиральных центров). Таким образом, цис- и транс-изомеры алкенов относительно друг друга являются диастереомерами и обладают разными свойствами.
Н СООН
Н Н
СООН
Н Н
С = С С = С
Н СООН
Транс-изомер и цис-изомер коричной кислоты
-Диастереомеры встречаются среди природных соединений, в частности, для обеспечения остроты зрения особенно важен изомер ретинола (витамин А), в котором все 4 двойные связи находятся в транс- конфигурации.
