
- •БиооргаНическая химия
- •Содержание
- •1. Строение и номенклатура органических соединений. Химическая связь. Электронные эффекты
- •1.1 Введение
- •1.2 Теории строения органических соединений
- •Основные положения теории строения органических соединений а.М. Бутлерова
- •Алкены Алкадиены Алкины
- •1.4 Номенклатура органических соединений
- •1.5 Изомерия органических соединений
- •1.6 Электронное строение атома углерода, гибридизация
- •1.7 Сопряженные системы
- •1.8 Электронные эффекты (индуктивный и мезомерный)
- •1.9 Кислотность и основность органических соединений
- •2. Общая характеристика реакций органических соединений.
- •2.1 Общая характеристика химических реакций
- •2.2 Радикальные реакции
- •2.3 Реакции электрофильного присоединения
- •2.5 Нуклеофильные реакции
- •2.6 Окислительно-восстановительные реакции (овр)
- •3. Поли- и гетерофункциональные соединения, участвующие в процессах жизнедеятельности
- •3.5. Классы гетерофункциональных соединений
- •3.6 Гетерофункциональные производные бензола как лекарственные средства
- •4. Биологически важные гетероциклические соединения
- •5. Аминокислоты, пептиды, белки
- •5.3 Пептиды.
- •5.5 Пространственное строение полипептидов и белков
- •6. Углеводы: моно, ди- и полисахариды
- •6.4 Олиго- и полисахариды
- •7. Нуклеотиды и нуклеиновые кислоты
- •7.1. Нуклеозиды.
- •7.2. Нуклеотиды.
- •8. Липиды и низкомолекулярные биорегуляторы
- •8. 1 Простые омыляемые липиды
- •8.2. Сложные омыляемые липиды
- •8.3 Неомыляемые липиды или низкомолекулярные биорегуляторы
- •9. Практикум лабораторный
- •9.1. Правила техники безопасности при работе в химической лаборатории
- •9.2. Общие закономерности реакционной способности органических соединений
- •3. Строение и свойства биополимеров
- •Литература
- •Биоорганическая химия Учебное пособие
4. Биологически важные гетероциклические соединения
Гетероциклические соединения (гетероциклы) — соединения, включающие в цикл один или несколько атомов, отличных от углерода (гетероатомов). Гетероциклические системы лежат в основе структуры соединений различных классов биологически активных веществ, таких как ДНК, РНК, многих лекарственных препаратов, а также алкалоидов. Последние представляют собой азотсодержащие гетероциклы растительного происхождения, обладающие выраженным физиологическим действием. К ним относятся различные наркотические средства, никотин, кофеин, морфин, атропин и др.
Наибольшее значение для организма имеют ароматические азотсодержащие гетероциклы — сопряженные системы, содержащие атом (атомы) азота и удовлетворяющие критерию ароматичности. Ароматические гетероциклы можно подразделить на две группы.
1

 .
-Избыточные
системы — молекулы с повышенной
электронной плотностью внутри цикла.
Это происходит, когда пара р-электронов
атома азота вступает в сопряжение с
-электронами
атомов углерода (р,-
сопряжение). В этом случае гетероатом
является электронодонором, а повышение
электронной плотности внутри цикла
облегчает протекание реакций по механизму
SЕ
(в -положение
к гетероатому); соединения легко
окисляются. Примером -избыточной
гетероциклической системы является
пиррол:
.
-Избыточные
системы — молекулы с повышенной
электронной плотностью внутри цикла.
Это происходит, когда пара р-электронов
атома азота вступает в сопряжение с
-электронами
атомов углерода (р,-
сопряжение). В этом случае гетероатом
является электронодонором, а повышение
электронной плотности внутри цикла
облегчает протекание реакций по механизму
SЕ
(в -положение
к гетероатому); соединения легко
окисляются. Примером -избыточной
гетероциклической системы является
пиррол:
пиррол индол (бензопиррол) пиридини
Электронодонорный атом азота, называемый пиррольным, является NH-кислотным центром. Кислотные свойства выражены очень слабо; например, пиррол взаимодействует со щелочными металлами и их амидами. Восстанавливается пиррол с трудом в жестких условиях, образуя гетероцикл пирролидин, обладающим сильноосновными свойствами. Пиррольное ядро входит в состав порфина, порфирина (тетрапиррольные соединения), природной аминокислоты триптофана, в состав индола (бензопиррола).
2. -Дефицитные системы — гетероциклы с пониженной электронной плотностью внутри цикла. В этом случае в сопряжении с -электронами атомов углерода участвует только один -электрон атома азота, а электронодефицитное состояние обусловлено большей по сравнению с атомом углерода электроотрицательностью атома азота. В этом случае гетероатом является акцептором протона за счет пары электронов, не участвующей в сопряжении, и проявляет основные свойства (пиридиновый атом азота). Электронодефицитное состояние ароматической системы приводит к затруднению реакции SЕ (в -положении к гетероатому). Простейшим примером такой гетероциклической системы является пиридин.
С оединения,
содержащие пиридиновый цикл, с трудом
окисляются, но легче восстанавливаются
(гидрируются). Например, в хинолине
(бензопиридине), окислению легче
подвергается бензольное кольцо, а
восстановлению — пиридиновое.
оединения,
содержащие пиридиновый цикл, с трудом
окисляются, но легче восстанавливаются
(гидрируются). Например, в хинолине
(бензопиридине), окислению легче
подвергается бензольное кольцо, а
восстановлению — пиридиновое.
хинолин 2,3-пиридиндикарбоноваякислота хинолин тетрагидрохинолин
О днако
гомологи пиридина легко окисляются
даже в мягких условиях. Так, при окислении
-пиколина
(2-метилпиридина) образуется никотиновая
кислота (витамин РР):
днако
гомологи пиридина легко окисляются
даже в мягких условиях. Так, при окислении
-пиколина
(2-метилпиридина) образуется никотиновая
кислота (витамин РР):
пиколин никотиновая кислота
Сочетание в молекуле двух пиридиновых атомов азота приводит к увеличению дефицита электронов внутри цикла и еще большему по сравнению пиридином понижению активности (инертности) соединений в реакциях SЕ а также уменьшению их основности по сравнению с пиридином. Так, шестичленный гетероцикл с двумя пиридиновыми атомами азота — пиримидин — в реакции с серной кислотой образует соли только по одному атому азота:

пиримидин гидросульфат пипиридина
Для многих гетероциклов с двумя атомами азота, а также для некоторых других гетерофункциональных соединений характерно явление таутомерии.
Таутомерия — это равновесная динамическая изомерия, сопровождающаяся миграцией (переносом) подвижной группы между двумя или несколькими реакционными центрами в молекуле. Если осуществляется перенос протона Н+, то таутомерия называется прототропная.
Таким образом, в основе явления таутомерии лежит кислотно-основное взаимодействие. Разновидноси прототропной таутомерии:
– лактим–лактамная (перенос Н+ между атомами азота и кислорода);
– енамин–иминная (перенос протона между атомами азота и углерода);
– кето–енольная (перенос Н+ между атомами кислорода и углерода).
П ервые
два вида таутомерии удобно рассмотреть
на примере производных пиримидина
(соединений, входящих в состав нуклеиновых
кислот), например цитозина (прямые
стрелки указывают направление смещения
таутомерного равновесия; изогнутые —
направление миграции протона):
ервые
два вида таутомерии удобно рассмотреть
на примере производных пиримидина
(соединений, входящих в состав нуклеиновых
кислот), например цитозина (прямые
стрелки указывают направление смещения
таутомерного равновесия; изогнутые —
направление миграции протона):
К ето-енольная
таутомерия пировиноградной кислоты
описывается равновесием:
ето-енольная
таутомерия пировиноградной кислоты
описывается равновесием:
В большинстве случаев кетонный таутомер оказывается гораздо более устойчивым. Присутствие енольного таутомера, однако, можно подтвердить образованием (при взаимодействии с фосфорной кислотой) фосфоенолпирувата — важнейшего метаболита в процессе гликолиза:

Производные пиримидина входят в состав ряда алкалоидов и сульфаниламидов.
Присутствие гидроксильных групп придает соответствующим производным пиримидина кислые свойства. Особенно сильные кислотные свойства проявляет 2,4,6-тригидроксипиримидин — барбитуровая кислота — более сильная, чем уксусная.
Б арбитуровая
кислота может быть получена при
взаимодействии малонового эфира с
мочевиной в присутствии этоксида натрия.
арбитуровая
кислота может быть получена при
взаимодействии малонового эфира с
мочевиной в присутствии этоксида натрия.
Б ольшую
роль в качестве снотворных и
противосудорожных средств играют 5,5-
дизамещенные производные барбитуровой
кислоты, так называемые барбитураты.
Их получают аналогично барбитуровой
кислоте, используя дизамещенные эфиры
малоновой кислоты. Для барбитуратов
возможна только лактим-лактамная
таутомерия. Они легко образуют
водорастворимые соли с одним эквивалентом
щелочи.
ольшую
роль в качестве снотворных и
противосудорожных средств играют 5,5-
дизамещенные производные барбитуровой
кислоты, так называемые барбитураты.
Их получают аналогично барбитуровой
кислоте, используя дизамещенные эфиры
малоновой кислоты. Для барбитуратов
возможна только лактим-лактамная
таутомерия. Они легко образуют
водорастворимые соли с одним эквивалентом
щелочи.
П римерами
барбитуратов служат 5,5-диэтилбарбитуровая
кислота, барбитал (веронал) R
= R
= C2H5,
ее натриевая соль, барбитал-натрий,
5-этил-5-фенилбарбитуровая кислота,
фенобарбитал (люминал) R=C2H5,
R
=
C6H5.
римерами
барбитуратов служат 5,5-диэтилбарбитуровая
кислота, барбитал (веронал) R
= R
= C2H5,
ее натриевая соль, барбитал-натрий,
5-этил-5-фенилбарбитуровая кислота,
фенобарбитал (люминал) R=C2H5,
R
=
C6H5.
Из бициклических гетероциклов наиболее распространены в природе соединения пуринового и птеридинового рядов.
П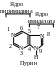 урин
— бициклическое гетероциклическое
соединение, образованное конденсированными
ядрами пиримидина и имидазола
урин
— бициклическое гетероциклическое
соединение, образованное конденсированными
ядрами пиримидина и имидазола

Пуриновая система ароматична. Она включает 8 -электронов двойных связей и неподеленную пару электронов атома азота в положении 9, что соответствует правилу Хюккеля (4п + 2, где п = 2). Пурин устойчив к действию окислителей, хорошо растворим в воде, амфотерен, образует соли не только с сильными кислотами, но (благодаря наличию NH-группы) и со щелочными металлами.
6-Гидроксипурин (гипоксантин), 2,6-дигидроксипурин (ксантин) и 2,6,8- тригидроксипурин (мочевая кислота) образуются в организме при метаболизме нуклеиновых кислот.
Мочевая кислота — конечный продукт метаболизма пуриновых соединений в организме. Она выделяется с мочой в количестве 0,5…1 г в сутки. Мочевая кислота двухосновна, плохо растворима в воде, но легко растворяется в щелочах, образуя соли (ураты)с одним или двумя эквивалентами щелочи. При некоторых нарушениях в организме ураты откладываются в суставах (подагра), а также в виде почечных камней. В результате нагревания мочевой кислоты с азотной кислотой с последующим добавлением аммиака к охлажденной реакционной смеси появляется интенсивное фиолетовое окрашивание. Оно используется для качественного обнаружения соединений, содержащих пуриновое ядро (мурексидная реакция).
По химическому поведению ксантин и гипоксантин в значительной степени аналогичны мочевой кислоте. Они амфотерны и образуют соли с кислотами и щелочами. N-метилзамещенные производные ксантина относятся к алкалоидам.
Аминопурины. Наиболее важны 6-аминопурин, или аденин и 1-амино-6-гидроксипурин, или гуанин, являющиеся обязательными компонентами нуклеиновых кислот. Аденин входит в состав некоторых коферментов.
При действии азотистой кислоты на аденин и гуанин происходит их дезаминирование с образованием гипоксантина и ксантина соответственно


Птеридиновая система ароматична, устойчива к действию окислителей, проявляет основные свойства. В природе довольно широко распространены гидрокси- и аминоптеридины. В частности, остаток 2-амино-6-метил-4-оксо-птеридина входит в состав фолиевой кислоты, а фрагмент 2,4- диоксоптеридина присутствует в важнейшем витамине рибофлавине — факторе роста живых организмов (витамин В2).
Типовые задачи и их решение
Задача ХVII. На первой стадии синтеза противомикробных средств фуранового ряда проводится реакция нитрования фурфурола. Почему фурфурол в отличие от фурана можно нитровать азотной кислотой?
Решение. Фурфурол представляет собой пятичленный кислородсодержащий ароматический электроноизбыточный гетероцикл, обладающий ацидофобными свойствами (не выдерживает присутствия кислот), поэтому его нитрование возможно, например, ацетилнитратом в пиридине. Электроноакцепторная альдегидная группа в фурфуроле понижает электронную плотность в ядре фурана, что приводит к его заметной стабилизации. По химическим свойствам он близок к бензальдегиду и легко вступает в реакции электрофильного замещения, в том числе нитруется азотной кислотой в присутствии уксусного ангидрида.

фурфурол 5-нитрофурфурол
Задачи для самостоятельного решения:
4.1. Витамин РР (амид никотиновой кислоты) предупреждает развитие пеллагры. Получите никотинамид из никотиновой кислоты и из хлорангидрида никотиновой кислоты.
4.2. Индол (бензпиррол) является структурным фрагментом многих алкалоидов, используемых в медицинской практике (резерпин, стрихнин и др.). Какой из двух циклов в молекуле индола предпочтительно участвует в реакциях электрофильного замещения? Напишите схему реакции сульфирования.
4.3. Спазмолитическое средство дибазол является гидрохлоридом 2-бензимидазола. Какой из двух атомов азота имидазольного ядра участвует в реакции образования этой соли?
4.4. Натриевая соль барбитала (барбитал-натрий) применяется как снотворное и успокаивающее средство. Какой центр кислотности в молекуле барбитала участвует в образовании соли? Какой тип таутомерии возможен для барбитуратов?
4.5. В чае содержится 1,3,7,9-тетраметилмочевая кислота. Напишите структурную формулу этого соединения. Способно ли оно к таутомерным превращениям? Почему?
4.6. Воспалительные процессы при подагре вызываются осаждением в суставах мононатриевой соли мочевой кислоты. В какой таутомерной форме мочевая кислота участвует в образовании натриевой соли?
