
- •БиооргаНическая химия
- •Содержание
- •1. Строение и номенклатура органических соединений. Химическая связь. Электронные эффекты
- •1.1 Введение
- •1.2 Теории строения органических соединений
- •Основные положения теории строения органических соединений а.М. Бутлерова
- •Алкены Алкадиены Алкины
- •1.4 Номенклатура органических соединений
- •1.5 Изомерия органических соединений
- •1.6 Электронное строение атома углерода, гибридизация
- •1.7 Сопряженные системы
- •1.8 Электронные эффекты (индуктивный и мезомерный)
- •1.9 Кислотность и основность органических соединений
- •2. Общая характеристика реакций органических соединений.
- •2.1 Общая характеристика химических реакций
- •2.2 Радикальные реакции
- •2.3 Реакции электрофильного присоединения
- •2.5 Нуклеофильные реакции
- •2.6 Окислительно-восстановительные реакции (овр)
- •3. Поли- и гетерофункциональные соединения, участвующие в процессах жизнедеятельности
- •3.5. Классы гетерофункциональных соединений
- •3.6 Гетерофункциональные производные бензола как лекарственные средства
- •4. Биологически важные гетероциклические соединения
- •5. Аминокислоты, пептиды, белки
- •5.3 Пептиды.
- •5.5 Пространственное строение полипептидов и белков
- •6. Углеводы: моно, ди- и полисахариды
- •6.4 Олиго- и полисахариды
- •7. Нуклеотиды и нуклеиновые кислоты
- •7.1. Нуклеозиды.
- •7.2. Нуклеотиды.
- •8. Липиды и низкомолекулярные биорегуляторы
- •8. 1 Простые омыляемые липиды
- •8.2. Сложные омыляемые липиды
- •8.3 Неомыляемые липиды или низкомолекулярные биорегуляторы
- •9. Практикум лабораторный
- •9.1. Правила техники безопасности при работе в химической лаборатории
- •9.2. Общие закономерности реакционной способности органических соединений
- •3. Строение и свойства биополимеров
- •Литература
- •Биоорганическая химия Учебное пособие
3. Поли- и гетерофункциональные соединения, участвующие в процессах жизнедеятельности
Подавляющее большинство органических веществ, участвующих в процессах метаболизма, представляют собой соединения с двумя и более функциональными группами. Их классифицировать следующим образом:
1) полифункциональные, содержащие одинаковые функциональные группы, например: этиленгликоль СН2ОН – СН2ОН, щавелевая кислота
НООС–СООН;
2) гетерофункциональные, содержащие различные функциональные группы, например: коламин СН2ОН–CH2NH2, пировиноградная кислота
СН3–СО –СООН;
3) гетерополифункциональные, например: моносахариды или яблочная кислота: НООС–СН(ОН) –СН2-СООН.
Наличие нескольких функциональных групп в молекуле оказывает значительное влияние на химические свойства соединения, приводя, с одной стороны, к усилению или ослаблениию реакционной способности соединений, а с другой — к появлению нехарактерных для монофункциональных соединений специфических свойств. Последние являются наиболее важными для обеспечения биологических функций, выполняемых этими веществами в организме.
3.1 Кислотно-основные свойства. Выполняется общая закономерность: наличие в молекуле групп ОН, SH, СООН приводит к усилению ее кислотных свойств, а аминогрупп NH2, NH — к усилению основных свойств. Кроме того, наличие дополнительной электроноакцепторной группы вблизи кислотного центра влечет за собой повышение кислотности соединения. Так, этиленгликоль СН2ОН–СН2ОН проявляет более сильные кислотные свойства по сравнению с этанолом СН3–СН2ОН; щавелевая кислота НООС–СООН является более сильной кислотой, чем уксусная СН3–СООН, а молочная кислота СН3–СН(ОН) –СООН – более сильной, чем пропановая СН3–СН2–СООН.
Во всех перечисленных случаях отрицательный индуктивный эффект заместителей (-I-эффект) вблизи групп ОН и СООН обусловливает значительную поляризацию связи О–Н и легкость отщепления протона, т.е. усиление кислотных свойств.
Наконец, наличие в молекуле различных по кислотно-основным свойствам функциональных групп обусловливает амфотерные свойства соединений. Предельным случаем является полный перенос протона от кислотного центра к основному, например в -аминокислотах, которые в кристаллическом состоянии, а так же в нейтральном водном растворе существуют в форме цвиттер-иона (биполярного иона, внутренней соли): H3N+–CH(R) –COO–.
3.2 Нуклеофильно-электрофильные свойства. Выполняется общая закономерность, а именно: наличие электроноакцепторного заместителя облегчает протекание нуклеофильных реакций и затрудняет протекание электрофильных реакций. Так, в присутствии карбоксильной группы атом галогена, например в -галогенкарбоновых кислотах, легко замещается не только на гидроксильную группу (при взаимодействии со щелочами), но и на аминогруппу (при взаимодействии с аммиаком):
R-CH(Cl)-COOH + 3NH3 R-CH(NH2)-COONH4 + NH4C1
Приведенная реакция протекает по механизму SN.
3.3 Реакции циклизации. Относятся к специфическим реакциям гетерофункциональных соединений и могут протекать как внутримолекулярно, так и межмолекулярно в зависимости от удаленности функциональных групп друг от друга.
Внутримолекулярная циклизация. Выполняется общая закономерность: реакции характерны для гетерофункциональных соединений с - и -положением функциональных групп. Нуклеофильный и электрофильный реакционные центры находятся внутри одной молекулы и оказываются сближенными в пространстве за счет существования молекулы в «свернутой» (клешневидной) конформации. В результате реакций внутримолекулярной циклизации могут образоваться циклические полуацетали из альдегидоспиртов по механизму AN:

5-гидроксипентаналь циклический полуацеталь 5-гидроксипентаналя
Реакции идут самопроизвольно уже при незначительном нагревании. Образующиеся циклические продукты подвергаются гидролизу в кислой и щелочной среде с образованием соответствующих солей.
Межмолекулярная циклизация. Выполняется общая закономерность: реакции характерны для -замещенных кислот, проходят по механизму межмолекулярного элиминирования и сопровождаются образованием устойчивых шестичленных циклов — лактидов из - гидроксикислот или циклических диамидов – дикетопиперазидов из -аминокислот:

молочная кислота лактид молочной кислоты
3.4 Реакции комплексообразования. Выполняется общая закономерность: поли- и гетерофункциональные соединения с -положением функциональной группы выступают в роли бидентатных или полидентатных лигандов при взаимодействии с ионами переходных металлов с образованием внутрикомплексных соединений — хелатов.
Реакции хелатообразования широко распространены и играют существенную роль в процессах метаболизма. Один из примеров — образование внутрикомплексной соли — глицината меди при взаимодействии в растворе аминоуксусной кислоты с солями меди (II):
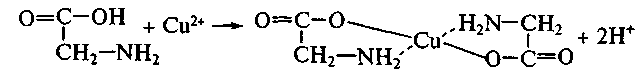
Большинство ионов металлов в организме находятся в виде устойчивых хелатных комплексов с органическими лигандами. Одним из примеров таких соединений является структура гемма гемоглобина крови и хлорофилла.
