
Біосинтез ліпідів
Біосинтез різних груп ліпідів має свої особливості.
Біосинтез жирів. Біосинтез жирів складається з трьох основних етапів: синтез гліцерину, вищих жирних кислот і сполучення їх в молекули тригліцеридів.
Синтез гліцерину. Близько 60% гліцерину утворюється з продукту проміжного обміну вуглеводів – діоксіацетонфосфата, решта поступає за рахунок тріоз пентозного циклу. Під впливом ферменту гліцерофосфатдегідрогенази діоксіацетонфосфат перетворюється в a-гліцерофосфат:

Частина гліцерину утворюється в результаті гідролізу гліцеридів клітин і міжклітинної рідини під впливом ліпаз:

Далі гліцерин під впливом ферменту гліцеролкінази перетворюється в a-гліцерофосфат:

Фосфорилування гліцерину відбувається в більшості тканин і органів, окрім жирової тканини і слизової оболонки тонкої кишки, в яких фермент гліцеролкіназа відсутній.
Біосинтез вищих жирних кислот. Головним компонентом, з якого утворюються вищі жирні кислоти, є ацетил-KoA. Він утворюється в процесі аеробного розпаду вуглеводів, b-окислення жирних кислот та ін.
Розрізняють два типи біосинтезу вищих жирних кислот: мітохондріальний і немітохондріальний.
Перший з них протікає в основному в мітохондріях клітин багатьох органів (печінки, серця, мозку, нирок) і деяких тканин (жировій). Реакції каталізують ферменти синтетази, які локалізуються на мембранах органоїдів і здатні подовжувати молекули вже існуючих активованих залишків вищих жирних кислот за рахунок ацетил-КоА і НАД×Н2:

Другий тип біосинтезу вищих жирних кислот відбувається в гіалоплазмі різних клітин. У ньому беруть участь ферменти карбоксилази, НАДФ×Н2, АТФ і Mg2+. У складі молекул карбоксилази простетична група містить залишок вітаміну біотину, який здатний зв'язувати CO2.
На першому етапі біосинтезу відбувається вбудовування CO2 в молекулу біотин-ферменту (ацетил-КоА – карбоксилази) під впливом ферменту карбоксилази:
![]()


Потім CO2 переноситься на ацетил-КоА, що призводить до утворення малоніл-КоА:

На наступному етапі йде поступове нарощування вуглеводневого радикала жирних кислот до потрібної величини за рахунок малоніл-КоА і ацетил-КоА з участю відповідних синтетаз. При цьому на кожному етапі ланцюг жирної кислоти подовжується на два вуглецеві атоми.
Якщо при біосинтезі утворюється пальмітинова кислота, то хімізм взаємодії ацетил-КоА і малоніл-КоА можна виразити так:

Останніми роками встановлений ще один шлях біосинтезу вищих жирних кислот – за допомогою білка ацилпереносника (АПБ), що містить простетичну групу, схожу з KoA. При цьому ацильні групи ацетил-КоА і малоніл-КоА переносяться на тіолові групи АПБ ферментами ацетил- і малонілтрансферазами. Koферментом є НАДФ×Н2, який утворюється в результаті функціонування пентозного циклу, окислення глутамінової кислоти, ін.
Біосинтез вищих жирних кислот з участю АПБ складається з ряду стадій:



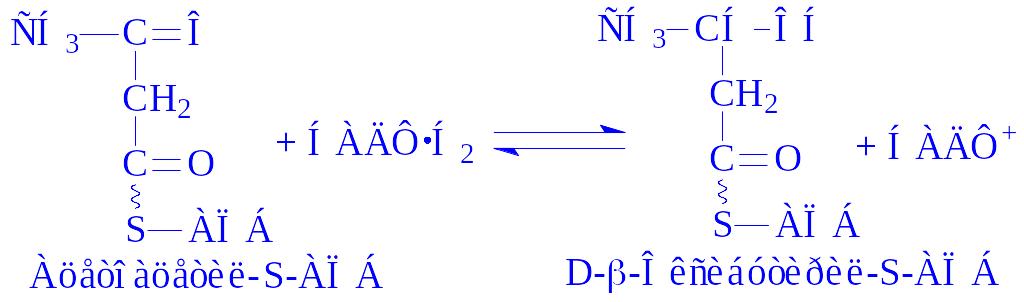



Далі відбувається нарощування вуглеводневого радикала жирної кислоти до величини, необхідної для біосинтезу потрібних клітині ліпідів.
Біосинтез тригліцеридів здійснюється в більшості тканин. Джерелом для синтезу є гліцерофосфат і ацил-KoA. Реакція протікає в декілька стадій. Спочатку утворюється фосфатидна кислота:
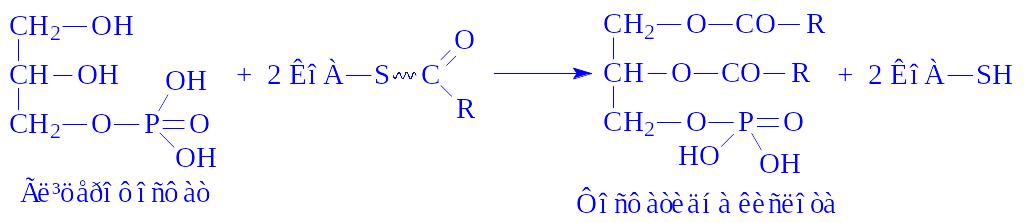
Реакцію каталізує мультиферментний комплекс – гліцерофосфатацилтрансфераза, яка локалізується в мікросомах.
Далі фосфатидна кислота під впливом ферменту фосфатидатфосфогідролази перетворюється в a-, b-дигліцерид – проміжний продукт біосинтезу жирів і фосфатидів:

На останній стадії a-, b-дигліцерид під впливом того ж мультиферментного комплексу взаємодіє з ацил-КоА, утворюючи тригліцерид:

Біосинтез стеринів і стеридів. Стериди синтезуються з екзогенного і ендогенного холестерину та вищих жирних кислот. Найбільша кількість холестерину утворюється в тканинах печінки, головного мозку, наднирниках. Сировиною для біосинтезу служить оцтова кислота, оцтовий альдегід, ацетооцтова кислота, ацетон, ізовалеріанова кислота та ін. Будівельним блоком є ацетил-КоА. Біосинтез холестерину складається з ряду стадій, що включають конденсацію ацетилових одиниць в сквален, циклізацію сквалена в ланостерин, деметилювання ланостерина і утворення холестерину. В цих реакціях беруть участь багато ферментів, коферментів, гормонів, макроергічні сполуки (АТФ) та ін.
Розглянемо послідовність стадій біосинтезу холестерину.
1. Спочатку три молекули ацетил-КоА конденсуються у b-окси-b-метилглутарил-КоА:

2. b-Окси-b-метилглутарил-КоА під впливом ферменту редуктази перетворюється на мевалонову кислоту:

3. Під впливом ферменту кінази мевалонова кислота фосфорилується і перетворюється на пірофосфатмевалонову кислоту:

4. Під впливом ферменту декарбоксилази відбувається декарбоксилування пірофосфатмевалонової кислоти; утворюється ізопентилпірофосфат – „активний ізопрен”:

5. Під впливом ферменту ізомерази частина молекул ізопентилпірофосфата ізомеризується в диметилалілпірофосфат:

6. Молекули ізопентилпірофосфата і диметилалілпірофосфата конденсуються з утворенням геранілпірофосфата:

7. Геранілпірофосфат взаємодіє з ізопентилпірофосфатом з утворенням фарнезилпірофосфата:

8. Дві молекули фарнезилпірофосфата конденсуються у вуглеводень сквален С30Н50, що містить шість подвійних зв'язків. Сквален в аеробних умовах циклізується, перетворюючись в ланостерин. Ланостерин деметилюється (втрачає три метильні групи), перетворюючись спочатку в зимостерин, потім – в десмостерин і, нарешті, в холестерин:

Невелика частина холестерину в тканинах синтезується з деяких амінокислот (лейцина). Після дезамінування і окислення утворюється ацетооцтова кислота – джерело b-окси-b-метилглутарил-KoA.
Холестерин характеризується високим ступенем обміну. Так, протягом доби 20% холестерину з міткою в бічному ланцюзі окислюється до CO2 і H2O. В окремих органах холестерин служить основою для біосинтезу молекул гормонів і біологічно важливих речовин (жовчних кислот).
Біосинтез фосфатидів. У тканинах і клітинах синтезуються окремі види гліцеро-, інозит- і сфінгозинфосфатидів. Перші стадії синтезу гліцерофосфатидів співпадають з такими при біосинтезі жирів (див. вище). Спочатку утворюються фосфатидні кислоти з фосфотріоз. Потім до них приєднуються вищі жирні кислоти у вигляді ацил-КоА. При утворенні молекули гліцерофосфатида один із залишків вищої жирної кислоти повинен належати ненасиченій жирній кислоті (олеїновій, лінолевій, ліноленовій), що поступає в організм у складі раціону. Під впливом фосфатаз фосфатидні кислоти гідролізуються, перетворюючись і a, b-дигліцериди. a, b-Дигліцериди взаємодіють з активованими азотистими основами, утворюючи молекули відповідних фосфатидів. Активація відбувається так:
Азотиста основа фосфорилується. Холін під впливом ферменту холінкінази перетворюється на фосфорилхолін:

Фосфорилхолін під впливом ферменту холінфосфатцитидилилтрансферази взаємодіє з цитидинтрифосфатом (ЦТФ), перетворюючись в цитидиндифосфат-холін (ЦДФ-холін):

ЦДФ-холін під впливом ферменту холінфосфотрансферази вступає в реакцію з a, b-дигліцеридом, що призводить до утворення фосфатида і виділення цитидинмонофосфата (ЦМФ):

ЦМФ взаємодіє з АТФ під впливом ферменту ГТФ-аденілаткінази, перетворюючись в ЦТФ:
ЦМФ + 2АТФ ® ЦТФ + 2АДФ.
ЦТФ вступає в реакцію з новими порціями фосфатів азотистих основ, виконуючи функції специфічного каталізатора.
Біосинтез інших гліцерофосфатидів протікає аналогічно. В синтезі інозитфосфатидів центральне місце належить цитидиндифосфатдигліцериду, який взаємодіючи з молекулами інозиту, утворює моно-, ди- і триінозитфосфатиди.
Фосфатиди синтезуються у всіх клітинах тваринного організму. Найбільша кількість фосфатидів утворюється в печінці і тонкій кишці. Фосфатиди гепатоцитів запобігають печінковому ожирінню. Для фосфатидів характерний високий ступінь метаболізму.
Біосинтез гліколіпідів. Із всіх гліколіпідів найбільш детально вивчений біосинтез цереброзидів. У цьому процесі беруть участь багато ферментів, коферменти, іони Mn2+ та інші речовини. Реакції протікають в такій послідовності.
1. З пальмітил-КоА утворюється пальмітиновий альдегід:

2. Пальмітиновий альдегід конденсується з серином, що призводить до утворення дигідросфінгозина:

3. Дигідросфінгозин дегідрується, утворюючи сфінгозин:

4. Відбувається ацилювання сфінгозина з утворенням цераміда:

5. Церамід вступає в реакцію з УДФ-галактозою, що призводить до утворення цереброзида:

Ліполіз
Ліполізом називається процес ферментативного розщеплення ліпідів тканин і клітин до їх складових частин, які використовуються для задоволення різних потреб організму — енергетичних, пластичних та ін. Обмін різних груп ліпідів, разом із загальними ознаками, має певні особливості.
Перетворення жирів. Під впливом тканинних ліпаз, які активуються солями фосфорної кислоти, нейтральні жири розщеплюються до гліцерину і вищих жирних кислот:
Цей процес найбільш інтенсивно протікає в печінці і легенях. Продукти розпаду жиру відрізняються за своєю хімічною структурою і шляхами перетворення в тканинах і клітинах.
Обмін гліцерину. Після гідролізу жиру гліцерин під впливом ферменту гліцеролкінази фосфорилується. a-Гліцерофосфат, що утворився під впливом ферменту гліцеральдегід-фосфатдегідрогенази окислюється у фосфогліцериновий альдегід, який включається в четверту стадію анаеробного розщеплення вуглеводів або служить джерелом для біосинтезу специфічних жирів тканин, гліцерофосфатів і інших речовин:
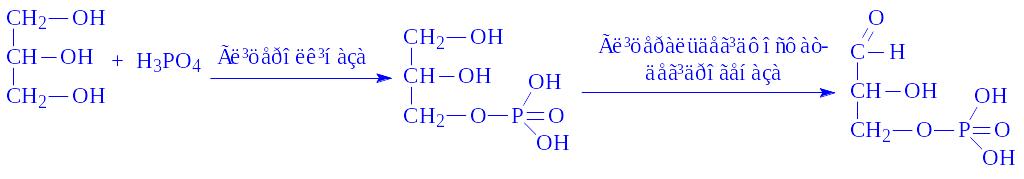
Обмін вищих жирних кислот. Механізм розпаду вищих жирних кислот в організмі пояснює теорія b-окислення жирних кислот, запропонована в 1904 р. німецьким біохіміком Ф. Кноопом. Згідно цієї теорії розпад жирних кислот протікає ступінчасто: від молекули жирної кислоти поступово відщеплюються двохвуглецеві фрагменти, розміщені в b-положенні.
Підставою для створення теорії b-окислення послужили такі факти. В кінці XIX ст. було встановлено, що ароматичні кислоти з організму виводяться з сечею в знешкоджуваному стані – у вигляді парних сполук з глікоколом: бензойна – у вигляді гіпурової, фенілоцтова – у вигляді фенацетурової кислот:
 ,
,

Ф. Кнооп почав „мітити” жирні кислоти раціону ароматичними радикалами. Якщо мітилась жирна кислота з парним числом атомом вуглецю (масляна, капронова, каприлова і т.д.), то в сечі виявлялася фенацетурова кислота. Якщо в раціоні були присутні кислоти з непарним числом атомів вуглецю (пропіонова, валеріанова), в сечі виявлялася гіпурова кислота. Отже, припустив Ф. Кнооп, в тканинах відбувається розпад жирної кислоти на двохвуглецеві фрагменти, а сама „мітка” в печінці з'єднується з цими фрагментами, утворюючи фенацетурову і гіпурову кислоти. Так була створена схема b-окислення вищих жирних кислот.
Припущення Ф. Кноопа були підтверджені в 1937 р. дослідами Шенхеймера і Ріттенберга. Вони згодовували мишам мічену D2 (дейтерієм) стеаринову кислоту і через деякий час знаходили в тканинах D-пальмітинову кислоту. Незабаром А. Ленінджер встановлює, що двовуглецевий залишок включається в цикл трикарбонових кислот. А. Ленінджер і співробітники в 1949 р. встановлюють, що процес b-окислення відбувається в мітохондріях. Уточнюються деталі b-окиcлення (Д. Грін, Ф. Лінен, С. Очоа та ін.). Встановлюється, що ненасичені жирні кислоти перед b-окисленням перетворюються в ненасичені. Створюється наступна сучасна схема b-окислення жирних кислот:
1. Під впливом аденілаткінази жирна кислота активується з утворенням ациладенілата:

2. Ациладенілат взаємодіє з HS-KoA під впливом ферменту ацил-КоА-синтетази з утворенням ацил-КоА:

3. Під впливом флавін-залежної дегідрогенази відбувається дегідрування активованого залишку жирної кислоти:

4. Залишок жирної кислоти під дією еноїл-КоА-гідратази гідрується в ділянці розриву подвійного зв'язку з утворенням b-оксиацил-КоА:
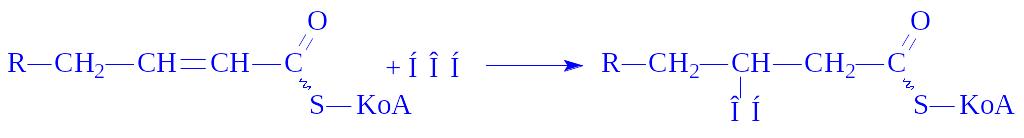
5. b-Оксиацил-КоА під впливом b-оксиацил-КоА-дегідрогенази у присутності НАД+ дегідрується, перетворюючись в кетоформу ацил-КоА:

6. Молекула кетоформи ацил-КоА під впливом ферменту ацетоацетил-КоА-тіолази і за наявності однієї молекули KoA розривається на дві частини: ацетил-KoA і ацил-КоА (останній має на два вуглеці менше початкової кислоти):

Ацил-КоА знову піддається b-окисленню до тих пір, поки вся молекула жирної кислоти не розпадеться на двохвуглецеві фрагменти – ацетил-КоА. Ацетил-КоА вступає в цикл трикарбонових кислот і інші реакції.
Вищі жирні кислоти є найважливішим джерелом хімічної енергії в організмі. При повному окисленні одного двохвуглецевого фрагмента жирної кислоти – ацетил-КоА – в мітохондріях утворюється п'ять молекул АТФ (дві – за рахунок ФАД×Н2 і три – за рахунок НАД×H2). При повному розпаді стеаринової кислоти утворюється дев'ять молекул ацетил-КоА, які дають 45 молекул АТФ (5 ´ 9 = 45). Якщо молекула ацетил-КоА включається в цикл трикарбонових кислот, то при її окисленні утворюється 12 молекул АТФ. Таким чином, дев'ять молекул ацетил-КоА, які утворилися при розпаді стеаринової кислоти, після окислення в циклі трикарбонових кислот є джерелом 108 молекул АТФ (12 ´ 9 = 108). Повне окислення однієї молекули стеаринової кислоти дає організму 153 молекули АТФ (45 + 108 = 153).
Перетворення стеридів і стеринів. Під впливом тканинних холестеринестераз стериди розщеплюються на холестерин і вищі жирні кислоти:

Вищі жирні кислоти використовуються як джерело хімічної енергії, сировина для синтезу ліпідів і інших речовин. Холестерин піддається різним перетворенням: у печінці з нього утворюються жовчні кислоти, в наднирниках – кортикостероїди, в статевих залозах – андро- і естрогени, ін. Частина холестерину дециклізується з утворенням ацетил-КоА, який бере активну участь в обміні речовин (схема 1).

Схема 1. Використання Ацетил-КоА
В деяких органах (печінка, нирки) двовуглецеві фрагменти молекули холестерину, що розпався, використовуються для біосинтезу глюкози й інших вуглеводів.
Перетворення фосфатидів. Молекула фосфатида розщеплюється в тканинах до спирту (гліцерину, інозиту, сфінгозину), вищих жирних кислот, фосфорної кислоти і азотистих основ. Гідроліз здійснюють ферменти типу фосфоліпаз. Гідроліз може бути повним і частковим. При частковому гідролізі найшвидше оновлюється та частина молекули, в якій був розміщений залишок азотистої основи, повільніше – „скелетна частина”. Фосфатидна кислота використовується тканинами для багатьох цілей – біосинтезу нових молекул різних фосфатидів, утворення нейтральних жирів, ін. Продукти кінцевого гідролізу молекули фосфатида можуть використовуватися тканинами для енергетичних, структурних і інших потреб. Високим ступенем метаболізму характеризуються фосфатиди печінки.
Перетворення решти ліпідів в тканинах. Експериментальні дані свідчать про те, що різні підгрупи гліколіпідів (цереброзиди, гангліозиди, страндин) і сульфатидів характеризуються високим ступенем обміну, особливо в нервовій тканині. Деталі їх тканинного метаболізму вивчені недостатньо.
