
- •Тема 1. Молекулярно-кінетична теорія ідеального газу.
- •Тема2.Основи термодинаміки.
- •Ізохорний процес .
- •Ізобарний процес .
- •Ізотермічний процес .
- •Тема 3.Електростатика.
- •Паралельне з’єднання конденсаторів.
- •Послідовне з’єднання конденсаторів.
- •Тема 4.Постійний струм.
- •. Енергетичні зони в кристалах
- •Розподіл електронів по енергетичних зонах. Валентна зона і зона провідності. Метали, діелектрики і напівпровідники
- •Власна провідність напівпровідників
- •§142. Домішкова провідність напівпровідників
- •Тема 5.Магнітостатика.
- •1. Магнітне поле прямолінійного провідника зі струмом.
- •2. Магнітне поле колового струму.
- •Тема 6.Електромагнітна індукція. Магнітні властивості речовини.
- •Тема 7.Основи теорії Максвела для електромагнітного поля.
- •Тема 8.Механічні і електромагнітні коливання.
- •Тема 9.Хвилі. Елементи хвильової оптики.
- •Смуги однакового нахилу
- •§2.1.4. Смуги однакової товщини
- •Кільця Ньютона
- •Дифракція Фраунгофера на одній щілині
- •Дифракція світла на дифракційній гратці
- •Тема 10. Основи квантової оптики.
- •Тема 11.Будова атома за Резерфордом-Бором.
- •Тема 12. Основи квантової механіки.
- •Тема 13.Елементи фізики атомного ядра.
Міністерство освіти і науки України
Червоноградський державний технікум гірничих технологій та економіки
Конспект самостійного вивчення
з предмету
„Загальна фізика”
розроблена згідно ОПП за спеціальністю № 5.090310 „Експлуатація і ремонт гірничого електромеханічного обладнання та автоматичних пристроїв”
Викладач: М.П.Репецький
Червоноград – 2010
РОЗДІЛ 1.Статистична фізика і термодинаміка.
Тема 1. Молекулярно-кінетична теорія ідеального газу.
4.Дослідне обґрунтування молекулярно-кінетичної теорії.5. Дослідні закони ідеального газу
Дослідним шляхом було встановлено цілий ряд законів, які описують поведінку ідеальних газів.
Закон Бойля-Маріотта: для даної маси газу при сталій температурі добуток тиску газу на його об’єм є величина стала:
 або
або
 .
.
Процес, що протікає при сталій температурі, називається ізотермічним.
Закон Гей-Люсаака: об’єм даної маси газу при сталому тиску змінюється лінійно з температурою:

де
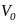 - об’єм
при 0°С,
t
– температура за шкалою Цельсія,
- об’єм
при 0°С,
t
– температура за шкалою Цельсія,
 - коефіцієнт.
- коефіцієнт.
Процес, що протікає при сталому тиску, називається ізобарним.
Закон Шарля: тиск даної маси газу при сталому об’ємі змінюється лінійно з температурою:

де
 - тиск газу при 0°С.
- тиск газу при 0°С.
Процес, який протікає при сталому об’ємі, називається ізохорним.
Вводячи
термодинамічну температуру
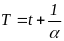 ,
законам Гей-Люссака і Шарля можна надати
такий вигляд:
,
законам Гей-Люссака і Шарля можна надати
такий вигляд:
у випадку ізобарного процесу
 і
і
 ,
,
і ізохорного процесу
 і
і
 .
.
У
молекулярній фізиці вводиться одиниця
кількості речовини моль.
Один моль – кількість речовини, яка
вміщує стільки структурних елементів,
скільки є атомів у 0,012 кг
ізотопу вуглецю
 .
.
В одному молі різних речовин міститься одна і та ж число молекул, яка називається сталою Авогадро:
 .
.
6. Рівняння Клапейрона-Менделєєва. Рівняння Клапейрона: для деякої маси газу при довільній зміні об’єму й температури тиск змінюватиметься так, що відношення добутку тиску на об’єм до абсолютної температури дорівнюватиме деякій сталій величині:
 і
і
 .
.
Рівняння Клапейрона-Менделєєва:

де
 об’єм моля газу (молярний об’єм),
об’єм моля газу (молярний об’єм),
 – універсальна
газова стала.
– універсальна
газова стала.
Для довільної маси газу m рівняння Клапейрона-Менделєєва має такий вигляд:
 ,
,
 ,
,
де μ – молярна маса газу, ν – число молів газу.
7.Основне рівняння молекулярно-кінетичної теорії ідеального газу..
Основне рівняння молекулярно-кінетичної теорії пов’язує параметри стану газу з характеристиками руху його молекул, тобто встановлює залежність між тиском і об’ємом газу та кінетичною енергією поступального руху його молекул.
Тиск газу в посудині є результатом зіткнення молекул газу із стінками посудини. Тиск газу є макроскопічним проявом руху молекул.
Розглянемо
однорідний газ, який поміщений в посудину
кубічної форми. Напрямимо осі системи
відліку вздовж ребер куба (рис. 53).
Нехай певна молекула М
рухається в посудині зі швидкістю
 .
Швидкість
можна розкласти на три складові вздовж
координатних осей:
.
Швидкість
можна розкласти на три складові вздовж
координатних осей:
 .
.

Виділимо
на стінці посудини елементарну площадку
 ,
яка перпендикулярна до осі
,
яка перпендикулярна до осі
 .
При кожному зіткненні молекула передає
площадці імпульс
.
При кожному зіткненні молекула передає
площадці імпульс
 ,
де
,
де
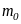 – маса молекули. За час
– маса молекули. За час
 площадки досягнуть лише ті молекули,
які знаходяться в об’ємі циліндра з
основою
і висотою
площадки досягнуть лише ті молекули,
які знаходяться в об’ємі циліндра з
основою
і висотою
 .
Кількість цих молекул дорівнює
.
Кількість цих молекул дорівнює
 ,
де
,
де
 –
кількість молекул в одиниці об’єму
газу. З них тільки половина потрапляє
на площадку
.
Решта через повну безладність
молекулярних рухів рухається не до
стінки, а від неї. За час
об площадку
ударяються
–
кількість молекул в одиниці об’єму
газу. З них тільки половина потрапляє
на площадку
.
Решта через повну безладність
молекулярних рухів рухається не до
стінки, а від неї. За час
об площадку
ударяються
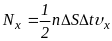 молекул газу.
молекул газу.
Якщо додати імпульси ударів всіх молекул то тиск газу на площадку
 ,
,
де враховано, що імпульс сили дорівнює зміні імпульсу молекул:
 .
.
Врахуємо, що з усіх молекул при хаотичному русі одна третя рухається в напрямку осі ох та те, що величина

називається середньою квадратичною швидкістю.
В результаті тиск газу
 .
.
Це рівняння називається основним рівнянням молекулярно-кінетичної теорії ідеального газу для тиску.
