
Овогенез
Типы овогенеза
Выделено несколько типов овогенеза. Диффузный овогенез - когда развитие женских половых клеток происходит в любом участке тела, и локализованный овогенез, протекающий в специальных женских гонадах – яичниках. Локализованный овогенез в яичнике может протекать без вспомогательных клеток – солитарный овогенез или при участии специальных клеток – алиментарный овогенез.
Каждый тип овогенеза связан с определенным типом питания яйцеклетки (табл.1).
В случае диффузного овогенеза ооциты являются подвижными фагоцитирующими клетками. Ооцит-фагоцит сам не синтезирует желточные включения, а растет за счет поглощения (фагоцитирования) окружающих соматических клеток при движении по межклеточному пространству. При фагоцитарном типе питания в цитоплазме яйцеклетки синтезируются гидролитические ферменты, необходимые для переваривания захваченных структур и накапливающиеся в лизосомах.
При солитарном овогенезе половые клетки самостоятельно синтезируют макромолекулы, получая все необходимые вещества для синтеза из окружающей среды (полости гонады, целомической жидкости, половой железы) в виде простых низкомолекулярных соединений.
Алиментарный овогенез – это развитие яйцеклетки в тесной взаимосвязи со вспомогательными соматическими клетками. Он может быть нутриментарным и фолликулярным.
Нутриментарный тип или мероистический овогенез наиболее хорошо изучен у насекомых. Ооцит окружен трофоцитами (клетками-кормилками), связанными с ним цитоплазматическими мостиками. Трофоциты – абортивные половые клетки, имеющие общее происхождение с ооцитом.
У дрозофилы в результате четырех делений каждый овогоний образует клон из 16 клеток (цистоцит), связанных друг с другом кольцевыми каналами. Овоцитом становится одна из двух клеток с четырьмя цитоплазматическими мостиками (наибольшая связность) в заднем конце яйцевой камеры. Во второй клетке мейоз начинается, но не завершается. Остальные цистоциты образуют питающие клетки. Синтез РНК осуществляется в питающих клетках, а в овоцитах не происходит активной транскрипции и не образуются хромосомы типа «ламповых щеток».
Таблица 1
Особенности овогенеза и типы питания яйцеклеток
Тип овогенеза |
Тип питания яйцеклетки |
Способность к движению, наличие вспомогательных клеток |
Взаимоотношения овоцита с окружающими клетками |
Синтетические процессы в овоците |
Типичные представители |
|
Диффузный |
Фагоцитар-ный |
подвижная клетка вспомогательных клеток нет |
- рост овоцита за счет поступления низкомолекулярных соединений из фаголизосом - не синтезирует вещества |
губки, кишечнополост-ные, ресничные черви
|
||
Локализованный |
Солитарный |
вспомогательных клеток нет |
вещества в низкомолекулярной форме поступают в овоцит из целомической жидкости и из половой железы |
- желточные белки и РНК синтезируются овоцитом самостоятельно в эндоплазматическом ретикулуме (эндогенный синтез) - формирование желточных гранул происходит в аппарате Гольджи - формирование хромосом типа «ламповых щеток» |
колониальные гидроидные полипы, иглокожие, некоторые черви, бескрылые насекомые, ланцетник |
|
Алиментарный |
Нутриментарный |
неподвижный овоцит окружен трофоцитами – клетками-кормилками, между которыми сохранены цитоплазматические мостики (незавершенная цитотомия); овоцит и клетки-кормилки имеют общее происхождение от одной овогониальной клетки |
- трофоциты синтезируют рРНК - в вителлогенезе трофоциты участия не принимают - высокомолекулярные вещества поступают извне |
- из трофоцитов по цитоплазматическим мостикам в овоцит поступают рибосомы и рибонуклеопротеиновые частицы - хромосомы типа «ламповых щеток» работают кратковременно или отсутствуют |
высшие черви, членистоногие |
|
Фолликулярный |
овоцит окружен фолликулярными соматическими клетками без прямых цитоплазматических связей; образует выросты |
фолликулярные клетки не синтезируют вещества, а выполняют транспортную роль |
- овоцит получает аминокислоты, жиры и белки извне, например, из печени у курицы - для питания яйцеклетки используются все резервы материнского организма (экзогенный синтез) - формирование хромосом типа «ламповых щеток» |
большинство животных, включая всех хордовых, многие беспозвоночные |
||
Однонаправленное движение веществ из питающих клеток в овоцит, вероятно, связано с наличием в яйцевой камере электрического градиента, обеспечивающего избирательную диффузию молекул, поэтому свободного обмена молекулами не происходит.
Три основных желточных белка дрозофилы образуются не в овоците, а в жировом теле и яичнике. Контроль за синтезом осуществляет ювенильный гормон экдизон и нейросекреторный гормон мозга. Экдизон регулирует поглощение желточных пептидов с поверхности ооцита, запускает синтез желточных белков в яичнике и жировом теле. Введение экдизона взрослым самцам стимулирует образование белков желтка в их жировом теле. Овогенез длится 12 суток и метаболическая активность питающих клеток должна быть очень высокой, что достигается путем политенизации хромосом. Образуется 512 копий хромосом вместо двух при репликации ДНК.
Несмотря на то, что у насекомых желток в яйце занимает центральную часть, яйцо имеет полярность, образованную в результате распределения материнских продуктов в цитоплазме овоцита. У некоторых насекомых нутриментарный тип питания сочетается с фолликулярным. В этих случаях фолликулярные клетки окружают овоцит вместе с его клетками-кормилками еще одним слоем.
Фолликулярный овогенез является наиболее распространенным типом в животном мире. Функциональной единицей является – фолликул, когда растущий овоцит окружается вспомогательными фолликулярными клетками, соматическими по происхождению. У млекопитающих происходит поступательное развитие фолликулов от стадии примордиальных фолликулов до граафовых пузырьков, так называемый процесс фолликулогенеза, который будет детально рассмотрен в разделе «овогенез человека». Фолликулярные клетки не участвуют в синтезе белков желтка, а все виды РНК синтезируются в самом овоците. Исключение составляют фолликулярные клетки птиц и ящериц, синтезирующие РНК для овоцита. Среди многочисленных функций фолликулярного эпителия – проведение и селекция гетеросинтетических макромолекул, защитная, регуляторная, синтез вторичных оболочек.
Общая характеристика овогенеза
Овогенез или дифференцировка половых клеток по женскому типу обеспечивает образование высокоспециализированной яйцеклетки и включает три периода: размножение, рост и созревание (рис. 9).
Размножение
Первичные гоноциты, достигнув яичника, становятся овогониями. Овогонии - это незрелые половые клетки, способные к митотическим делениям, число которых видоспецифично. Митотические деления овогониев могут быть связаны с сезонным размножением и повторяются в течение всей жизни (рыбы, амфибии) или происходить только в период внутриутробного развития плода и завершаться к рождению (млекопитающие). Например, у человека максимальное количество овогониев (6-7 млн) обнаруживается у пятимесячного плода, затем происходит разрушение (атрезия) половых клеток и к моменту рождения девочки количество овогониев не превышает 1 млн. Закончив митотические деления, овогонии вступают в период роста и становятся овоцитами I порядка.
Рост
В растущем овоците происходят активные синтетические процессы: ядро вступает в профазу первого деления мейоза, а в цитоплазме накапливаются питательные вещества, органеллы, РНК, белки, рибосомы. Это стадия малого роста овоцита, или превителлогенез (цитоплазматический рост), когда рост овоцита незначителен и ядерно-цитоплазматическое отношение не нарушается.
Синтетические процессы в овоците протекают с огромной скоростью, что обеспечивается амплификацией генов и формированием хромосом типа «ламповых щеток».
Амплификация генов заключается в том, что участки ДНК, которым надлежит синтезировать большие количества РНК, многократно копируются (амплифицируются): с петли рибосомной ДНК (рДНК) снимаются кольцевые копии в виде первичных ядрышек, на которых транскрибируются рРНК, необходимая для сборки рибосом. Это механизм регуляции активности генов, многократно усиливающий транскрипцию некоторых конкретных генов.
Например, в овоцитах амфибий синтез дополнительного количества рДНК и появление экстра-копий ядрышкового организатора происходит во время пахитены. У Xenopus и Bufo на стадии лептотены в ядре содержится только одно ядрышко, на стадии пахитены появляются дополнительные ядрышки часто в виде колец, их количество постоянно растет и на стадии диплотены достигает 1000.
Накопление тРНК происходит без амплификации. Информационная РНК (мРНК) транскрибируется с хромосом типа «ламповых щеток», которые являются деспирализованными участками ДНК. В цитоплазме мРНК покрывается белковой оболочкой, формируя информосомы. Большинство синтезированных матриц и рибосом заготавливается впрок и будет использовано только после оплодотворения.
С середины диплотены начинается большой рост овоцита, или вителлогенез (трофоплазматический рост), во время которого значительно увеличивается объем цитоплазмы и начинается накопление в ней желточных включений, а также углеводов, липидов, рибосом. Ядерно-цитоплазматическое отношение уменьшается, и яйцеклетка увеличивается в размере в десятки (человек) или сотни тысяч раз (лягушка). Однако на стадии диакинеза мейоз останавливается (блок мейоза) и возобновляется только с наступлением половозрелости. У человека блок мейоза снимается через 10-15 лет, профаза первого деления мейоза и рост овоцита I порядка растягивается на многие годы репродуктивного периода.
Материал, накопленный в цитоплазме овоцита во время профазы I мейоза, включает источники энергии и органеллы (желток и митохондрии), ферменты, предшественники синтеза ДНК, РНК и белка, запас информационных РНК, структурные белки и морфогенетические детерминанты - все, что необходимо для будущего развития зародыша.
Созревание
Это заключительный период овогенеза, во время которого овоцит первого порядка с диплоидным ядром (2n4c) в результате двух последовательных делений созревания мейоза превращается в зрелую гаплоидную яйцеклетку (nc), готовую к оплодотворению. При первом делении мейоза (редукционное деление мейоза) образуется овоцит второго порядка и первое редукционное тельце. При втором делении созревания (эквационное деление мейоза) образуется зрелое яйцо и три редукционных тельца, которые впоследствии дегенерируют. Деления созревания в овогенезе происходят с неравномерным распределением цитоплазмы между сестринскими клетками, в результате чего весь накопленный материал попадает только в одну клетку – яйцеклетку.
Вителлогенез
Вителлогенез (vitellus – желток) может осуществляться за счет эндогенного (самим овоцитом) или экзогенного синтеза веществ. Накопление желтка за счет эндогенных синтезов в самом растущем овоците характерно для организмов с солитарным типом питания яйцеклеток, например моллюсков, кишечнополостных, иглокожих. Двойное происхождение желтка
встречается у некоторых кольчатых червей, ракообразных, низших насекомых. У большинства животных желток запасается за счет экзогенных синтезов в разных соматических тканях. Однако в процессе эволюции синтез желтка постепенно концентрируется в определенном органе, например, в печени у позвоночных или жировом теле у насекомых.
Желток (вителлин) состоит из комплекса веществ (белки, жиры, углеводы), используемых для питания зародыша. В цитоплазме овоцита желток запасается в виде гранул или пластин, ограниченных мембраной. Основным структурным компонентом желткового белка является вителлогенин (молекулярная масса 470 000 дальтон), состоящий из липовителлина (липопротеид, содержащий до 20% липидов) и фосвитина (фосфопротеин, содержащий 8% фосфата). Желточная гранула образована одной молекулой липовителлина и двумя молекулами фосвитина.
Вителлогенез у позвоночных регулируется гормональными взаимодействиями гипоталамуса, гипофиза и фолликулярных клеток яичника. Гипоталамус выделяет рилизинг-фактор гонадотропного гормона (люлиберин), который воспринимает гипофиз и, в свою очередь, выделяет гонадотропины в кровь. Гонадотропины стимулируют фолликулярные клетки яичника к секреции эстрогена, вызывающего резкое изменение функционального состояния клеток печени, которые начинают синтезировать вителлогенин. Если эстроген инъецировать взрослым самцам амфибий, изменения в клетках печени также наступают, и происходит синтез вителлогенина. После введения эстрогена каждая клетка содержит около 50 000 молекул мРНК вителлогенина, которая до введения гормона не обнаруживалась. Синтеза других новых белков не происходит. Поэтому эстроген считается гормоном, контролирующим накопление вителлогенина путем регуляции генов на уровне транскрипции и трансляции.
Вителлогенин, синтезированный в печени, доставляется в яичник с кровью. Через фолликулярные клетки яичника этот белок попадает в овоцит с помощью микропиноцитоза, когда внутрь клетки отделяются одетые мембраной пузырьки в основании микроворсинок. В зрелом овоците из вителлогенина образуется вителлин - пиноцитозные пузырьки сливаются, формируя желточные пластинки.
Таблица 2
Классификация типов яйцеклеток
Типы яиц по количеству желтка |
Типы яиц по распределению желтка |
Типичные представители |
алецитальные или безжелтковые |
|
плацентарные млекопитающие |
Олиголецитальные или маложелтковые |
изолецитальные (гомолецитальные) одиночные желточные включения распределены равномерно |
большинство червей и моллюсков, асцидии, иглокожие, ланцетник |
Мезолецитальные или со средним количеством желтка |
телолецитальные желток смещен к одному из полюсов яйца |
амфибии, головоногие моллюски, осетровые рыбы |
Полилецитальные или многожелтковые
|
телолецитальные |
костистые рыбы, рептилии, птицы |
центролецитальные желток сосредоточен в центре яйца |
большинство членистоногих |
Вителлогенин проникает в овоцит равномерно и одинаково по всей поверхности. Однако дальнейшее его распределение внутри овоцита изменяется, и отложение желтка в яйце происходит асимметрично, максимальная концентрация наблюдается на вегетативном полюсе. В результате формируется анимально-вегетативная ось. Желточные пластинки, сформированные на анимальном полюсе, смещаются к центру, внутрь клетки. На вегетативном полюсе они не меняют своего положения, остаются на периферии и постепенно увеличиваются в размерах. Затем медленно перемещаются внутрь овоцита, а на их месте формируются новые желточные пластинки. В результате транспорта желточных пластинок количество желтка в вегетативной части яйца достигает 75%. Другие органеллы яйца тоже перемещаются и распределяются специфическим образом – процесс ооплазматической сегрегации. Кортикальные гранулы формируются из аппарата Гольджи и сначала рассеяны по всей цитоплазме овоцита, однако затем занимают строго определенное место – на периферии яйцеклетки. Там же располагаются многочисленные митохондрии и пигментные гранулы. Так формируется кортикальный слой яйца. Внутри яйца в цитоплазме также происходит перераспределение веществ. Желточные пластинки концентрируются в вегетативной части яйца, а гликогеновые гранулы, рибосомы, эндоплазматический ретикулум и митохондрии – на анимальном полюсе. К концу вителлогенеза цитоплазма овоцита становится многослойной, с четким распределением веществ по анимально-вегетативной оси яйца. Вероятно, что в этом процессе особую роль играет цитоскелет. Микротрубочки способствуют перемещению мРНК в направлении вегетативного полюса, а микрофиламенты задерживают их в кортексе яйца.
Количество и распределение желтка в яйцеклетках имеет огромное значение для развития. В зависимости от биологии размножения запас питательных веществ в яйце варьирует очень широко. Желтка совсем мало в яйцеклетках плацентарных млекопитающих, эмбрионы которых получают питание из материнского организма, или перепончатокрылых насекомых, откладывающих яйца в чужие организмы (наездники), а также в яйцах животных, подвижные личинки которых выходят из оболочек на очень ранних стадиях развития (морской еж). У животных (рыбы, амфибии, рептилии, птицы), развитие которых происходит за счет собственных запасов питательных веществ в течение длительного времени с формированием высокоразвитого организма, образуется большое количество желтка. Морфологическая характеристика яйцеклеток в зависимости от количества и распределения желтка представлена в таблице 2.
Оболочки яйцеклетки
Поверх плазматической мембраны, яйцеклетка окружена несколькими специализированными оболочками. Первичная или желточная оболочка прилегает к поверхности яйцеклетки, выделяется самой яйцеклеткой и имеется у всех организмов. Особенно хорошо первичная оболочка развита у яиц большинства позвоночных. Она пронизана выростами яйца и фолликулярных клеток, поэтому выглядит радиально исчерченной и называется zona radiata. У млекопитающих желточная оболочка выглядит как блестящий ободок вокруг яйца и называется zona pellucida (рис. 10, 11).
Вторичные и третичные оболочки встречаются не у всех яйцеклеток. Вторичные оболочки или хорион являются продуктом выделения фолликулярных клеток и лучше выражены в яйцах насекомых. Обычно это жесткая и непроницаемая оболочка с одним или несколькими узкими отверстиями (микропиле) для проникновения сперматозоидов. Третичные оболочки формируются за счет выделений желез яйцевода. Хорошо развиты третичные оболочки у яиц некоторых позвоночных. В яйцах амфибий – это прозрачная толстая студенистая оболочка. Наиболее сложные третичные оболочки у акуловых и химеровых рыб. Часто вытянутой формы, в виде люльки, плотная роговая оболочка четко имеет размер и форму зародыша перед вылуплением. У птиц третичные оболочки включают белковую, две подскорлуповых пергаментных и скорлуповую оболочки. По мере движения яйца по яйцеводу вниз железы последовательно формируют защитные оболочки зародыша.
Блокирование мейоза и выход из блока
Процесс мейоза при созревании яйцеклетки может происходить без участия сперматозоида или, наоборот, с их участием. Без участия сперматозоида мейоз завершается у немногих организмов (актинии, морской еж). Развитие яйцеклетки останавливается на стадии образования женского пронуклеуса и возобновляется после оплодотворения.
У большинства животных остановка мейоза происходит на длительный период во время профазы первого деления (стадии диплотена-диакинез). Это первый блок мейоза при созревании яйцеклетки, который снимается овуляцией, т.е. выходом зрелой яйцеклетки из фолликула.
Второй блок мейоза (послеовуляторный блок) – короткий, и он снимается сперматозоидом или другим активирующим агентом, например механическим воздействием или изменением солевого состава окружающей среды.
Какие механизмы лежат в основе этих процессов, что выводит овоцит из состояния покоя и возобновляет мейоз, а позже блокирует мейоз на стадии метафазы II – это вопросы, на которые пока нет достаточно полных ответов.
Известно, что за возобновление мейоза отвечает фактор, стимулирующий созревание (ФСС), активный при делении клетки и отсутствующий в интерфазе. ФСС – это протеинкиназа, которую активирует циклин – белок, транслирующийся в интерфазе и быстро разрушающийся при окончании деления клетки. Если по окончании деления клетки циклин не разрушается, то ФСС сохраняет активность, и клетка блокируется в метафазе. Как только циклин разрушается, ФСС инактивируется, и клетка возвращается в интерфазу.
Например, цитоплазма овулирующего яйца амфибий может вызывать задержку деления других клеток в метафазе. Очевидно, это связано с присутствием в цитоплазме так называемого цитостатического фактора (CSF), блокирующего деление клетки в метафазе. Недавно цитостатический фактор CSF был выделен и описан как белок pp39mos с молекулярной массой 39 000 дальтон.
Вероятная цепь событий, происходящих в овоците следующая. Прогестерон вызывает в овоците трансляцию особой материнской мРНК, запасенной ранее в цитоплазме. Процесс кодируется протоонкогеном mos, и в результате синтезируется фосфопротеин pp39mos, основная функция которого – пробуждение яйца. Этот белок выявляется только при созревании овоцита и быстро разрушается после оплодотворении. Если ингибировать трансляцию этого белка – дезинтеграции зародышевого пузырька не происходит, и процесс созревания овоцита не возобновляется.
Таблица 3
Характеристика мейоза у разных групп животных
Особенности мейоза |
Первый блок мейоза |
Второй блок мейоза |
Оплодотворение |
Типичные представители |
Мейоз без остановки |
|
|
стадия женского пронуклеуса |
некоторые кишечнополостные морской еж |
Одна остановка |
стадия диакинеза профазы I |
|
стадия диакинеза профазы I мейоза |
губки, некоторые плоские, круглые, кольчатые черви, моллюски. |
Две остановки |
стадия диплотены-диакинеза профазы I; у млекопитающих блок мейоза происходит в эмбриональный период; блок снимается овуляцией |
стадия метафазы I |
стадия метафазы I |
некоторые губки, немертины, моллюски, большинство насекомых собаки, лисицы, лошади |
стадия метафазы II |
стадия метафазы II |
почти все хордовые |
||
стадия анафазы II |
стадия анафазы II |
летучие мыши |
Кроме того, белок pp39mos удерживает хромосомы в метафазе до оплодотворения. Белок фосфорилирует специфическую протеазу, и разрушение циклина в комплексе ФСС-циклин не происходит. Если циклин не деградирован, то ФСС стабилизируется и клетка вступает в метафазу и остается на этой стадии пока не будет разрушен ФСС.
Если белок pp39mos разрушается (что происходит при оплодотворении), то активируется специфическая протеаза, разрушающая циклин, и мейоз возобновляется.
Очевидно, деградация белка pp39mos связана с Ca-зависимой протеазой кальпен II, которая активируется при высвобождении ионов Ca² из эндоплазматического ретикулума при оплодотворении. В результате происходит возобновление мейоза и его завершение при оплодотворении.Таким образом, увеличение концентрации белка pp39mos связано с присутствием прогестерона, а снижение – с активацией кальпена II.
В зависимости от стадии, на которой наступает блокировка мейоза, и когда в яйцеклетку проникает сперматозоид, животных можно разделить на несколько групп (табл.3).
Молекулярно-генетические механизмы формирования овоцита
Яйцеклетка – это не гомогенное образование, а гетерогенная, химически преформированная система. Именно в ходе ооплазматической сегрегации формируются региональные особенности цитоплазмы. Происходит специфическое распределение биологически активных веществ и образование полярных градиентов, которые на химическом уровне определяют план строения будущего организма. Яйцеклетка характеризуется анимально-вегетативным градиентом – постепенное снижение концентрации и синтеза РНК и белков от анимального полюса к вегетативному. В вегетативной части яйцеклетки располагаются метаболически инертные запасные питательные вещества.
Значение ооплазматической сегрегации было показано в экспериментах Ж.Браше, который разрушал градиент веществ цитоплазмы путем центрифугирования. Если в результате центрифугирования разрушалась система градиентов, а распределение РНК, белков и других веществ в цитоплазме яйца оказывалось равномерным – развитие останавливалось, и зародыш погибал. Если путем центрифугирования единый анимально-вегетативный градиент разделялся на два самостоятельных – возникал зародыш с двумя системами осевых органов.
Разрушение анимально-вегетативного градиента, вероятно, нарушает неравномерное распределение РНК, от которого зависит синтез соответствующих белков, специфичных для определенных районов развивающегося зародыша. В ходе дальнейшего развития, на стадии дробления бластомеры отличаются друг от друга как в физиологическом, так и в молекулярном отношении.
Однако такая гетерогенность яйцеклетки свойственна не всем организмам. Вероятно, для яиц млекопитающих не характерна фиксированная гетерогенность, и анимально-вегетативная ось устанавливается после развития зиготы. В экспериментах на овоцитах мышей, удалось получить нормальное развитие бластоцисты из яиц, лишенных анимального или вегетативного полюса. Возможно, в таких оперированных овоцитах происходит в дальнейшем перераспределение различных маркеров в ходе раннего развития, что может указывать на высокую регуляционную способность овоцитов млекопитающих.
У некоторых организмов (амфибии, насекомые) формирование анимально-вегетативного градиента зависит от материнского организма.
На созревших яйцах Rana pipiens была показана прямая зависимость полярности яйца от распределения кровеносных сосудов. У 75-80% созревших яйц Rana pipiens стебелек, прикрепляющий оболочку яйца к яичнику, расположен в области экватора яйца неслучайно. Выходящие из стебелька кровеносные сосуды распространяются по оболочке, причем основная часть артериальных сосудов располагается в анимальной половине яйца, тогда как венозные сосуды – преимущественно в вегетативной части. В результате формируется градиент интенсивности процессов обмена веществ, подобно градиентам распределения желтка и пигмента. Анимальный полюс, снабжаемый артериальной кровью, находится в более благоприятных условиях, что способствует накоплению биологически активных веществ и более активному метаболизму. В цитоплазме вегетативного полушария, снабжаемого
Таблица 4
Системы генов, контролирующие формирование овоцита у дрозофилы
Гради-ент овоцита |
Гены |
Локализация продукта гена (мРНК, белок) |
Функция гена и его продукта |
Фенотипическое проявление мутации гена |
Анимально-вегетативный |
bicoid
exuperantia shallow nanos: активируется 5 генами с материнским эффектом и геном pumilio hunchback:активируктся белком гена bicoid |
Синтез и транспорт мРНК из питательных клеток в анимальный полюс (передняя часть зародыша) Анимальный полюс
Синтез мРНК в фолликулярных клетках, транспорт ее для синтеза белка на вегетативном полюсе Передняя половина зародыша |
Белок стимулирует транскрипцию гена hunchback
Поддержание стабильности и распределения продукта гена bicoid
Блокировка трансляции мРНК гена hunchback Участие в транспорте продукта гена nanos Репрессирует гены, активные в брюшных сегментах |
Нарушение развитие головного конца
Отсутствие самых передних структур
Нарушение заднего конца зародыша
Леталь при мутации, гомозиготной по этому гену |
Дорзо-вентральный |
torpedo pipe, nudel, windbeutel spatzle:активируется генами snake и easter toll:активируется продуктом гена spatzle pelle cactus dorsal |
Фолликулярные клетки Фолликулярные клетки
Перивителлиновое пространство
Активируется на вентральной стороне и белок распределяется по всему яйцу равномерно
|
Белок связывает лиганд из овоцита
Посылают сигнал в вентральную часть овоцита Формирование дорсо-вентрального градиента
Высвобождает белок dorsal из комплекса dorsal-cactus |
Развитие дорсальной части зародыша |
Образование терминальных структур |
torso: белок активируется продуктом гена torsoless и взаимодействием с генами tailless huckebein |
Передний и задний концы зародыша Фолликулярные клетки |
Контроль формирования акрона и тельсона |
При отсутствии белка эмбрион полностью сегментирован При доминантной мутации гена передняя половина зародыша превращается в акрон, задняя – в тельсон
|
венозной кровью, создаются условия для накопления запасных питательных веществ, в связи с более инертным метаболизмом.
У насекомых ооплазматическая сегрегация обусловлена положением овоцита относительно окружающих трофических клеток. Обычно полюса овоцита имеют неравное положение относительно трофических клеток, и всегда один из полюсов окружен большим количеством питающих клеток, снабжающих его через специальные канальцы различными веществами (РНК, белки и др.) и даже митохондриями (у некоторых жуков). Поставленный в более благоприятное положение относительно трофоцитов полюс овоцита впоследствии становится анимальным.
Молекулярно-генетические механизмы формирования градиентов в яйцеклетке наиболее изучены на дрозофиле.
Яйцеклетка дрозофилы развивается из общей с трофоцитами клетки-предшественника. Каждая такая клетка претерпевает 4 деления, в результате чего образуется 16 клеток, одна из которых будет половой. Будущие половые клетки выявляются рано, после того как ядра, дающие начало зародышевому пути, попадают в область полярной плазмы, образование которой контролируется геном oscar. В половой клетке в цитоплазме выделяется специфическая область – спектросома. Остальные клетки становятся питающими и соединены с яйцеклеткой цитоплазматическими мостиками, по которым в нее поступают различные вещества, участвующие в формировании градиентов. Хромосомы трофических клеток претерпевают политенизацию, что активизирует процесс обслуживания яйцеклетки. Из материнской мезодермы образуется около 1000 мелких фолликулярных клеток, окружающих дифференцирующийся овоцит с трофическими клетками. Будущий передний конец эмбриона располагается в области овоцита, прилежащий к трофоцитам, а более выпуклая поверхность яйца становится вентральной частью эмбриона. Далее начинается активное функционирование материнского генома в трофических и фолликулярных клетках.
Выделяют три основные системы генов, особенно важных для формирования градиентов яйцеклетки (табл. 4).
Первая система генов обеспечивает формирование анимально-вегетативного градиента. Вторая система генов контролирует формирование дорсо-вентрального градиента яйца. Наконец, третья система генов контролирует формирование градиентов в овогенезе, а именно образование терминальных структур – акрона (несегментированный головной конец) и тельсона (несегментированный хвостовой конец).
В первой системе генов ключевым является ген bicoid, содержащий специфическую консервативную последовательность ДНК из 180 нуклеотидов, названную гомеобокс. При мутации гена bicoid нарушается развитие головного конца дрозофилы (вместо головы и груди развиваются структуры заднего конца зародыша), тогда как задний конец развивается нормально. Продукт гена bicoid перемещается из питательных клеток в анимальный полюс развивающегося овоцита, формируя выраженный анимально-вегетативный градиент распределения продукта этого гена. Такие продукты называются морфогенами.
Для четкого распределения продукта гена bicoid на переднем полюсе зародыша требуется активность еще двух генов: exuperantia и swallow. Мутации этих генов нарушают градиент распределения белка bicoid, у зародышей отсутствуют самые передние структуры, но формируются удлиненные челюсти и грудные структуры.
Кроме этого, фолликулярные клетки передают в овоцит транскрипты гена nanos, которые локализуются на вегетативном полюсе. Белок гена nanos синтезируется в области заднего полюса и затем транспортируется в область брюшных сегментов, что осуществляется при участии продукта гена pumillo. У мутантов nanos нарушается развитие заднего конца зародыша. Если транскрипты гена nanos инъецировать в передний конец зародыша, то в этой области могут сформироваться различные структуры, свойственные заднему полюсу.
В формировании плана строения организма на самых ранних этапах созревания овоцита принимает участие важный ген hunchback, который функционирует и в материнском, и в зиготическом геноме. Работа гена hunchback зависит от гена bicoid, а его продукты сосредоточены в передней части зародыша, где формируются головные и грудные сегменты. Мутанты, гомозиготные по этому гену утрачивают передние структуры и являются летальными.
К генам, контролирующим формирование дорзо-вентрального градиента, относятся torpedo, pipe, nudel, windbeutel, которые функционируют в фолликулярных клетках. Гены овоцита посылают сигнал неизвестной природы к рецептору, кодируемому геном torpedo, белок которого способен связывать лиганд из овоцита. Далее гены фолликулярных клеток посылают сигнал в вентральную область овоцита (рис. 12).
После оплодотворения гены snake, easter активируют ген spatzle, продукт которого активирует на вентральной стороне яйца ген toll. Продукт гена toll в свою очередь активирует продукт гена pelle – киназу, которая фосфорилирует продукт гена cactus. Этот процесс заканчивается высвобождением продукта гена dorsal, поступающий в ядра. В этом каскаде реакций ген toll необходим для формирования дорзо-вентральной полярности и активация toll-рецептора высвобождает белок гена dorsal из комплекса dorsal-cactus. В ядрах формируется градиент белка гена dorsal, концентрация которого выше в вентральной области и ниже – в дорсальной. Возможно, снижение концентрации белка dorsal вызывает реакции, трансформирующие клетки в дорсальном направлении.
А


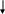



Анимальный полюс Вегетативный полюс
(передний конец зародыша) (задний конец зародыша)
Б





 snake
snake
easter

дорсальная вентральная перивителлиновое
сторона сторона пространство
Рис. 12 . Схема детерминации анимально-вегетативного (А) и дорсо-вентрального (Б) градиентов в яйце дрозофилы. Гены и их продукты неизвестной природы указаны вопросом.
В третьей группе генов, определяющих формирование градиентов в овогенезе, основная роль принадлежит гену torso, активация белка которого осуществляется продуктом гена torsoless, функционирующем в фолликулярных клетках, а также взаимодействием с продуктами генов tailless и huckebein. При отсутствии продукта гена torso эмбрион развивается полностью сегментированный, акрон и тельсон не развивается.
Таким образом, развитие овоцита представляет собой последовательное формирование гетерогенности его цитоплазмы, т.е. осуществляется ооплазматическая сегрегация. В этот период функционирует большое количество генов, и в яйцеклетке накапливается набор самых разных мРНК, многие из которых будут использованы на более поздних стадиях развития эмбриона. Именно в ходе созревания яйцеклетки закладывается план будущего строения организма.
Овогенез у человека
Созревание яиц и овуляция у млекопитающих может протекать двумя способами. В первом случае (кролики, норки) овуляция стимулируется актом спаривания. При физическом раздражении шейки матки происходит выделение гонадотропинов из гипофиза, в результате чего возобновляется мейоз и происходит овуляция. Большая часть копуляций завершается оплодотворением яйца.
Во втором случае, что характерно для большинства млекопитающих и человека, овуляция происходит в определенное время года, т.е. характерна периодичность. Обычно определенные факторы среды являются сигналом для гипоталамуса, который выделяет рилизинг-фактор гонадотропинов. Этот фактор вызывает в гипофизе секрецию гонадотропинов: фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ), которые обеспечивают пролиферацию фолликулярных клеток, рост фолликула и инициируют овуляцию. Кроме того, гонадотропины вызывают секрецию эстрогена, который взаимодействует с определенными нейронами, что запускает цепь реакций брачного поведения, характерного для вида.
Процесс созревания и выделения яйцеклетки (менструальный цикл) у приматов включает ряд событий, которые регулируются гормонами гипофиза, гипоталамуса и яичника: овариальный цикл – созревание и выделение овоцита; маточный цикл – создание условий для имплантации бластоцисты в матку; цервикальный цикл – обеспечение условий для проникновения спематозоидов в женский половой путь только в определенное время.
Периодичность у человека около 29 суток, хотя она не приурочена к определенному сезону. Большая часть овоцитов в зрелом яичнике женщины блокирована на длительной стадии диплотены профазы первого деления мейоза. Каждый овоцит заключен в первичном фолликуле, состоящем из одного слоя эпителиальных клеток гранулезы и менее организованного слоя теки. Периодически одна или другая группа первичных фолликулов вступает в стадию фолликулярного роста - фолликулогенез. При этом объем овоцита увеличивается в 500 раз. Рост овоцита сопровождается увеличением числа фолликулярных клеток (гранулеза фолликула), образующих вокруг овоцита концентрические слои. Вначале однослойные, фолликулы в результате размножения фолликулярных клеток становятся многослойными (первичные фолликулы). Позже фолликулярные клетки начинают выделять особую жидкость и постепенно резорбироваться, а на их месте возникают полости (антрум) – так формируется вторичный фолликул. Полость фолликула заполняется смесью белков, гормонов, цАМФ и других молекул. По мере роста овоцита полости сливаются в одну, и фолликул становится зрелым, или Граафовым, пузырьком.
В каждый конкретный момент созревает небольшая группа фолликулов. Но большая часть из них погибает. Чтобы овоцит прошел дальнейшее развитие, необходимо воздействие гонадотропных гормонов. Созревание овоцита произойдет в том случае, если фолликул будет находиться на определенной стадии развития, когда поднимется волна гонадотропина. Это фолликулярная фаза менструального цикла, когда гипофиз начинает секретировать все большее количество ФСГ. В ответ на гормон, созревающие фолликулы продолжают рост и пролиферацию клеток. Далее в гипофизе начинается секреция гормона ЛГ, снимающего блок мейоза. Ядерные
мембраны овоцитов разрушаются, хромосомы продолжают первое деление мейоза. Один набор хромосом остается внутри овоцита, а другой попадает в небольшое полярное тельце. Это происходит в пределах блестящей оболочки zona pellucida. На этой стадии происходит овуляция: стенка Граафова пузырька лопается, яйцеклетка освобождается из яичника и выходит в яйцевод.
Оба гонадотропина воздействуют на фолликулярные клетки, в которых усиливается синтез эстрогена, регулирующего дальнейшее протекание цикла. Максимальная секреция эстрогена приходится на середину цикла. В это же время отмечается всплеск выделения ЛГ и небольшой подъем ФСГ. В течение 10-12 часов после всплеска гонадотропина ЛГ яйцеклетка овулирует. Возможно, физический выход яйцеклетки из фолликула связан с повышением содержания внутри фолликула простагландинов, которые вызывают сокращение гладких мышц яичника и увеличивают отток воды из овариальных капилляров. Если синтез простагландинов ингибировать, то овуляции не происходит. Таким образом, лютеинизирующий гормон вызывает повышение давления внутри фолликула, стенка которого разрушается, и через образовавшееся отверстие яйцо выпадает в полость тела.
После овуляции начинается лютеальная фаза цикла. Клеточная масса овулировавшего фолликула под влиянием постоянно выделяющегося ЛГ, становится желтым телом беременности. Основная функция желтого тела – синтез стероидного гормона прогестерона, который необходим для подготовки матки к имплантации бластоцисты. С током крови прогестерон попадает в матку и стимулирует рост стенки матки и кровеносных сосудов. Кроме того, прогестерон ингибирует образование ФСГ, что предотвращает созревание новых фолликулов и яйцеклеток.
Если оплодотворения не происходит, желтое тело дегенерирует, секреция прогестерона снижается, ткань с поверхности матки отторгается. Если уровень сывороточного прогестерона снижается, возобновляется секреция прогестерона гипофизом и начинается новый цикл.
Если оплодотворение происходит, трофобласт начинает синтезировать новый гормон – лютеотропин, который будет поддерживать желтое тело в состоянии активности и сохранять высокий уровень сывороточного прогестерона. Таким образом, у человека происходит периодическое созревание яйцеклеток и их овуляция посредством менструального цикла, который также обеспечивает подготовку матки к имплантации бластоцисты и развитию зародыша в течение девяти месяцев.
Рассмотренные выше вопросы, касающиеся мужского и женского гаметогенезов, позволяют выделить основные особенности этих процессов (табл. 5), в результате которых формируются высокоспециализированные половые клетки, способные к оплодотворению и образованию зиготы – зародышу будущего организма.
Таблица 5
Сравнительная характеристика процессов овогенеза и сперматогенеза
Стадия гаметогенеза |
Овогенез |
Сперматогенез |
Стадия размножения |
- количество митотических делений овогоний видоспецифично и значительно ниже,чем сперматогоний; - у высших позвоночных размножение овогоний происходит в эмбриональный период развития. |
- количество митотических делений сперматогоний большое; - в результате митотических делений сперматогоний формируется синцитиальный клон, т.к. цитотомия не завершается полностью и между соседними клетками остаются цитоплазматические мостики (фузомы); - митотическое деление сперматогоний происходит в течение всего репродуктивного периода организма. |
Стадия роста |
- рост овоцита происходит в течение длительной профазы первого деления мейоза и разделяется на два этапа – период малого и большого роста; - объем овоцита увеличивается значительно за счет накопления питательных веществ; - блокада мейоза на разных его стадиях у различных организмов (кроме кишечнополостных, иглокожих). |
- рост сперматоцита первого порядка незначительный, трофические компоненты не резервируются - профаза мейоза начинается на стадии роста и продолжается на стадии созревания без перерывов. |
Стадия созревания |
- для завершения мейоза необходима активация яйцеклетки сперматозоидом; - происходит неравномерное распределение цитоплазмы в результате мейоза – образуется одна яйцеклетка со всем накопленным материалом и три маленьких редукционных тельца.
|
образуются четыре гаплоидные одинакового размера сперматиды, которые не делятся. |
Стадия формирования |
отсутствует |
процесс дифференцировки сперматиды в сперматозоид. |
