
Таблица№1: Характеристика элементов 3А группы.
|
B |
Al |
Ga |
In |
Tl |
Порядковый номер |
5 |
13 |
31 |
49 |
81 |
Атомный вес |
10,82 |
26,98 |
69,72 |
114,82 |
204,39 |
Удельный вес |
2,34 |
2,70 |
5,9 |
7,31 |
11,83 |
Цвет |
желтовато-коричневый |
Серебристый |
Серебристо-белый |
Серебристо-белый |
Серебристо-белый |
Электронная конфигурация |
[Не]2s22p1 |
[Ne]3s23p1 |
[Ar]3d104s24p1 |
[Kr]4d105s25p1 |
[Xe]4f145d16s26p1 |
|||||||
Возможные валентные состояния |
I II III |
I II III |
I II III |
I II III |
I III |
|||||||
История открытия |
Ж.Л.Гей-Люссаком и Л.Ж.Тенаром в 1808г. и Гемфри Дэви |
Хансом Кристианом Эрстедом в 1825 г. |
Полем-Эмилем Лекок де Буабодраном в 1875 г. |
Ф.Райхом и Г.Рихтером в 1863 г. |
У.Круксом в 1861 г., выделен К.А.Лэми в 1862 г. |
|||||||
R, нм |
0,023 (Э3+) 0,831 (атом.) 0,088 (ковал.) 0,208 (Ван-дер-Ваальсов) |
0,057 (Э3+) 0,143 (атом.) 0,125 (ковал.) 0,205 (Ван-дер-Ваальсов) |
0,062 (Э3+) 0,113 (Э+) 0,122 (атом.) 0,125 (ковал.) |
0,092 (Э3+) 0,132 (Э+) 0,163 (атом.) 0,150 (ковал.) |
0,105 (Э3+) 0,149 (Э+) 0,170 (атом.) 0,155 (ковал.)
|
|||||||
Энергия ионизации,I1: Э→Э++ ē, эВ, I2: Э+→Э2++ ē, эВ, I3: Э2+→Э3++ ē, эВ |
8,298
25,155
37,930 |
5,986
18,828
28,447 |
5,998
20,574
30,170 |
5,786
18,869
28,03 |
6,11
20,428
29,83 |
|||||||
E°(Э3+/Э), B |
|
-1,67 |
-0,65 |
-0,343 |
0,71 |
|||||||
Потенциал ионизации, Эв |
8,298 |
5,984 |
5,999 |
5,786 |
6,107 |
|||||||
Сродство к электрону, эВ |
-0,30 |
-0,46 |
-0,39 |
-0,72 |
-0,50 |
|||||||
Э.О., эВ |
2,04 (по Полингу) 2,01 (по Оллреду) 4,29 (абсолютная) |
1,61 (по Полингу) 1,47 (по Оллреду) 3,23 (абсолютная) |
1,81 (по Полингу) 1,82 (по Оллреду) 3,2 (абсолютная) |
1,78 (по Полингу) 1,49 (по Оллреду) 3,1 (абсолютная) |
1,62 (TlI) 2,04 (TlIII) (по Полингу) 1,44 (по Оллреду) 3,2 (абсолютная) |
|||||||
Стабильные изотопы |
10В (19,57 %) и 11В (80,43%) |
27Al |
69Ga(61,2%) и 71Ga(38,8%) |
113In(4, 33%)и 115In(95,67%) |
205Tl(80,5%) И 203Tl (29,5%) |
|||||||
Поперечное сечение захвата тепловых нейтронов, м2 |
10В 3*10-25, 11В 4*10-32 |
215* 10-25 |
2,1*10-28 и 5,1* 10-28 |
190 барн на атом |
|
|||||||
Таблица №1.1: Распространенность элементов 3А группы в природе.
|
B |
Al |
Ga |
In |
Tl |
Изотопный состав |
10В (19,57 %) и 11В (80,43%) |
27Al |
69Ga(61,2%) и 71Ga(38,8%) |
113In(4, 33%)и 115In(95,67%) |
205Tl(80,5%) И 203Tl (29,5%) |
Место по распространению |
28 |
3 |
|
|
|
Содержание в земной коре, % |
6∙10-4 |
6,6 |
4∙10-4 |
1,5∙10-6 |
3∙10-6 |
Важнейшие природные соединения |
Na2B4O7 ∙ 10H2O – бура, Na2B4O7 ∙ 4H2O – кератит, H3BO3 – сассолин. |
Al2O3 ∙nH2O – боксит, Al2O3 – корунд, обнаруж. в виде [AlO(OH)] – бемита и [Al(OH)3] – гиббсита. |
Извлекается как побочный продукт при очистке цинка и меди. |
В виде примеси в сульфидной цинковой руде и галените PbS |
В виде включений в поташе, полевом шпате, поллуците; побочный продукт плавки цинка и свинца. |
Таблица №1.2: Применение
B |
Al |
Ga |
In |
Tl |
бор находит применение в виде добавки при получении коррозионно-устойчивых и жаропрочных сплавов. Поверхностное насыщение стальных деталей бором (борирование) повышает их механические и антикоррозийные свойства. Карбиды бора (В4С и В13С2) обладают высокой твердостью, это — хорошие абразивные материалы. Ранее их широко использовали для изготовления сверл, применяемых зубными врачами (отсюда название бормашина). Бор (в виде волокон) служит упрочняющим веществом многих композиционных материалов. Сам бор и его соединения — нитрид BN и другие — используются как полупроводниковые материалы и диэлектрики. Газообразный BF используют в счетчиках тепловых нейтронов. Бор (его нуклид 10В) характеризуется высоким эффективным сечением захвата тепловых нейтронов (3·10–25 м2) Важно, что при этой ядерной реакции возникают только стабильные ядра. Поэтому чистый бор и, особенно, его сплавы применяют в виде поглощающих нейтроны материалов при изготовлении регулирующих стержней для ядерных реакторов, замедляющих или прекращающих реакции деления. Около 50% природных и искусственных соединений бора используют при производстве стекол (так называемые боросиликатные стекла), около 30% — при производстве моющих средств. Наконец, примерно 4-5% соединений бора расходуется при производстве эмалей, глазурей, металлургических флюсов. В медицине бура и борная кислота (в виде водно-спиртовых растворов) находят применение как антисептические средства. В быту буру или борную кислоту используют для уничтожения бытовых насекомых, в частности, тараканов (бура, попадая в органы пищеварения таракана, кристаллизуется, и образовавшиеся острые игольчатые кристаллы разрушают ткани этих органов). |
по масштабам применения алюминий и его сплавы занимают второе место после железа (Fe) и его сплавов. Широкое применение алюминия в различных областях техники и быта связано с совокупностью его физических, механических и химических свойств: малой плотностью, коррозионной стойкостью в атмосферном воздухе, высокой тепло- и электропроводностью, пластичностью и сравнительно высокой прочностью. Алюминий легко обрабатывается различными способами — ковкой, штамповкой, прокаткой и др. Чистый алюминий применяют для изготовления проволоки (электропроводность алюминия составляет 65,5% от электропроводности меди, но алюминий более чем в три раза легче меди, поэтому алюминий часто заменяет медь в электротехнике) и фольги, используемой как упаковочный материал. Основная же часть выплавляемого алюминия расходуется на получение различных сплавов. Сплавы алюминия отличаются малой плотностью, повышенной (по сравнению с чистым алюминием) коррозионной стойкостью и высокими технологическими свойствами: высокой тепло- и электропроводностью, жаропрочностью, прочностью и пластичностью. На поверхности сплавов алюминия легко наносятся защитные и декоративные покрытия. Разнообразие свойств алюминиевых сплавов обусловлено введением в алюминий различных добавок, образующих с ним твердые растворы или интерметаллические соединения. Основную массу алюминия используют для получения легких сплавов — дуралюмина (94% — алюминий, 4% медь (Cu), по 0,5% магний (Mg), марганец (Mn), железо (Fe) и кремний (Si)), силумина (85-90% — алюминий, 10-14% кремний (Si), 0,1% натрий (Na)) и др. В металлургии алюминий используется не только как основа для сплавов, но и как одна из широко применяемых легирующих добавок в сплавах на основе меди (Cu), магния (Mg), железа (Fe), никеля (Ni) и др. Сплавы алюминия находят широкое применение в быту, в строительстве и архитектуре, в автомобилестроении, в судостроении, авиационной и космической технике. В частности, из алюминиевого сплава был изготовлен первый искусственный спутник Земли. Сплав алюминия и циркония (Zr) — циркалой — широко применяют в ядерном реакторостроении. Алюминий применяют в производстве взрывчатых веществ. Особо следует отметить окрашенные пленки из оксида алюминия на поверхности металлического алюминия, получаемые электрохимическим путем. Покрытый такими пленками металлический алюминий называют анодированным алюминием. Из анодированного алюминия, по внешнему виду напоминающему золото (Au), изготовляют различную бижутерию. При обращении с алюминием в быту нужно иметь в виду, что нагревать и хранить в алюминиевой посуде можно только нейтральные (по кислотности) жидкости (например, кипятить воду). Если, например, в алюминиевой посуде варить кислые щи, то алюминий переходит в пищу и она приобретает неприятный «металлический» привкус. Поскольку в быту оксидную пленку очень легко повредить, то использование алюминиевой посуды все-таки нежелательно. |
применяют в основном (97%) в производстве полупроводниковых материалов (GaAs, GaSb, GaP, GaN |
компонент легкоплавких сплавов и полупроводниковых материалов. Арсенид, антимонид и фосфид индия - полупроводниковые материалы. |
компонент сплавов, главным образом с оловом (Sn) и свинцом (Pb) (кислотоупорные, подшипниковые и др.). Амальгама талия — жидкость для низкотемпературных термометров. Соединения талия (ТlCl, ТlBr, TlI) — оптические материалы для инфракрасной техники. |
Таблица №1.3: Биологическая роль элементов 3А группы
B |
Al |
Ga |
In |
Tl |
бор — важный микроэлемент, необходимый для нормальной жизнедеятельности растений. Недостаток бора останавливает их развитие, вызывает у культурных растений различные болезни. В основе этого лежат нарушения окислительных и энергетических процессов в тканях, снижение биосинтеза необходимых веществ. При дефиците бора в почве в сельском хозяйстве применяют борные микроудобрения (борная кислота, бура и другие), повышающие урожай, улучшающие качество продукции и предотвращающие ряд заболеваний растений. Роль бора в животном организме не выяснена. В мышечной ткани человека содержится (0,33-1)·10–4 % бора, в костной ткани — (1,1-3,3)·10–4 %, в крови — 0,13 мг/л. Ежедневно с пищей человек получает 1-3 мг бора. Токсичная доза — 4 г. |
в организм человека алюминий ежедневно поступает с пищей (около 2-3 мг), но его биологическая роль не установлена. В среднем в организме человека (70 кг) в костях, мышцах содержится около 60 мг алюминия. |
Галлий жизненно важен для растений. Биологическая роль галлия для человека не расшифрована.
В периодической системе галлий, наряду с германием, находятся в окружении жизненнонеобходимых биоэлементов, таких как хром, марганец, железо, кобальт, медь, цинк, селен. Этот факт свидетельствует о необходимости более пристального изучения эссенциальности галлия для человека. Галлий не оказывает влияния на резорбцию костной ткани, стимулированную витамином D; но предупреждает резорбцию, связанную с метаболизмом паратгормона, тироксина и интерлейкина-1-ß. |
О биологической роли индия почти нет сведений, известно лишь, что индий в следовых количествах есть в зубной ткани, и что в больных зубах (кариозных) его концентрация значительно ниже, чем в здоровых. Сведения о токсикологии индия противоречивы, но, скорее всего, при введении в желудок и внутривенно индий малотоксичен. Пыль индия вредна. ПДК индия в воздухе 0,1 мг/м3 (США) и 4 мг/м3 (Россия). |
Таллий обнаружен в растительных и животных организмах. Из животных больше всего таллия содержат медузы, актинии, морские звезды и другие обитатели морей. Некоторые растения аккумулируют таллий в процессе жизнедеятельности. Таллий был обнаружен в свекле, произраставшей на почве, в которой самыми тонкими аналитическими методами не удавалось обнаружить элемент таллий. Позже было установлено, что даже при минимальной концентрации таллия в почве свекла способна концентрировать и накапливать его.
Таллий обладает выраженной токсичностью, которая обусловлена нарушением ионного баланса главных катионов организма – Na+ и K+ . Ион Tl+ склонен образовывать прочные соединения с серосодержащими лигандами и таким образом подавлять активность ферментов, содержащих тиогруппы. Поскольку ионные радиусы K+ и Tl+ близки, они обладают сходными свойствами и способны замещать друг друга в ферментах. Катион Tl+ обладает большей по сравнению с К+ способностью проникать через клеточную мембрану внутрь клетки. При этом скорость проникновения Tl+ в 100 раз выше, чем у щелочных металлов. Это вызывает резкое смещение равновесия Na/K , что приводит к функциональным нарушениям нервной системы. Кроме того, таллий нарушает функционирование различных ферментных систем, ингибирует их, препятствуя тем самым синтезу белков. Именно тот факт, что таллий является изоморфным «микроаналогом» К+, свидетельствует о том, что токсичность его соединений для человека существенно выше, чем у свинца и ртути. |
Таблица №2: Характеристика простого вещества элементов 3А группы.
|
B |
Al |
Ga |
In |
Tl |
Агрегатное состояние |
Бесцветное, серое или красное кристаллическое вещество либо темное аморфное вещество |
Серебристо – белый легкий металл |
Светло-серый металл с синеватым оттенком |
Серебристо-белый металл |
Белый металл с голубоватом оттенком |
Структура Решетки |
Ромбо- эдри- чес- кая |
ГЦК |
α-орторомб. β-ромбич. γ-ромбич.
|
Гранецентри- рованнаятетрагонал. |
α-гексагонал. β-кубическая γ-ГЦК
|
Длина связи, нм |
0,1590 |
0,2446 |
0,244 |
|
|
Энергия связи, эВ/ат |
5,81 |
3,31 |
2,78 |
2,60 |
1,87 |
Плотность г/см3 |
2,34 |
2,69 |
5,91 |
7,31 |
11,85 |
Температура плавления, К |
2300 |
660,52 |
29,93 |
156,32 |
303,7 |
Температура кипения, К |
3658 |
2467 |
2403 |
2080 |
1457 |
Молярная теплоемкость, Дж/(К * моль) |
11,09 |
24,35 |
26,07 |
26,7 |
26,3 |
Теплопровод-ность, Вт/(м*К) |
27,4 |
237 |
28,1 |
81,8 |
46,1 |
Молярный объем, см3/моль |
4,6 |
10,0 |
11,8 |
15,7 |
17,2 |
Теплота плавления, кДж/моль |
23,60 |
10,75 |
5,59 |
3,24 |
4,31 |
Теплота испарения, кДж/моль |
504,5 |
284,1 |
270,3 |
225,1 |
162,4 |
Температурный коэффициент линейного расширения, К-1 |
5∙10-6 |
23,03∙10-6 |
11,5∙10-6 (вдоль оси a) 31,5∙10-6 (b) 16,5∙10-6 (c) |
33∙10-6 |
33∙10-6 |
Основной минерал |
Na2B4O7 ∙ 10H2O – бура, Na2B4O7 ∙ 4H2O – кератит, H3BO3 – сассолин. |
Al2O3 ∙nH2O – боксит, Al2O3 – корунд, обнаруж. в виде [AlO(OH)] – бемита и [Al(OH)3] – гиббсита. |
Извлекается как побочный продукт при очистке цинка и меди. |
В виде примеси в сульфидной цинковой руде и галените PbS |
В виде включений в поташе, полевом шпате, поллуците; побочный продукт плавки цинка и свинца. |
Содержание в земной коре, % |
6∙10-4 |
6,6 |
4∙10-4 |
1,5∙10-6 |
3∙10-6 |
Энергия атомизации, кДж/моль |
560 |
330 |
286 |
243 |
182 |
Энтальпия плавления, кДж/моль |
50,2 |
10,7 |
5,6 |
3,3 |
4,2 |
Таблица №2.1: Химические свойства простых веществ 3А группы
B |
Al |
Ga |
In |
Tl |
Химически Бор при обычных условиях довольно инертен (взаимодействует активно лишь с фтором), причем кристаллический Бор менее активен, чем аморфный. С повышением температуры активность Бора возрастает и он соединяется с кислородом, серой, галогенами. При нагревании на воздухе до 700°С Бор горит красноватым пламенем, образуя борный ангидрид B2O3 - бесцветную стекловидную массу. При нагревании выше 900 °С Бор с азотом образует нитрид бора BN, при нагревании с углем -карбид бора B4C3, с металлами - бориды. С водородом Бор заметно не реагирует; его гидриды (бороводороды) получают косвенным путем. При температуре красного каления Бор взаимодействует с водяным паром: 2B + 3Н2О = B2O3 + 3H2. В кислотах Бор при обычной температуре не растворяется, кроме концентрированной азотной кислоты, которая окисляет его до борной кислоты H3BO3. Медленно растворяется в концентрированных растворах щелочей с образованием боратов. |
Внешняя электронная оболочка атома Алюминия состоит из 3 электронов и имеет строение 3s23р1. В обычных условиях Алюминий в соединениях 3-валентен, но при высоких температурах может быть одновалентным, образуя так называемых субсоединения. Субгалогениды Алюминия, AlF и АlСl, устойчивые лишь в газообразном состоянии, в вакууме или в инертной атмосфере, при понижении температуры распадаются (диспропорционируют) на чистый Аl и AlF3 или АlСl3 и поэтому могут быть использованы для получения сверхчистого Алюминия. При накаливании мелкоизмельченный или порошкообразный Алюминий энергично сгорает на воздухе. Сжиганием Алюминия в токе кислорода достигается температура выше 3000°С. Свойством Алюминия активно взаимодействовать с кислородом пользуются для восстановления металлов из их оксидов (Алюминотермия). При темно-красном калении фтор энергично взаимодействует с Алюминием, образуя AlF3. Хлор и жидкий бром реагируют с Алюминием при комнатной температуре, иод - при нагревании. При высокой температуре Алюминий соединяется с азотом, углеродом и серой, образуя соответственно нитрид AlN, карбид Al4C3 и сульфид Al2S3. С водородом Алюминий не взаимодействует; гидрид Алюминия (AlН3)X получен косвенным путем. Большой интерес представляют двойные гидриды Алюминия и элементов I и II групп периодической системы состава МеНn·nAlH3, так называемые алюмогидриды. Алюминий легко растворяется в щелочах, выделяя водород и образуя алюминаты. Большинство солей Алюминия хорошо растворимо в воде. Растворы солей Алюминия вследствие гидролиза показывают кислую реакцию. |
На воздухе при обычной температуре Галлий стоек. Выше 260° С в сухом кислороде наблюдается медленное окисление (пленка оксида защищает металл). В серной и соляной кислотах Галлий растворяется медленно, в плавиковой - быстро, в азотной кислоте на холоду Галлий устойчив. В горячих растворах щелочей Галлий медленно растворяется. Хлор и бром реагируют с Галлием на холоду, иод - при нагревании. Расплавленный Галлий при температурах выше 300° С взаимодействует со всеми конструкционными металлами и сплавами. |
В соответствии с электронной конфигурацией атома 4d105s25p1 Индий в соединениях проявляет валентность 1, 2 и 3 (преимущественно). На воздухе в твердом компактном состоянии Индий стоек, но окисляется при высоких температурах, а выше 800 °C горит фиолетово-синим пламенем, давая оксид In2O3 - желтые кристаллы, хорошо растворимые в кислотах. При нагревании Индий легко соединяется с галогенами, образуя растворимые галогениды InCl3, InBr3, InI3. Нагреванием Индия в токе HCl получают хлорид InCl2, а при пропускании паров InCl2 над нагретым In образуется InCl. С серой Индий образует сульфиды In2S3, InS; они дают соединения InS·In2S3 и 3InS·In2S3. В воде в присутствии окислителей Индий медленно корродирует с поверхности: 4In + 3O2+6H2O = 4In(ОН)3. В кислотах Индий растворим, его нормальный электродный потенциал равен -0,34 в, в щелочах практически не растворяется. |
Конфигурация внешней электронной оболочки атома Tl 6s26р1; в соединениях имеет степень окисления +1 [Tl (I)] и +3 [Tl (III)]. Таллий взаимодействует с кислородом и галогенами уже при комнатной температуре, с серой и фосфором при нагревании. Хорошо растворяется в азотной, хуже в серной кислотах, не растворяется в галогенводородных, муравьиной, щавелевой и уксусной кислотах. Не взаимодействует с растворами щелочей; свежеперегнанная вода, не содержащая кислорода, не действует на Таллий. |
Таблица №3.1: Характеристика высших оксидов
|
B2O3 |
Al2O3 |
Ga2O3 |
In2O3 |
Tl2O3 |
Описание |
Бесцветное стеклообразное или кристаллическое вещество горьковатого вкуса. |
Бесцветные кристаллы |
Белые кристаллы |
Желтые кристаллы |
Темно-коричневые кристаллы |
решетка |
Слоистая |
ромбоэдрическая |
моноклинная |
Кубическая объемно-центрированная |
Кубическая |
Расстояние между слоями, нм |
0,185 |
|
|
|
|
Плотность, г/см3 |
1,812 |
3,99 |
6,48 |
7,18 |
10 |
∆ Н обр, кДж/моль |
-1254,9 |
-1675,6 |
-1089 |
-925,9 |
-390,4 |
Длина связи Me-O, нм |
0,145 |
|
|
|
|
Т пл, оС |
325-400 |
2044 |
1740 |
1910 |
717 |
Т кип, оС |
2250 |
3530 |
3300 |
|
1169 |
Твердость |
Около 4 (по Моосу) |
9 (по Моосу) |
6 |
|
|
Получение |
Нагреванием на воздухе B до 700оС или обезвоживанием H3BO3 при 235оС |
Получают из бокситов, нефелинов, каолина, алунитовалюминатным или хлоридным методом. Сырьё в производстве алюминия, катализатор, адсорбент, огнеупорный и абразивный материал. |
Прокаливанием Ga(NO3)3 или Ga(OH)3 при 200-250оС, затем в течение 12 часов при 600оС. Получают нагреванием металлического галлия на воздухе при 260 °C или в атмосфере кислорода, или прокаливанием нитрата или сульфата галлия |
Получают нагреванием металлического индия выше температуры плавления на воздухе или в кислороде, или прокаливанием гидроксида, нитрата, сульфата или карбоната индия (III) |
Получают нагреванием металлического таллия на воздухе или в атмосфере кислорода, а также прокаливанием гидроксида или нитрата таллия (III) |
Сро , Дж/(моль*К) |
62,76 |
79,033 |
92 |
92 |
|
∆ Н пл, кДж/моль |
24,56 |
111,4 |
519 |
84 |
|
∆ Н возг, кДж/моль |
433 |
|
574 |
272 |
|
∆ S 298 , Дж/(моль*К) |
53,97 |
50,92 |
85,1 |
107,9 |
148,1 |
∆ Gобр, кДж/моль |
-1178 |
|
-998,2 |
-831,9 |
-321,4 |
∆ Н 298, перехода кристаллического в стеклообразный, кДж/моль |
18,6 |
|
|
|
|
Свойства |
Термически стоек. Не восстанавливается углем даже при 1000оС. В присутствии угля при нагревании с галогенами образует галогениды, с N2 – нитрид, энергично взаимодействует с водой давая H3BO3 . B2O3 – промежуточный продукт в производстве B, он входит в состав спец. стекол, керамики, эмали. |
бесцветные нерастворимые в воде кристаллы. Химические свойства — амфотерный оксид. Практически не растворим в кислотах. Растворяется в горячих растворах и расплавах щелочей. Является полупроводником n-типа.
|
Не растворим в воде и органических растворителях. С минеральными кислотами образует соли Ga, с растворами щелочей галлаты. |
Не растворяется в воде, но растворяется в кислотах. Диссоциирует с образованием In2O. |
Выше 500 °C на воздухе Tl2O3 переходит в Tl2O. |
Растворимость в воде |
Не растворим |
Не растворим |
Не растворим |
Не растворим |
Не растворим |
Длина связи Э-О, А |
|
|
1,83 и 2,00 |
2,18 |
2,26 |
Таблица№3.2: Характеристика низших оксидов
|
B2O |
Al2O |
Ga2O |
In2O |
Tl2O |
Агрегатное состояние |
|
Газ |
Темно-коричневое, серое или черное вещество |
Черные кристаллы |
Черный порошок |
Т пл, оС |
93 |
250 |
Около 650 |
650 |
300 |
Ткип, оС |
366 |
|
Около 750 |
700(возг) |
1080 |
Плотность, г/см3 |
|
3,9-4 |
4,77(20оС) |
6,99 |
9,52 |
Сро , Дж/(моль*К) |
39,74 |
51,267 |
48,2 |
49,789 |
51,044 |
∆ Н обр, кДж/моль |
271,8( для газа) |
-144,143 |
-356 |
-55,350 |
-177 |
∆ S 298 , Дж/(моль*К) |
230,956 |
256,946 |
284 |
298,319 |
134,31 |
Свойства |
|
|
Устойчив в сухом воздухе при 20оС в отсутствие О2 и паров H2O до 600оС. Сильный восстановитель, легко окисляется при нагревании. Медленно реагирует с разбавленными кислотами, энергично с концентрированными. |
Хорошо растворяется в соляной кислоте |
Растворяется в разбавленных кислотах. Получают восстановлением In2O3 водородом |
Тип решетки |
Слоистая структура типа графита |
|
|
|
|
Таблица№6: Характеристика борных кислот
|
H3BO3 |
HBO2 |
Агрегатное состояние |
Бесцветные кристаллы |
Бесцветные кристаллы |
Тип решетки |
Решетка слоистая, триклинная |
Кубическая решетка(наиболее устойчивая) |
Параметры решетки, нм |
а=в=0,704 с = 0,656 α = 101,10оС β = 92,30оС z = 4 пространственная группа Р1, расстояние между слоями 0,318 нм |
а = 0,887 z = 24 |
Плотность, г/см3 |
1,46 |
2,486 |
Температура плавления, оС |
170,9 (с разл.) |
236 (c разл.) |
Сро , Дж/(моль*К) |
81,3 |
42,258 |
∆ Н пл, кДж/моль |
22,34 |
|
∆ Н обр, кДж/моль |
-1094,9 |
-804,6 |
∆ S 298 , Дж/(моль*К) |
88,74 |
240,161 |
∆ Н возг, кДж/моль |
63,97 |
|
∆ Н исп, кДж/моль |
98,1 |
|
Растворимость в воде |
2,60% по массе при 0оС, 4,80% при 20оС, 10,35% при 50оС, 28,7% при 100оС |
|
Растворимость в метаноле, % |
21,0 |
|
Растворимость в этаноле, % |
11,2 |
|
Растворимость в ацетоне, % |
0,65 |
|
Ка1 |
5,8*10-10 |
|
Ка2 |
4*10-13 |
|
Ка3 |
4*10-14 |
|
Длина связи |
|
1,78 |
Таблица№7: Характеристика гидроксида алюминия
|
Гиббсит |
байерит |
Норд- страндит |
бемит |
Диаспор |
|||||
Кристаллическая решетка |
моноклинная |
триклинная |
моноклинная |
триклинная |
орторомбическая |
орторомбическая |
||||
Параметры решетки, а, нм b, нм с, нм α β γ |
0,864 0,507 0,972
94,34 |
1,733 1,008 0,973 94,17 92,13 90,00 |
0,501 0,868 0,476
90,27 |
0,889 0,500 1,020 92,56 110,23 90,32 |
0,297 1,223 0,370 |
0,440 0,943 0,284 |
||||
Число формульных единиц в ячейке |
4 |
16 |
2 |
4 |
2 |
2 |
||||
Плотность, г/см3 |
2,35-2,42 |
|
2,53 |
2,44 |
3,01-3,06 |
3,44 |
||||
Твердость по Моосу |
2,5-3,5 |
|
|
3 |
3,5-4,0 |
6,5-7,0 |
||||
Показатель преломления обыкновенного луча |
1,567 |
|
1,567 |
1,580 |
1,640-1,646 |
1,702 |
||||
Показатель преломления необыкновенного луча |
1,587 |
|
1,581 |
1,613 |
1,654-1,661 |
1,750 |
||||
Таблица №8: Характеристика гидроксидов подгруппы галлия
Элемент |
Гидроксид |
Ga |
Ga(OH)3. Из водных р-ров солей галлия (при рН 3,0-4,1) и галлатов (при рН 9,7-6,4) осаждается гидроксид Ga(OH)3*xH2O. Кислотные св-ваGa(OH)3 (или ортогаллиевой к-ты H3GaO3) выражены сильнее основных; он является более сильной к-той, чем А1(ОН)3, поэтому р-ры солей к-т галлия-галлатов устойчивее р-ров алюминатов. При нагр. гидроксида до ~ 400 °С образуется GaOOH (или метагаллиевая к-та HGaO2), к-рый выше 550 °С переходит в Ga2O3. Выпадает в виде желеобразного осадка при обработке растворов солей трехвалентного галлия гидроксидами и карбонатами щелочных металлов (pH 9,7). Растворяется в концентрированном аммиаке и концентрированном растворе карбоната аммония, а при кипячении осаждается. Нагреванием гидроксид галлия можно перевести в GaOOH, затем в Ga2O3.H2O, и, наконец, в Ga2O3. Можно получить гидролизом солей трехвалентного галлия. |
In |
In(OH)3. Желеобразный осадок. Мало растворим в воде и аммиаке. Растворяется в кислотах и избытке щелочей. Получают обработкой солей индия (III) щелочами или гидролитическим осаждением. Прокаливая In(ОН)3, получают In2O3. |
Tl |
TlOH. Желтые кристаллы. Абсорбирует диоксид углерода. Растворяется в воде и спирте. Водный раствор имеет сильно щелочной характер, действует на стекло и фарфор. Молярная электропроводность при бесконечном разведении при 25оС равна 273 Cм.см2/моль. Получают растворением оксида таллия (I) в воде или взаимодействием Tl2SO4 с гидроксидом бария. Tl(OH)3. Красновато-коричневый осадок, мало растворимый в воде и щелочах. Растворяется в разбавленных кислотах. При кипячении водной суспензии образуется Тl2О3. Получают действием щелочей на соли таллия (III). |
Таблица №9: Характеристика гидридов бора
|
B2H6 |
B4H10 |
B5H9 |
B5H11 |
B6H10 |
B6H12 |
B10H14 |
B10H16 |
Температура плавления, оС |
-166 |
-120 |
-47,6 |
-122 |
-65 |
-82 |
99 |
81 |
Температура кипения, оС |
-92,5 |
18 |
48,6 |
63 |
108 |
80-90 |
213 |
|
∆ Н обр, кДж/моль |
36,6 |
57,68 |
59,92 |
66,88 |
71,06 |
110,77 |
-66,88 108,68 (для газа) |
145,5 (для газа) |
∆ Н сгор, кДж/моль |
-72,4 |
-70,4 |
-69,2 |
-69,2 |
-66,9 |
|
-66,3 |
|
Плотность, г/см3, Жидкого твердого |
0,447(-112оС) 0,557(-183оС) |
0,56(-35оС) 0,59(-70оС) |
0,65(0оС) 0,63(-46,7оС |
|
0,69(0оС) жидкого |
|
0,78(100оС) 0,94(20оС ) |
0,87(20оС) твердого |
Агрегатное состояние |
газ |
газ |
жидкость |
жидкость |
жидкость |
жидкость |
кристаллы |
кристаллы |
Предельно допустимая концентрация,мг/м3 |
0,1 |
|
0,01 |
0,01 |
|
|
|
0,3 |
Таблица №10: Характеристика гидридов 3А группы
Элемент |
Гидрид |
Al |
(AlH3)n. Белое, аморфное, нелетучее вещество. Устойчиво в вакууме (до 100оC). Под действием электрического разряда на триметилалюминий в большом избытке водорода образуется смесь Al2(CH3)3H3 и (AlH3)n. При дальнейшей обработке Al2(CH3)3H3 также получают (AlH3)n. |
Ga |
Ga2H6. Летучая жидкость, которая плавится при -21,4оC, кипит при 139оС (температура определена экстраполированием). В эфирной суспензии с гидратом лития или таллия образует соединения LiGaH4 и TlGaH4. Образуется в результате обработки тетраметилдигалланатриэтиламином. |
In |
(InH3)n. Белое вещество, которое разлагается на элементы выше 80оС. Получают при комнатной температуре смешиванием треххлористого индия с гидридом лития в эфирном растворе. Известен двуххлористыйиндийалюминатIn[AlH4]Cl2. Смешивая треххлористый индий с эфирным раствором LiAlH4 (-70оС), получают гидрид индия и соединение состава In(AlH4)3. |
Tl |
Не образует с водородом простого соединения. Гидрид таллия получается в форме двойных соединений Tl(GaH4)3 и TlCl(AlH4)2. |
|
B2H6 |
(AlH3)n |
Ga2H6 |
InH3 |
TlH3 |
|
Агрегатное состояник |
|
твердое |
жидкость |
|
|
|
Тип решетки |
|
гексагональную сингонию, ромбической сингонии, |
|
|
|
|
Длина связи |
|
|
152 |
|
|
|
Энергия связи |
380,9 |
|
|
|
|
|
Т пл |
-166 |
|
-21 |
139 |
|
|
Т кип |
-92,5 |
|
139 |
412 |
|
|
∆Н298кДж/моль |
38,5
|
-11,422
|
|
|
|
|
∆G |
89,6 |
46,422 |
|
|
|
|
∆SДж/мольК |
232 |
30,047 |
|
|
|
|
Ср Дж/мольК |
56,9 |
40,208 |
|
|
|
|
теплопроводность |
|
|
|
|
|
|
электропроводность |
|
|
|
|
|
|
Плотность, г/см3 |
0,447 |
1,45 |
|
|
|
|
Применение |
Применяется в качестве антиоксидантов,катализаторов окисления предельных и ароматических углеводородов в спирты и фенолы, добавки к смазочным маслам. |
Гидрид алюминия находит широкое применение в органическом синтезе в качестве сильнейшего восстанавливающего агента.
В связи с тем, что гидрид алюминия представляет собой соединение с высоким содержанием водорода (10,1 %), он используется в производстве ракетных топлив и некоторых взрывчатых веществ[25], а также для систем хранения и генерации в автономных энергетических водородных установках. |
|
|
|
|
Химические свойства
1) Диборан является сильной кислотой Льюиса, вследствие чего способен образовывать комплексы с основаниями (например, с аммиаком).
Диборан
взаимодействует с водой. При этом
выделяется водород и образуется борная
кислота: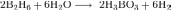
2) Соединение нестабильно: при нагревании выше 100 °C разлагается:

Бурно взаимодействует с водой:

С диэтиловым эфиром образует высокореакционный, но относительно стабильный комплекс переменного состава, который часто используется для синтетических целей:
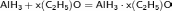
Аналогичный комплекс образуется с другими низшими алифатическими эфирами, а также с триметиламином: AlH3 • N(CH3)3. Последний взаимодействует с водой со взрывом.
Для стабилизации гидрида алюминия также можно использовать комплексы с другими аминами, например с N-метилпирролидином (NMP): AlH3 • NMP и AlH3 • (NMP)2.
Гидрид алюминия — очень сильный восстановитель. Он способен восстановить углекислый газ до метана:

Известны многочисленные реакции восстановления органических соединений с использованием гидрида алюминия (см. раздел ...).
Взаимодействует с гидридом лития, образуя алюмогидрид:

Медленно вступает в реакцию с дибораном, образуя борогидрид алюминия:

Получение
1) Существующие методы получения диборана основаны на взаимодействии галогенидов или алкоксидов бора с донорами гидрид-ионов.
В промышленности диборан получают путём восстановления BF3:

При получении диборана в лабораторных условиях восстанавливают фторид или хлорид бора:
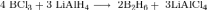
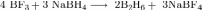
2) Используемый сегодня принципиальный метод получения чистого гидрида алюминия из гидрида лития в среде диэтилового эфира был предложен ещё в 1947 году:

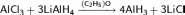
Хлорид лития выпадает в осадок до момента полимеризации AlH3 и отделяется от эфирного раствора, из которого путём дальнейшей отгонки эфира получают комплекс гидрида алюминия с диэтиловым эфиром.
Также гидрид алюминия по аналогии можно получить реакцией алюмогидрида лития с серной кислотой, хлоридом бериллия, хлоридом цинка[4], хлороводородом и алкилгалогенидами:



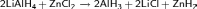

Вместо алюмогидрида лития можно использовать алюмогидрид натрия:

Для получения чистого гидрида (без примесей растворителя) эфирный комплекс подвергают нагреванию в вакууме с добавлением бензола[6] или в присутствии небольших количеств LiAlH4 или смеси LiAlH4+LiBH4[4]. При этом сперва получаются β-AlH3 и γ-AlH3 модификации, которые затем переходят в более стабильный α-AlH3[4].
Другим способом получения несольватированного эфиром гидрида алюминия, является электролиз алюмогидрида натрия в среде тетрагидрофурана.
Среди прочих методов отметим синтез с использованием гидрида магния:

Долгое время считалось, что гидрид алюминия невозможно получить прямым взаимодействием элементов, поэтому для его синтеза использовали приведённые выше косвенные методы[24]. Однако, в 1992 году группа российских учёных осуществила прямой синтез гидрида из водорода и алюминия, используя высокое давление (выше 2 ГПа) и температуру (более 800 K). Вследствие очень жёстких условий протекания реакции, в настоящий момент метод имеет лишь теоретическое значение
Таблица №11: Характеристика галогенидов бора
|
BF3 |
BCl3 |
BBr3 |
BI3 |
Температура плавления, оС |
-127 |
-107 |
-46 |
+43 |
Температура кипения, оС |
-101 |
-12,5 |
+90 |
210 Разл |
∆ Н 298, кДж/моль |
-1137 |
-427 |
-243 |
-38 |
∆ G298, кДж/моль |
-1120 |
-387 |
-238 |
-43,049 |
Длина связи B-Hal, нм |
0,129 |
0,173 |
0,187 |
0,210 |
Энергия связи B-Hal, кДж/моль |
644 |
443 |
376 |
284 |
Агрегатное состояние |
Бесцветный газ с удушливым запахом, дымящий во влажном воздухе. |
Бесцветный газ, дымящий во влажном воздухе. |
Бесцветная жидкость |
Газ |
Энергия диссоциации, эВ |
6,4 |
4,2 |
3,1 |
|
Угол FBF, оС |
120 |
|
|
|
Плотность, г/см3 |
0,00307( 20оС), твердого -1,87 (-130оС) |
1,343(11оС) |
2,65( ОоС) |
3,3(50оС) |
Сро , Дж/(моль*К) |
50,5 |
62,65 |
67,780 |
71,128 |
∆ Н пл, кДж/моль |
4,62 |
6,81 |
|
|
∆ Н обр, кДж/моль |
-1119 |
-404,5 |
|
|
∆ S 298 , Дж/(моль*К) |
254,3 |
289,35 |
228,195 |
350,200 |
∆ Н исп, кДж/моль |
17,1 |
23,86 |
|
|
Растворимость в воде |
332,1 г в 100г H2O при ОоС |
190 г в 100 г (-136,4оС) |
|
|
Способы получения |
Сплавлением тетрафторбората калия с борным ангидридом |
Хлорированием В, его сплавов при 1000 оС или раскаленной смеси В2О3 с углем. |
|
|
Молекулярная масса, а.е.м. |
67,81 |
117,17 |
250,54 |
|
Давление паров, мм.рт.ст |
10(-142оС), 100(-124оС) |
1(-92оС) 10(-68оС) 100(-33,5оС) |
|
|
Дипольный момент молекулы, Дебаях |
0(20оС) |
|
|
|
Поверхностное натяжение, мН/м |
|
16,7(20оС) |
|
|
Показатель преломления ( для D-линии натрия) |
|
1,428(12оС) |
1,553(20оС) |
|
Валентно-силовая константа, дин/см 10-5 |
6,69 |
3,30 |
2,50 |
|
Межатомное расстояние, А |
1,30 |
1,73 |
1,87 |
|
Таблица № 12: Характеристика галогенидов алюминия
|
AlF3 |
AlCl3 |
AlBr3 |
AlI3 |
Температура плавления, оС |
1290 |
193 |
97,5 |
179,5 |
Температура кипения, оС |
1291 (возг.) |
180 (возг.) |
255 |
381 |
Плотность, г/см3 |
3,1 |
2,5 |
3,2 |
4,0 |
∆ Н 298, кДж/моль |
-1510 |
-705 |
-513 |
-308 |
∆ G298, кДж/моль |
-1432 |
-629 |
-491 |
-304 |
∆ S 298 , кДж/моль |
66 |
109 |
180 |
190 |
Длина связи Al - Hal |
1,63 |
2,06 |
2,21 |
2,44 |
Энергия связи Al – Hal, кДж/моль |
690 |
460 |
380 |
319 |
К.Ч. |
6 |
6 |
4 |
4 |
Агрегатное состояние |
Бесцветные кристаллы |
Бесцветные дымящие на воздухе кристаллы |
Бесцветное кристаллическое вещество |
Бесцветное вещество |
Тип решетки |
Тригональная |
моноклинная |
моноклинная |
моноклинная |
∆ Н возг, кДж/моль |
272 |
115,7 |
-513 |
-308 |
Таблица № 13: Характеристика галогенидов галлия
|
GaF3 |
GaCl3 |
GaBr3 |
GaI3 |
Температура плавления, оС |
Выше 1000 |
77,8 |
122,5 |
213 |
Температура кипения, оС |
Ок 950 ( возг) |
200,5 |
278 |
345 |
Плотность, г/см3 |
4,47 |
2,47 |
3,74 |
4,15 |
Сро , Дж/(моль*К) |
78,7 |
87,5 |
|
|
∆ Н пл, кДж/моль |
|
11,5 |
11,7 |
16,5 |
∆ Н исп, кДж/моль |
188( возг.) |
23,4 |
29,9 |
68,7 |
∆ Н обр, кДж/моль |
-1070 |
-525,4 |
-387 |
-239 |
∆ S 298 , Дж/(моль*К) |
117 |
170 |
160 |
204 |
Агрегатное состояние |
Бесцветные кристаллы |
Бесцветные кристаллы |
Белые кристаллы |
Желтые кристаллы |
Тип решетки |
гексагональная |
триклинная |
|
ромбическая |
Параметры решетки |
а=0,694 в=0,684 с = 0,682 α = 119,5оС β = 90,8оС z = 1 пространственная группа Р1,
|
|
|
|
Свойства |
Хорошо растворим в воде. Является сильн6ой кислотой Льюиса. Применяют его для получения Ga высокой чистоты и синтеза других соединений Ga, а также как катализатор полимеризации, наполнитель нейтринных ловушек. |
Не растворяется в воде. Не взаимодействует с разбавленными минеральными кислотами, разлагается растворами щелочей. |
|
По свойствам подобен GaCl3. |
Энергия связи Ga – Hal, кДж/моль |
560 |
379 |
340 |
279 |
К.Ч. |
6 |
4 |
4 |
4 |
Таблица № 14: Характеристика галогенидов индия
|
InF3 |
InCl3 |
InBr3 |
InI3 |
Температура плавления, оС |
1170 |
586 |
420 |
207 |
∆ Н 298, кДж/моль |
-1029 |
-537 |
-418 |
-247 |
∆ G298, кДж/моль |
-962 |
-460 |
-372 |
-142 |
Температура кипения, оС |
1200 |
617 |
450(возг.) |
447( разл.) |
Агрегатное состояние |
Бесцветные кристаллы |
Бесцветные гигроскопич. кристаллы. |
Светло-желтые кристаллы |
Желтые кристаллы |
Плотность, г/см3 |
4,51 |
3,45 |
4,74 |
4,72 |
Растворимость в воде, г/л. |
|
33,5( 22оС) |
|
|
Энергия связи In – Hal, кДж/моль |
555 |
374 |
333 |
270 |
К.Ч. |
6 |
6 |
6 |
4 |
Кристаллическая решетка |
гексагональная |
моноклинная |
|
моноклинная |
Таблица №15: Характеристика галогенидов таллия (I)
Соединение |
TlF |
TlCl |
TlBr |
TlI |
Цвет |
белый |
белый |
желтоватый |
Желтый или красный |
Удельный вес |
8,36 |
7,00 |
7,5 |
7,29 |
Температура плавления, оС |
327 |
430 |
456 |
440 |
Температура кипения, оС |
855 |
806 |
815 |
824 |
Межатомное расстояние в молекуле пара, А |
|
2,54 |
2,67 |
2,91 |
Растворимость моль/л, при 18оС |
Очень легко растворяется |
12,7 |
1,48 |
0,17 |
Теплота образования, ккал/моль |
77,1 |
48,5 |
41,3 |
31,2 |
Плотность, г/см3 |
8,23 |
7,00 |
7,22 |
7,29 |
Тип решетки |
NaCl |
CsCl |
CsCl |
NaCl |
Таблица №16: Характеристика галогенидов таллия (III)
|
TlF3 |
TlI3 |
Цвет |
белый |
белый |
∆ Н, кДж/моль |
573 |
359 |
Температура плавления, оС |
550 (разл.) |
155 (разл.) |
К.Ч. |
6 |
6 |
Плотность, г/см3 |
8,65 |
|
Кристаллическая решетка |
орторомбическая |
моноклинная |
Температура кипения, оС |
930 |
|
Таблица №17: Характеристика карбидов бора
|
B4C |
B13C2 |
структура |
Черные кристаллы с ромбоэдрической решеткой |
Черные кристаллы с ромбоэдрической решеткой |
Параметры решетки |
а = 0,5598 нм, с = 1,2120 нм, z = 3, пространственная группа R3m |
а = 0,5630 нм, с = 1,2190 нм, z = 3, пространственная группа R3m |
Температура плавления, оС |
2450(разл.) |
2460 |
Плотность, г/см3 |
2,52 |
2,46 |
Температурный коэффициент линейного расширения, K-1 |
4,5*10-6 (300-1100 K) |
5,5*10-6 (300-1100 K) |
Микротвердость, ГПа |
49,1 |
55,9 |
Сро , Дж/(моль*К) |
53,09 |
|
∆ Н пл, кДж/моль |
105 |
|
∆ Н обр, кДж/моль |
-62 |
|
∆ S 298 , Дж/(моль*К) |
27,11 |
|
Давление пара над твердым веществом, Па |
0,091(300 К) 8,2(2522 К) |
|
Теплопроводность, Вт/(м*К) |
121,4(300 К) 62,8( 970 К) |
|
Модуль упругости, ГПа |
450 |
|
Полупроводник |
p-типа |
n-типа |
Описание
|
Одно из наиболее устойч. Соединений. Окисляется на воздухе выше 600оС. Не раств. в воде и минеральных к-тах и их смесях, разлагается кипящими растворами щелочей. Не взаимод. с S,P,N2 до 1250ОС, реагирует с Cl2ок. 1000 ОС с образованием BCl3 и С. Получают его главным образом восстановлением B2O3 углеродом (сажей) при 1900-2150 ОС. Применяют для изготовления абразивных и шлифовальных материалов, в качестве полупроводников и диэлектриков. Он содержится в наплавочных составах для повышения стойкости металлич. пов-стей к мех. Воздействию. Карбид обогащенный изотопом 10B – поглотитель нейтронов в ядерных реакторах. |
|
|
BN |
||
α |
β |
γ |
|
цвет |
белый |
черный |
Серый |
Кристаллическая решетка |
Гексагон. |
Кубич. (типа сфалерита) |
Гексагон. (типа вырцита) |
Параметры решетки, нм |
а = 0,2504, с = 0,6661 |
а = 0,3615 |
а = 0,2550, с = 0,4230 |
Число формульных единиц в ячейке |
2 |
4 |
2 |
Пространственная группа |
P63/mmc |
F43m |
P63mc |
Плотность, г/см3 |
2,29 |
3,45 |
3,40 |
Температурный коэффициент линейного расширения, К-1 |
По оси а = 2,9*10-6, по оси с = 40,5*10-6 |
По оси а = 2,8*10-6 |
По оси а = 2,7*10-6, , по оси с = 3,7*10-6 |
Ширина запрещенной зоны, эВ |
3,7 |
6-7 |
2,1 |
Температура Дебая, К |
2000 |
1720 |
1460 |
Микротвердость, ГПа |
0,1-0,7 |
60-98 |
49-57 |
Модуль Юнга, ГПа |
34-87 |
840 |
790 |
Температура плавления,оС |
Около 3000 |
||
Сро , Дж/(моль*К) |
19,71 |
||
∆ Н пл, кДж/моль |
81 |
||
∆ Н обр, кДж/моль |
-250,5 |
||
∆ S 298 , Дж/(моль*К) |
14,81 |
||
Давление пара над твердым BN, Па |
5 при 2000 К |
||
Свойства |
Полупроводник. Устойчив в атмосфере О2 до 700оС разлагается горячими растворами щелочей с выделением NH3. Получают его главным образом взаимодействием B2O2 с NH3 около 2000оС в присутствии восстановителя ( обычно угля), а также плазмохимическим методом ( аморфный бор подают в струю азотной плазмы при 5000-6100 К). BN служит для изготовления высокоогнеупорных материалов, термостойкого волокна, как сухая смазка в подшипниках, полупроводник или диэлектрик. |
||
Таблица №19: Характеристика боратов неорганических
Соединение |
Плотность, г/см3 |
Растворимость в воде (25оС), % по массе |
Температура обезвоживания, оС |
Температура плавления безводной соли, оС |
Температура боратовой перегруппировки, оС |
Бура, Na2B4O7*10H2O |
1,71 |
2,5 |
40-400 |
742 |
|
Ашарит, Mg2B2O5* H2O |
2,72 |
0,14 |
615-660 |
1340 |
|
Гидроборацит, CaMgB6O11*6 H2O |
2,17 |
0,22 |
170-440 |
|
780 |
Калиборит, KMg2B11O19*9H2O |
2,13 |
1,6 |
100-600 |
815 |
650 |
Колеманит, Ca2B6O11*5 H2O |
2,42 |
0,26 |
150-600 |
950 |
710 |
Пандермит, Ca4B10O19*7 H2O |
2,42 |
0,18 |
120-600 |
|
Ок. 800 |
Натрия метаборат, NaBO3*4 H2O |
1,91 |
20,2 |
58-306 |
968 |
|
Калия метаборат, KBO2*4/3 H2O |
2,23 |
42,7 |
100-250 |
950 |
|
Калия пентаборат, KB5O8*4 H2O |
1,74 |
3,4 |
50-350 |
780 |
457 |
Аммония тетраборат, (NH4)2B4O7*4 H2O |
|
8,76 |
87 |
|
192(с разл.) |
Магния метаборат, Mg(BO2)2*8 H2O |
2,29 |
0,1 |
80-350 |
988 |
760 |
Кальция метаборат, Ca(BO2)2*2 H2O |
2,60 |
0,25 |
350-500 |
1154 |
700 |
Бария гексаборат, BaB6O10*4 H2O |
2,3 |
0,52 |
180-450 |
|
670 |
Свинца метаборат, Pb(BO2)2* H2O |
4,9 |
|
160 |
600 |
540 |
Таблица №20: Характеристика боратов органических
Соединение |
Температура плавления, оС |
Температура кипения, оС/мм.рт.ст. |
Триметилборат, (CH3O)3B |
-29 |
69/760 |
Триэтилборат, (C2H5O)3B |
-85 |
117/760 |
Трибутилборат, (C4H9O)3B |
|
115/15 |
Три-β-хлорэтилборат, (ClCH2CH2O)3B |
97-98 |
112/0,05 |
Трифенилборат (C6H5O)3B |
92-93 |
177-178/0,5 |
Бутокси (этилендиокси)-боран C4H9OB-OCH2-OCH2 |
|
108/35 |
Атом В в боратах находится в sp2-гибридизованном состоянии, три связи B-O лежат в одной плоскости, угол между двумя соседними связями близок к 120оС. |
||
Способы получения: Действие спиртов, фенолов, диолов на Н3BO3, B2O3, BCl3 или буру. Взаимодействие BHal3 или B2O3 с простыми или сложными эфирами, альдегидами, кетонами, силикатами, фосфатами. Окисление R3B. Термическое разложение M[B(OR)4]. |
||
Бораты гидролизуются водой до B(OH)3 и ROH, переэтерифицируются спиртами и фенолами (кроме пространственно затрудненных). |
||
Применение: Бораты могут быть использованы как антиоксиданты, катализаторы окисления парафинов в спирты( ароматич. Соединений – в фенолы), в синтезе органических и биоорганических соединений, красителей, для разделения цис- и транс-диолов, защиты гидроксильных групп ( напр. в полиолах), как фунгициды, антисептики, добавки, улучшающие некоторые свойства моторных топлив, смазочных масел, полимеров. |
||
Таблица №21: Характеристика боридов металла
Борид |
Тпл., оС |
Теплопроводность, Вт/(м*К) |
Сро , Дж/(кг*К) |
Температурный коэффициент линейного расширения, 10-6К-1 |
Р, мкОм*м |
Температурный коэффициент р, 10-3 К-1 |
Работа выхода электронов, эВ |
Микротвердость, ГПа |
TiB2 |
3225 |
64,5 |
636 |
5,2 |
0,09 |
2,0 |
3,88 |
33,7 |
ZrB2 |
3225 |
58,2 |
445 |
5,9 |
0,10 |
2,3 |
3,60 |
22,5 |
HfB2 |
3380 |
51,1 |
249 |
6,3 |
0,10 |
3,3 |
3,85 |
29,0 |
VB2 |
2745 |
42,3 |
|
7,6 |
0,23 |
2,1 |
3,95 |
28,0 |
NbB2 |
3035 |
23,9 |
417 |
8,0 |
0,26 |
1,0 |
3,65 |
26,0 |
TaB2 |
3035 |
15,9 |
289 |
8,2 |
0,33 |
1,2 |
3,66 |
26,0 |
CrB2 |
2200 |
31,8 |
696 |
10,5 |
0,30 |
1,2 |
3,36 |
21,0 |
Mo2B5 |
2200 |
26,8 |
|
8,6 |
0,26 |
3,3 |
3,95 |
23,5 |
W2B5 |
2370 |
31,8 |
|
7,8 |
0,22 |
4,3 |
2,95 |
26,6 |
CaB6 |
2230 |
23,0 |
|
6,5 |
|
1,2 |
2,86 |
27,0 |
LaB6 |
2740 |
47,7 |
572 |
6,4 |
0,08 |
2,6 |
2,66 |
28,0 |
SmB6 |
2540 |
13,8 |
439 |
6,8 |
2,60 |
10-3 |
4,40 |
25,0 |
Свойства: Взаимодействие между атомами металла и бора в боридах относительно слабое, поэтому их структуру рассматривают как две слабо связанные подрешетки. Структура низших боридов определяется металлической подрешеткой, а высших – борной. В соединениях типа М4В и М2В атомы В изолированы друг от друга, в соединениях типа МВ они образуют одинарные зигзагообразные цепи, в М3В4 – сдвоенные цепи. По мере увеличения содержания В структура боридов значительно усложняется. Так в МВ2 атомы В образуют плоские сетки, в МВ4 – гофрированные сетки и каркасы в виде октаэдрических группировок, в МВ6 – октаэдры, в МВ12 – кубооктаэдры и икосаэдры, в МВ66 – цепи икосаэдров. Гексагональная кристаллическая решетка характерна для МВ2 и МВ4, кубическая для М2В, МВ, МВ6, МВ12, МВ66, ромбическая для М4В, МВ, М3В4, М4В, МВ12. С возрастанием содержания бора в пределах бинарной системы растёт доля ковалентных связей В-В и уменьшается взаимодействие М-В, в результате чего повышаются твердость, температура плавления, теплопроводность и электрическая проводимость и уменьшается температурный коэффициент линейного расширения. Одновременно возрастает химическая стойкость. Бориды устойчивы к действию воды( кроме низших боридов Ве и Mg), соляной, фтористоводородной и карбоновых кислот. Легко разлагаются HNO3 и H2SO4 при нагревании. Взаимодействуют с расплавами щелочей, карбонатов и сульфатов щелочных металлов. |
||||||||
Способы получения: Взаимодействие металла с В с использованием внешнего нагрева ( спекание, сплавление) либо инициированием внеш. источником тепла с послед. разогревом реагентов благодаря выделению теплоты реакции. Восстановление оксида металла смесью В и С, карбидом бора или бором в вакууме. Электролиз расплавов боратов и оксидов металлов |
||||||||
|
TiB2 |
ZrB2 |
CrB2 |
LaB6 |
CaB6 |
Название |
Диборид титана |
Диборид циркония |
Диборид хрома |
Гексаборид лантана |
Гексаборид кальция |
Агрегатное состояние |
Черные кристаллы |
Серые кристаллы |
Серые кристаллы |
Фиолетово-пурпурные кристаллы |
Черные кристаллы |
Тип решетки |
Гексагональная решетка |
Гексагональная решетка |
Гексагональная решетка |
Кубическая решетка |
Кубическая решетка |
Параметры решетки, нм |
а = 0,3026, с = 0,3313 |
а = 0,1368, с = 0,3528 |
а = 0,2970, с = 0,3074 |
а = 0,4156 |
а = 0,4145 |
Своиства и применение |
Используют для изготовления испарителей для расплавов металлов и футеровки электролизеров, как компонент жаростойких сплавов, инструментальных материалов. |
Устойчив в расплавах цветных и черных металлов, металлургических шлаков. Характеризуется стабильностью термоэлектрических свойств. Используют для изготовления защитных чехлов и элементов термопар. |
Обладает высокой износостойкостью. Компонент износостойких наплавочных покрытий. |
Обладает хорошими термоэмиссионными свойствами. Устойчив к ионной бомбардировке и в агрессивных газовых средах. Применяют в качестве эмиттеров в электроннолучевых устройствах средней и высокой мощности. |
Используют как абразив, нейтронопоглащающий материал. |
Таблица №22 Характеристика борогидридов металлов
соединение |
Температура плавления, оС |
Плотность, г/см3 |
∆ Н обр, кДж/моль |
Li[BH4] |
283 (c разл.) |
0,681 |
-193,83 |
Na[BH4] |
505 (с разл.) |
1,074 |
-190,73 |
K[BH4] |
640 |
1,771 |
-163,34 |
Cs[BH4] |
660 ( с разл.) |
2,361 |
-263,34 |
Be[BH4] |
125 ( с разл.) |
,604 |
-107,84 |
Mg[BH4] |
305 ( с разл.) |
1,046 |
-152,57 |
Al[BH4] |
-64,5 |
0,544 |
-301,38 |
Zr[BH4] |
28,7 |
1,13 |
|
Растворимость борогидридов металлов.
(в воде - % по массе, в остальных растворителях – г в 100 г.)
Растворитель |
Li[BH4] |
Na[BH4] |
K[BH4] |
Вода |
20,9(10оС) |
33,1(20оС) |
18,4(20оС) |
Жидкий NH3 |
30,4(0оС) |
104,0(1,9оС) |
20,0(10оС) |
Эфир |
4,28(25оС) |
0,1(20оС) |
|
ТГФ |
28,0(25оС) |
11,0(40оС) |
|
диглим |
1,79(25оС) |
24,27(30оС) |
|
Таблица № 23: Характеристика алюминатов
Соединение |
Кристаллическая решетка |
Параметры ячейки (длины ребер, нм) |
Температура плавления, оС |
Плотность, г/см3 |
β-NaAlO2 |
Ромбическая |
а = 0,537 b = 0,521 с = 0,707 |
1800 |
2,693 |
α LiAlO2 |
Ромбоэдрическая |
а = 0,5006 α = 32,50 |
900 |
3,38 |
γ LiAlO2 |
Тетрагональная |
а = 0,5181 с = 0,6290 |
1610-1700 |
2,56 |
LiAl5O8 |
Кубическая |
а =0,7908 |
Около 2000 |
3,606 |
Сa3Al2O6 |
Кубическая |
а = 1,5262 |
1535 |
3,00 |
MgAl2O4 |
Кубическая |
а = 0,809 |
2135 |
3,6 |
LaAlO3 |
Ромбоэдрическая |
а = 0,5357 α = 60,1 |
2373 |
5,84 |
LaAl11O18 |
Гексагональная |
а = 0,5556 с = 2,2030 |
1925 |
4,03 |
YAlO3 |
Ромбическая |
а = 0,5180 b = 0,5330 с = 0,7375 |
2150 |
5,35 |
Y3Al5O12 |
Кубическая |
а = 1,2007 |
2213 |
4,55 |
Sm4Al2O9 |
моноклинная |
а = 0,762 b = 1,068 с = 1,115 β = 108,5 |
2250 |
|
Таблица № 24: Характеристика алюминийорганических соединений
Соединение |
Мол.м |
Температура плавления, оС |
Температура кипения, оС/мм.рт.ст |
Плотность, г/см3 |
Триметилалюминий (CH3)3Al |
72,08 |
15 |
130 |
0,752 |
Диметилалюминийхлорид (CH3)2AlCl |
107,54 |
|
83-84/200 |
|
Триэтилалюминий (C2H5)3Al |
114,16 |
-52,5 |
136/100 |
0,875 |
Диэтилалюминийхлорид (C2H5)2AlCl |
120,56 |
-74 |
127/50 |
0,96 |
Этилалюминийдихлорид (C2H5)AlCl2 |
126,96 |
32 |
113/50 |
1,222 |
Тетраэтилалюминат натрия [(C2H5)4Al]Na |
166,20 |
125 |
|
|
Трипропилалюминий (C3H7)3Al |
56,24 |
-84 |
110/10 |
0,820 |
Триизобутилалюминий (изо-C4H9)3Al |
198,33 |
-6 |
86/10 |
0,78 |
Диизобутилалюминийгидрид (изо-C4H9)2AlH |
142,28 |
|
117/1 |
|
Диизобутилалюминийхлорид (изо-C4H9)2AlCl |
176,06 |
-39 |
60/3 |
0,905 |
Таблица №25: Характеристика Нитрида алюминия
|
AlN |
Агрегатное состояние |
Бесцветные кристаллы |
Тип решетки |
Гексагональная решетка типа вюрцита |
Параметры решетки, нм |
а = 0,3111 , с = 0,4975 , z = 2, пространственная группа P63mc |
Температура плавления,оС |
2430-2630 |
Сро , Дж/(моль*К) |
30,1 |
∆ Н пл, кДж/моль |
Около 68 |
∆ Н обр, кДж/моль |
-319 |
∆ S 298 , Дж/(моль*К) |
20,2 |
Теплопроводность, Вт/(м*К) |
30,14 |
Температурный коэффициент линейного расширения, K-1 |
4,03*10-6 |
Ширина запрещенной зоны, эВ |
Выше 5 |
Твердость по Моосу |
9 |
Микротвердость, ГПа |
12 |
Модуль упругости, ГПа |
350(300 К) 280(1673 К) |
Свойства |
Окисляется на воздухе выше 900оС. С минеральными кислотами на холоду практически не взаимодействует, горячими кислотами медленно разлагается. При нагревании реагирует с растворами щелочей. |
Получение |
Взаимодействие азота с алюминиевой пудрой около 1200оС |
Применение |
В качестве огнеупорного материала для футеровок ванн, электролизеров, муфельных печей, тиглей, чехлов для термопар, для нанесения коррозионностойких и износостойких покрытий на сталь, графит. |
Таблица №26: Характеристика алюмогидридов
Соединение |
Плотность, г/см3 |
∆ Н обр, кДж/моль |
Температура разложения, оС |
∆ S 298 , Дж/(моль*К) |
Li[AlH4] |
0,917 |
-107,1 |
150-170 |
787 |
Na[AlH4] |
1,28 |
-113,1 |
220-230 |
1240 |
K[AlH4] |
1,33 |
-166,7 |
276-296 |
1290 |
Cs[AlH4] |
2,84 |
-165,0 |
294-325 |
1508 |
Mg[AlH4]2 |
1,05 |
-234 |
118 |
|
Ca[AlH4]2 |
|
-184,3 |
230 |
|
|
B2S3 |
Al2S3 |
Ga2S3 |
In2S3 |
Tl2S3 |
|
|
|
Агрегатное состояние |
бесцветн. кристаллы |
Прозрачные желтые игольчатые гексагональные кристаллы |
|
|
|
|
|
|
Тип решетки |
Кристаллический или стекловидный |
гексагональный |
Кубический или гексагональный |
кубический |
аморфный |
|
|
|
Длина связи |
|
|
|
|
|
|
|
|
Энергия связи |
|
|
|
|
|
|
|
|
Т пл |
|
1120 |
1250 |
1050. |
|
|||
Т кип |
600 |
|
|
|
|
|
|
|
∆Н298КДж/моль |
-252(т)
|
-724
|
-510,448
|
-351,456
|
500,406 |
|
|
|
∆G |
|
|
-505,427 |
-337,196 |
685,715 |
|
|
|
∆S Дж/мольК |
327(г) |
|
-703,778 |
169,594 |
|
|
||
Ср Дж/мольК |
80,7(г) |
|
|
117,988 |
397,392 |
|
||
теплопроводность |
|
|
|
|
|
|
||
электропроводность |
|
|
|
|
|
|
||
Получение |
|
При действии воды подвергается полному гидролизу. Получают из элементов при высокой температуре (сжигание проволоки, ленты или листочков металлического алюминия в парах серы, введение серы в расплавленный алюминий). Другие способы получения: реакция сероводорода с металлическим алюминием, нагретым до 830-1350оC, нагревание порошка металлического алюминия с Ag2S, ZnS, PbS или Sb2S3, восстановление безводного сульфата алюминия водородом при нагревании. |
|
Сульфид индия можно получить при нагревании металла с серой или при пропускании сероводорода в слабокислый раствор соли индия. Его цвет изменяется от желтого через красный до коричневого. Цвет и кристаллическая структура этого вещества, по-видимому, связаны со скоростью образования, которая в свою очередь зависит от раствора, из которого сульфид индия осаждается сероводородом. Из раствора хлорида индия выпадает желтый осадок, который состоит из мелких частиц или имеет неупорядоченную структуру. По-видимому, это объясняется быстрым ростом кристаллов. Из раствора сульфата индия образуется соль красного цвета, обладающая определенной структурой, которая обнаруживается при рентген оструктурном анализе. По-видимому, в этом случае рост кристаллов происходит с меньшей скоростью. Это может быть связано с электрохимическими свойствами индия, описанными в следующем разделе. |
|
|
||
Таблица №27: Характеристика неорганических соединений галлия
|
GaN |
GaP |
Агрегатное состояние |
Кристаллы |
Оранжевые или зеленовато-желтые кристаллы с алмазным блеском |
Тип решетки |
Решетка типа вюрцита |
Решетка кубическая типа сфалерита |
Параметры решетки, нм |
а = 0,3186, b = 0,5178 |
а = 0,54495 |
Температура плавления, оС |
1700 |
1790 |
Плотность, г/см3 |
6,1 |
4,1297 |
∆ Н обр, кДж/моль |
-109,8 |
-102,6 |
Ширина запрещенной зоны, эВ |
3,39(27оС) |
2,25(27оС) |
свойства |
Не взаимодействует с водой, растворами минеральных кислот и царской водкой, медленно реагирует с растворами щелочей, окисляется на воздухе при 800оС. |
Устойчив к действию кислорода воздуха до 700оС. Не взаимодействует с водой, практически не реагирует с серной и соляной кислотой, медленно взаимодействует при нагревании с азотной и фтористоводородной кислотами, царской водкой, разлагается растворами щелочей при нагревании с выделением PH3. |
применение |
Материал для светодиодов и прозрачных диэлектрических покрытий. Перспективен как материал инжекционных лазеров. |
Полупроводниковый материал для светодиодов, солнечных батарей, датчиков Холла, оптических фильтров. |
Сро , Дж/(моль*К) |
|
44 |
∆ Н пл, кДж/моль |
|
122,4 |
∆ S 298 , Дж/(моль*К) |
|
51,9 |
Температурный коэффициент линейного расширения, K-1 |
|
5,78*10-6 |
Теплопроводность, Вт/(м*К) |
|
110 |
Подвижность электронов, см2/(В*с) |
|
300 |
|
GaSb |
GaAs |
Название |
Антимонид галлия |
Арсенид галлия |
Агрегатное состояние |
Светло-серые кристаллы с металлическим блеском |
Темно-серые с фиолетовым оттенком и металлическим блеском кристаллы. |
Тип решетки Параметры решетки, нм |
Кубическая типа сфалерита а=0,609593 |
Кубическая типа сфалерита а=0,565321 |
Температура плавления, оС |
712 |
1238 |
Плотность, г/см3 |
5,6137(20оС) |
5,317(20 оС) |
Сро , Дж/(моль*К) |
48,6 |
46,9 |
∆ Н пл, кДж/моль |
65,19 |
105,6 |
∆ Н обр, кДж/моль |
-44,2 |
-74,1 |
∆ S 298 , Дж/(моль*К) |
76,17 |
64,27 |
Температурный коэффициент линейного расширения, K-1 |
6,7*10-6 |
5,93*10-6 |
Теплопроводность, Вт/(м*К) |
35 |
150 |
Ширина запрещенной зоны, эВ |
0,79( 27 оС) |
1,428( 27 оС) |
Подвижность электронов, см2/(В*с) |
4000 |
8500 |
Свойства |
Устойчив на воздухе и в воде, медленно взаимодействует с минеральными кислотами и концентрированными растворами щелочей. |
Устойчив к кислороду воздуха и парам воды до 600оС, медленно реагирует с H2SO4 и соляной кислотой с выделением AsH3. |
Получение |
Сплавлением Ga с 5 % избытком Sb в атмосфере H2 в кварцевых или графитовых контейнерах, после чего GaSb гомогенизируют зонной плавкой. |
Сплавлением Ga с As под давлением паров As около 100кПа. |
Применение |
Полупроводниковый материал для СВЧ-диодов, транзисторов, микроволновых детекторов. |
Один из основных полупроводниковых материалов материалов для интегральных микросхем, фотоприемников, СВЧ- и фотодиодов, транзисторов, инжекционных лазеров, оптических фильтров и модуляторов лазерного излучения, солнечных батарей и др. |
Таблица №28: Характеристика органических соединений галлия
Соединение |
Мол.масса |
Температура плавления,оС |
Температура кипения,оС |
Триметилгаллий Ga(CH3)3 |
114,83 |
-15,8 |
55,7 |
Триэтилгаллий Ga(C2H5)3 |
156,91 |
-82,5 |
142 |
Трифенилгаллий Ga(C6H5)3 |
301,04 |
166 |
|
Эфираттриметилгаллия Ga(CH3)3*O(C2H5)2 |
188,95 |
-76 |
98,3 |
Таблица №29: Халькогениды подгруппы галлия
|
Агрегатное состояние |
Температура плавления, оС |
Плотность, г/см3 |
Ga2S3 |
Белые, светло-желтые или оранжевые кристаллы |
1125 |
3,74 |
Ga2S2 |
Желтые кристаллы |
1015 |
3,75 |
Ga2Se2 |
Темно-красные кристаллы |
960 |
5,03 |
Ga2Te3 |
Черные кристаллы |
810 |
5,582 |
Соединение |
Цвет |
Плотность, г/см3 |
Температура плавления, оС |
∆ Н обр, кДж/моль |
Ширина запрященной зоны, эВ |
In2S3 |
Красно-коричневый |
4,9 |
1090 |
-351 |
1,1 |
InS |
Красный |
5,18 |
692 |
-121 |
|
In2Se3 |
Темно- фиолетовый |
5,67 |
890 |
-344 |
1,2 |
InSe |
Темно-коричневый |
5,7 |
660 |
-118 |
1,1 |
In2Te3 |
Черный |
5,78 |
667 |
-192 |
1,0 |
InTe |
Сине-стальной |
6,29 |
696 |
-71 |
|
Таблица №30 Квасцы
Важным классом алюминиевых солей являются квасцы. Это структурный прототип и родоначальник большого класса аналогичных солей, образуемых другими элементами. Квасцы имеют общую формулу MAl(SO4)2*12H2O, где М может быть практически любым обычным однозарядным одноатомным катионом, кроме лития, который слишком мал по размерам, и его введение в систему связано с потерей стабильности. Кристаллы состоят из ионов [M(H2O)6]+, [Al(H2O)6]3+, и двух ионов SO42-. Соли того же типа MIMIII(SO4)2*12H2O образуют и другие ионы М3+, включая Ti, V, Cr, Mn, Fe, Co, Ga, In, Rh, Ir. Все такие соединения называются квасцами, а соли алюминия – алюминиевыми квасцами.
Произведения растворимости
Вещество |
ПР |
-lgПР |
Al(OH)3 |
10-32 |
32 |
TlBr |
3,9*10-6 |
5,41 |
TlBrO3 |
8,5*10-5 |
4,07 |
Tl2CO3 |
4*10-3 |
2,4 |
TlCl |
1,7*10-4 |
3,76 |
Tl2CrO4 |
9,8*10-13 |
12,01 |
TlI |
3,6*10-8 |
7,44 |
TlIO3 |
3,4*10-6 |
5,47 |
Tl(OH)3 |
10-45 |
45 |
Tl2S |
5*10-21 |
20,3 |
AlASO4 |
1,6*10-16 |
15,80 |
AlPO4 |
5,75*10-19 |
18,24 |
Ga4[Fe(CN)6] |
1,5*10-34 |
33,82 |
Ga(OH)3 |
7,1*10-36 |
35,15 |
In4[Fe(CN)6] |
1,9*10-44 |
43,72 |
In(OH)3 |
5*10-34 |
33,3 |
In(IO3)3 |
3*10-3 |
2,5 |
In2S3 |
1*10-88 |
88 |
TlClO4 |
4*10-2 |
1,4 |
Tl3Co(NO2)6 |
1,0*10-16 |
16,00 |
Tl4Fe(CN)6 |
5*10-10 |
9,3 |
Tl3PO4 |
6,7*10-8 |
7,18 |
Tl2PtCl6 |
4*10-12 |
11,4 |
TlReO4 |
1,2*10-5 |
4,92 |
TlSCN |
1,7*10-4 |
20,30 |
Tl2SO3 |
6,3*10-4 |
3,2 |
Tl2SO4 |
4*10-3 |
2,4 |
Tl2S2O3 |
2,0*10-7 |
6,70 |
TlVO3 |
1*10-5 |
5 |
Tl4V2O7 |
1*10-11 |
11 |
