
- •Глава II. Процессы образования и диссоциации химических соединений
- •1. Термодинамика и кинетика реакций образования и диссоциации карбонатов
- •2. Термодинамика реакций образования и диссоциации оксидов металлов
- •3. Кинетические особенности реакций образования и диссоциации карбонатов, оксидов, сульфидов
- •4. Процессы окисления твердых металлов
4. Процессы окисления твердых металлов
Известно, что в атмосферных условиях поверхность большинства металлов покрыта тонкой пленкой оксидов. Только благородные металлы: золото, платина, серебро не окисляются на воздухе. Со временем толщина оксидного слоя растет и теоретически весь металл должен превратиться в оксид. Однако некоторые металлы могут существовать весьма долго в металлической форме, поскольку оксидная пленка защищает их от дальнейшего окисления, например алюминий, медь и сплавы на их основе. Присутствие в атмосфере водяного пара, диоксида углерода, и других примесей ускоряет окисление, которое называют газовой коррозией.
При нагревании металла окисление поверхности значительно ускоряется. На поверхности металла за очень короткое время возникает толстый слой окалины. Эти процессы должны учитываться при нагреве металла перед обработкой давлением или для термической обработки для повышения или изменения его физических свойств, а также при использовании металлических деталей в области повышенных температур в котлах, турбинах, двигателях внутреннего сгорания, реактивных двигателях и т.п.
Первостепенную роль в окислении металла играет кислород газовой фазы. Как было показано выше, окислительный потенциал воздушной атмосферы и большинства атмосфер металлургических агрегатов, нагревательных печей и т.п. достаточен с избытком для образования оксидов металлов. Только нагрев в глубоком вакууме или в восстановительной атмосфере, например в чистом водороде, не сопровождается его окислением.
Образование и рост окалины на поверхности металла
Окисление поверхности твердого металла можно в общем виде представить следующей схемой. Образование тонкого, первичного слоя оксидной пленки, рост оксидной пленки. Рост оксидной пленки зависит от подвода окислителя к ее поверхности и от диффузии окислителя - кислорода через пленку к поверхности металла, которая может происходить как путем молекулярной диффузии через пленку, так и путем диффузионного переноса по порам и трещинам. Рост пленки зависит также и от кристаллохимических процессов, связанных с превращениями одних веществ в другие - металла в оксид, одних оксидов в другие.
Пленка оксидов может обладать защитными свойствами. Такими свойствами обладают сплошные, плотные пленки, покрывающие вcю поверхность металла. Условие сплошности,, сформулированное Пиллингом и Бедоуртсом, состоит в том, что объем оксида, возникающего из металла на его поверхности, должен быть больше объема израсходованного металла, иначе пленки оксида не хватает, чтобы покрыть весь металл и пленка получится рыхлой.
Сплошные пленки образуются в случае: VOK/V/MeO =MdMe/ x dOK A > 1 (I группа металлов).
Несплошные пленки образуются в случае: VOK/VMe = MdMe/ x dOK <I (II группа металлов),
где VOK - мольный объем оксида; VMe - объем металла, израсходованного на образование оксида; М- молекулярная масса оксида; А- атом-
масса металла; dOK - плотность оксида; dMe - плотность металла; число атомов металла в молекуле оксида.
Можно считать, что защитными свойствами обладают пленки на металлах при 1< VOK/VMe< 2,5-3,0.
К I группе относятся металлы, образующие защитную пленку, -Al, Ni, Cr, Fe, Сu и другие.
Ко II группе - Na, К, Mg, Ca. Металлы второй группы окисляются c
большой скоростью. При больших отношениях объема окалины к объему металла вследствие большой разности мольного объема оксида и металла в окалине возникают значительные напряжения, приводящие к ее периодическому растрескиванию. Нарушение целостности покрова оксида открывает доступ кислорода к поверхности металла и вызывает увеличение скорости роста окалины, до тех пор пока поры не будут закрыты новым слоем оксида. Тогда скорость окисления вновь уменьшается.
Ниже приведены отношения объемов оксидов к объему израсходованного металла.
Металл . . . . . K Ca Cu Zn Al Si Pb
Оксид . . . . . . K2O CaO Cu2O ZnO Al2O3 SiO2 PbO
Vок/VМеО. . . 0,48 0,63 1,67 1,58 1,31 1,33 1,15
Металл . . . . . Cr Fe Ni Mo W Mo
Оксид . . . . . . Сr2O3 Fe2O3 NiO MoO2 WO2 MoO3
Vок/VМеО . . . . 2,02 2,14 1,52 2,18 1,86 3,45
На рис.30 показаны схемы возможного образования оксидной пленки на поверхности металла: а - сплошная пленка; б - рыхлая пленка.

Рисунок 30 - Схема образования оксидной пленки на металле: а –сплошная
пленка; б – рыхлая пленка.
Процесс роста оксидной пленки начинается с адсорбции окислителя на активных центрах и образования зародышей оксида на поверхности металла, далее возникает молекулярный слой оксида на поверхности металла. В дальнейшем кислород газовой фазы адсорбируется «внешней поверхности оксида и диссоциирует на атомы О2 →2еO. Атомы кислорода ионизируются О+2еО-2 и диффундируют в слое оксидной пленки по направлению к поверхности металла. Одновременно с поверхности металла в оксидный слой переходят катионы металл с электронами: Me → Ме+n +nе. Катионы металла диффундируют от металлической поверхности к наружной поверхности оксида.
На поверхности оксида происходит взаимодействие ионов кислорода и металла и возникновение кристаллической решетки оксида по уравнений
mМе+n + mn/2 O-2 →МеmОmn/2 за исключением сложных оксидов.
Для формально-кинетического описания процесса окисления допус -тимы следующие упрощения:
Концентрация кислорода в объеме газа - соб - равна концентрации кислорода на внешней поверхности оксида - сп, концентрация кислорода на поверхности металла - с''п. Реакция на поверхности металла имеет первый порядок по концентрации с''п.
Подвод кислорода в газовой фазе к поверхности оксида не лимитирует процесс. Таким образом, скорость роста оксида состоит из двух последовательно протекающих стадий:
а) диффузия кислорода через оксид со скоростью
![]() ,
,
где S- поверхность оксида, м2; V- объем оксида, м3;
б) химическая реакция на поверхности металла vk = Кс''п, где D –
коэффициент диффузии кислорода в слое оксида; у - толщина слоя; К - константа скорости.
Пусть наблюдаемая скорость роста оксида равна vн = dy/dτ. В установившемся режиме окисления vн = vд = vk. Исключив неизвестную концентрацию с''п и разделив переменные, найдем
dy + D/Kdy (S/V) = Dco6dτ (S/V);
после интегрирования при начальных условиях τ= 0 и у = 0 получим
![]()
При окислении металлов со сплошной оксидной пленкой в начале окисления, когда толщина оксида незначительна у2<<у, и в последнем уравнении пренебрегаем первым слагаемым по сравнению со вторым. Тогда у = Kcобτ, толщина оксидного слоя линейно зависит от времени. Окисление идет с постоянной скоростью, пропорциональной концентрации cоб; реакция протекает в кинетическом режиме.
При большой
толщине оксидного слоя у2
>> у пренебрегаем величиной (D/K)
у (S/V)
и получим, что
![]() .
Толщина слоя оксида растет во времени
по параболической зависимости
пропорционально
.
Толщина слоя оксида растет во времени
по параболической зависимости
пропорционально
![]() .
Это означает, что лимитирующим является
диффузионный режим процесса.
.
Это означает, что лимитирующим является
диффузионный режим процесса.
Между этими крайними случаями лежит промежуточная область, описываемая уравнением.
При низких температурах, примерно до 300 оС на Al, Fe, Ni, Zn рост
пленки сопровождается большим самоторможением во времени и подчиняется логарифмическому закону: у = K lg τ + а; где К-константа скорости роста пленки, а - постоянная (отрезок на оси ординат, соответствую-
щий х0 при τ =0).
На рис.31 представлены кривые, характеризующие окисление на воздухе по линейному (1), параболическому (2), логарифмическому (3) законам.

Рисунок 31 - Закономерности окисления пленок на металлах
Тонкие оксидные пленки толщиной до 40 нм - невидимы, средние по толщине - до 50 нм видимы как цвета побежалости и более 50 нм - это слои окалины.
Окисление железа
При окислении железа на воздухе выше 570 °С оксидный слой имеет трехслойную структуру, состоящую из слоя вюстита, магнетита и
гематита с промежуточными переходными слоями между ними. При окислении при температурах до 570 оС отсутствует слой вюстита. Если же окисление происходит в атмосфере СО2 или Н2О, то Fe2О3 не образуется. Перед рассмотрением механизма образования слоя оксидов на поверхности железа познакомимся с основными кристаллохимическими характеристиками твердых фаз в этой системе.
Железо имеет три модификации: α-Fe до 910 оС с объемноцентрированной кубической решеткой о.ц.к; γ-Fe в температурном промежутке 910-1400 °С с гранецентрированной решеткой г.ц.к.; выше 1400 оС - δ-Fe также с о.ц.к. решеткой.
Оксид железа - вюстит (FeO). Вещество не имеет точного стехио-метрического состава, оно имеет переменный состав; в вюстите больше кислорода, чем это следует из химической формулы FeO. Вюстит устойчив в области 570-1370 °С. Он имеет кубическую решетку типа поваренной соли и образует твердый раствор вычитания. Отдельные узлы кристаллической решетки там, где должны располагаться ионы железа, остаются вакантными, как это представлено на рис.32. Для сохранения электронейтральности кристалла с каждым "исчезнувшим" ионом Fe+2 из элементарной ячейки должны быть выведем два электрона, вместо этого появляются два катиона Fe+3 по реакции 2Fe+2 = 2Fe+3 + 2е. Таким образом, с уходом одного катиона Fe+2 образуется группа: Fe+2 + 2Fe+3 + 4О-2, химический состав которой coответствует соединению Fe3O4, т.е. образуется раствор магнетита в FeO.
Магнетит Fe3O4 имеет кубическую решетку типа шпинели (MgO* А12О3). Элементарная ячейка магнетита состоит из группы следующих катионов; 8Fe+2; 16Fe+3; 32О-2.

Рисунок 32 - Схема замещения узлов в кристаллической решетке вюстита:
ионы 1 – О-2, 2 – Fe+2, 3 – Fe+3
Гематит - Fe2О3 имеет две модификации: α-гематит имеет ромбоэдрическую решетку типа корунда А12О3; γ-Fe2О3 - маггемит имеет тетрагональную решетку, параметры которой незначительно отличаются от параметров решетки магнетита. Эта решетка также имеет катионные вакансии. Они образуются в результате удаления из кристаллов Fe3О4 части ионов Fe+2 совместно с электронами с переходом остальных двухвалентных ионов железа в трехвалентные. Параметры кристаллических решеток оксидов железа представлены в табл.7.
Таблица 7- Параметры решеток оксидов железа
Номер |
Фаза |
Тип решетки |
ai, нм |
ai/aα-Fe |
1 |
α-Fe |
кубическая |
0,291 |
1,00 |
2 |
Вюстит |
кубическая |
0,430 |
1,48 |
3 |
магнетит |
кубическая |
0,841 |
2,89 |
4 |
гематит |
ромбическая |
0,542 |
- |
5 |
маггемит |
тетрагональная |
0,833 |
2,86 |
Между фазами 1, 2, 3, 5 существует размерное и структурное соответствие. Они относятся к близким кристаллическим системам и перестройка одной решетки в другую не вызывает больших взаимных смешений ионов.
Рассмотрим превращение α-Fe в вюстит. При окислении железа ионы кислорода внедряются в грани решетки железа в плоскостях 1-5-7-3 (рис.33), в середине сторон (показано стрелками). Для размещения анионов кислорода решетка железа вынуждена расшириться и образуется грань элементарной решетки вюстита с параметром 0,430 нм, который в 1,42 раза больше параметра решетки α-Fe и почти соответствует размеру диагонали элементарной решетки α-Fe.
При этом перемещение катионов железа в плоскости, параллельной грани 1-2-3-4, будет незначительным, всего на 4,6 % возрастает расстояние между ионами Fe+2. Такие перемещения частиц укладываются в требование размерного соответствия, которое допускает изменения в параметре решетки до 9 %. В направлении, перпендикулярном грани 1-2-3-4, соответствия нет, так как внедрение ионов кислорода требует увеличения расстояния между катионами железа в 1,5 раза.

Превращение решетки FeO в Fe3O4 происходит еще проще, так в одной элементарной ячейке магнетита может разместиться 8 ячеек вюстита. При этом анионы кислорода остаются на своих местах почти без изменений. Превращение FеО в Fе3O4 сопровождается удалением из решетки вюстита некоторого количества катионов Fe+2 с одновременным переходом некоторой части двухзарядных катионов железа в трехзарядные. Переход магнетита в маггемит, т.е. в γ-Fe2O3 , который устойчив при 200-400 оС, происходит легко, так как между ними большое размерное соответствие, а при температуре выше 400 оС может происходить появление α-Fe2O3. Меньший размер параметра решетки маггемита по сравнению с магнетитом объясняется сжатием решетки благодаря вакансиям, появляющимся при переходе Fe3О4 в γ-Fe203.
Механизм роста окалины на поверхности железа

Рисунок 34 - Распределение активности в слое окалины на поверхности железа
Перемещение частиц кислорода и железа происходит диффузионным путем. Наиболее благоприятные условия для диффузии имеются в слоях вюстита и гематита. Решетки этих оксидов имеют вакантные узлы, по которым и происходит перемещение катионов железа и анионов кислорода. В гематите подвижность ионов кислорода на четыре порядка превышает подвижность катионов железа, поэтому в этом слое диффундирует преимущественно кислород.
Магнетит имеет плотную кристаллическую решетку типа шпинели в которой также появляются катионные и анионные вакансии, по которым и происходит диффузия.
Наиболее "удобным" для диффузии частиц является слой вюстита. Ионная проводимость вюстита зависит от температуры и парциального давления кислорода в газовой фазе. При росте р02 увеличивается нестехеометрия вюстита, его неупорядоченность, происходит рост ионной проводимости и, следовательно, возрастание коэффициента диффузии железа. Коэффициент диффузии железа в вюстите пропорционален концентрации вакансий. При 1270 К коэффициент диффузии железа DFeO равен 7*10-2 м2/с, что почти в тысячу раз больше, чем аналогичный коэффициент в магнетите. В гематите DFe+3 = 10-18 м2/с, а Do=6*10-14 м2/с
Таким образом, механизм появления окалины при температуре>570 oС на поверхности железа можно представить следующим образом.
В первый момент на металле возникает тонкая пленка γ-Fe2O3, которая в дальнейшем утолщается и перестраивается в устойчивую фазу α-Fe2О3. Подходящие к поверхности окалины катионы железа взаимодействуют с адсорбированным кислородом и образуют слой Fe2О3 , растущий наружу. Из металла в слой гематита происходит диффузия ионов железа. В решетке
γ-Fe2О3 происходит заполнение катионных вакансий и γ-Fe2О3 перестраивается в Fe3О4: Fe + 4Fe2О3→3Fe3О4; впоследствии на поверхности железа появляется слой вюстита. При дальнейшем окислении происходит рост всех слоев окалины. Ионы железа перемещаются к поверхности окалины. На границе раздела FeO-Fe3О4 они внедряются в решетку магнетита и перестраивают ее в вюстит Fe + Fe3О4 →4FeO. Образующиеся катионные вакансии в вюстите заполняются непрерывно поступающими катионами Fe+2.
Диффузия кислорода в глубь окалины сопровождается также подобными превращениями. На границе раздела вюстита с железом кислород внедряется в решетку железа, образует пересыщенный раствор, который переходит постепенно в вюстит и расширяется в глубь металла. Толщины слоев окалины составляют: гематит примерно 2-3%; магнетит - 5 %, остальное - вюстит. Вюстит является наиболее слабым защитным слоем.Как было показано в работах В.И.Архарова, скорость окисления железа наиболее заметно возрастает при нагреве >600 oC (cм. рис.35), т.е. тогда, когда в структуре окалины появляется вюстит. Это объясняется его высокой диффузионной проницаемостью по железу и кислороду и высоким структурным соответствием между решетками вюстита и магнетита. Благодаря этому решетки легко перестраиваются одна в другую. При пониженных температурах, когда вюстит не образуется, образование оксидных слоев затруднено. Для повышения жаростойкости стали необходимо легировать ее такими элементами, которые или повышают температуру образования вюститного слоя, или способствуют образованию плотных оксидных слоев. Это достигается при введении в состав стали никеля и хрома. Оксид хрома (II) образует с FeO соединение FeCr2O4, решетка которого плохо пропускает катионы железа и кислорода. Атомы хрома в решетке гематита упрочняют ее и также повышают ее защитные свойства.
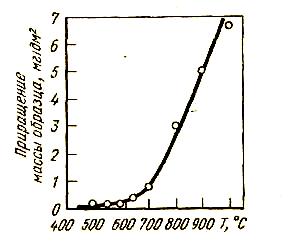
Рисунок 35- Скорость окисления железа в зависимости от температуры
