
- •Глава II. Процессы образования и диссоциации химических соединений
- •1. Термодинамика и кинетика реакций образования и диссоциации карбонатов
- •2. Термодинамика реакций образования и диссоциации оксидов металлов
- •3. Кинетические особенности реакций образования и диссоциации карбонатов, оксидов, сульфидов
- •4. Процессы окисления твердых металлов
Глава II. Процессы образования и диссоциации химических соединений
1. Термодинамика и кинетика реакций образования и диссоциации карбонатов
Термодинамика реакций образования и диссоциации карбонатов
Наиболее часто в металлургической промышленности применяют известняк (карбонат кальция, СаСО3). Карбонатами называются соли угольной кислоты, общая формула карбоната: МеСО3. Также применяются карбонаты магния, железа, марганца. Доломит (Са, Мg) (СО3)2 используется для изготовления футеровки, наведения шлака. Карбонаты являются рудами некоторых металлов. Как пример можно привести сидериты - железные руды, состоящие из FеСO3 или руды марганца - родохрозит, содержащие МnСO3. Разложение карбонатов происходит при плавке чугуна в доменных печах, на лентах спекательных машин. Условия разложения и выбор оптимальных режимов обжига имеют существенное значение для анализа процессов в различных агрегатах. При нагревании карбонаты разлагаются на оксид металла и на диоксид углерода:
МеСО3 = МеО + СО2, ΔН>О; (55)
реакция эндотермическая. Карбонаты в общем виде образуются по экзотермической реакции
МеО + СO2 = МеСO3> ΔН <О. (56)
Приведем следующие реакции образования карбонатов:
СаО + СO2 = СаСO3; ΔН °298 = -178 кДж, (57)
МgО + СO2 = МgСO3; ΔН °298 = -103,8 кДж, (58)
FеО + СO2 = FеСO3; ΔН °298 = - 104,3 кДж, (59)
МnО + СO2=МnСO3; ΔН °298 = -118,5 кДж. (60)
Константа равновесия реакции (56) равна К56 =aMeCO3/PCO2*aMeO; где aMeCO3,
aMeO - активности карбоната и оксида металла; PCO2 - парциальное давление диоксида углерода. Если оксид металла и карбонат находятся в виде твердых или жидких чистых веществ, то активности их равны 1. Тогда константа равновесия равна 1/РCO2 .
Это подтверждает и правило фаз Гиббса, по которому система будет иметь только одну степень свободы, так как С = К - Ф + 2, К=2; Ф= = 3 и С = 1. Так как константа равновесия зависит только от температуры, то и величина PCO2 является функцией температуры. Равновесное парциальное давление диоксида углерода в реакции диссоциации углекислого соединения называется упругостью диссоциации карбоната. Если участники процесса не образуют между собой растворов, то эта величина является функцией только температуры и равна обратной величине константы равновесия. Для оценки сравнительной прочности различных соединений, в частности карбонатов, или сродства оксидов к СO2 используется величина термодинамического изобарного потенциала или ΔG°, равная
ΔG°=-RТ1n 1/ PCO2 =RT1n PCO2 .
Упругость диссоциации может служить мерой сравнительной прочности карбоната или сродства оксида к СO2. Чем меньше величина ΔG° и PCO2 , тем более прочен карбонат, и наоборот. Поскольку реакции образования карбонатов экзотермичны, то с ростом температуры константы равновесия уменьшаются, а PCO2 растет, т.е. прочность карбонатов с нагревом уменьшается.
Для анализа реакции диссоциации карбоната МеСO3 = МеО + СO2 и определения возможного ее направления в зависимости от внешних условий
используют преобразованное уравнение изотермы Вант-Гоффа:
ΔGт = RT(1n PфCO2-1n PCO2);
где PфCO2 - фактическое парциальное давление диоксида углерода в атмосфере системы, а PCO2 - упругость диссоциации. Направление процесса будет зависеть от соотношения между этими величинами.
Если PфCO2> PCO2, т.е. давление СO2 в системе выше равновесного, то ΔG° > 0 и реакция может идти только в обратную сторону, в сторону образования карбоната.
Если PфCO2< PCO2 , т.е. давление СO2 в системе меньше равновесного, то ΔG° <0 и реакция должна идти в сторону разложения карбоната.
В случае PфCO2= PCO2 система будет находиться в состоянии равновесия.
 Рисунок
16 - Диссоциация карбонатов в зависимости
от температуры
Рисунок
16 - Диссоциация карбонатов в зависимости
от температуры
Эти соотношения показаны на рисунке 16.
Точки, лежащие на этой кривой, соответствуют состоянию равновесия реакции разложения карбоната.
Область на диаграмме выше кривой равновесия соответствует условиям, где PфCO2> PCO2 и в которой возможно только образование карбоната. В области ниже кривой PфCO2< PCO2, и здесь происходит разложение карбоната.
С помощью данной диаграммы можно определять направление процесса при любых температурах и парциальных давлениях СO2.
Для определения направления процесса при различных температурах и постоянном давлении СO2 необходимо провести на диаграмме прямую, параллельную оси абсцисс, соответствующую данному значению PCO2. Точка пересечения прямой с равновесной кривой определит температуру начала разложения карбоната при данном давлении СO2 в атмосфере. Эта температура называется температурой разложения карбоната. При всех температурах выше данной происходит разложение карбонатов, а при более низких при этом давлении СO2- образование карбоната. Известно, что в воздухе обычно содержится 0,03 % СO2, т.е. парциальное давление PCO2 равно 30,4 Па. Для СаСО 3 температура начала разложения на воздухе равна 806 К или 533 °С, таким обра зом на воздухе разложение карбоната кальция, известняка может происходить только при нагреве > 533 оС. Зависимость упругости диссоциации карбоната кальция от температуры выражается уравнением
lgРсо2 = - 8905/Т + 7,53 (Рсо2, кПа) (61)
ΔG° = 170,58 - 0,144 Т кДж. (62)
На рис.17 представлена зависимость ΔG°от температуры для реакции (57). При 1183 К ΔG° = 0, а Рсо2= 105 Па.
Ниже приведены упругости диссоциации СаСO3 при различных температурах:
t, oC , . . . . . 300 500 600 700 800 900 1000 1100 1300
Рсо2 , Па .9,75*10-4 10 213 2000 1,7*104 8,6*104 3,4*105 11*105 74*105
В интервале температур 600- 1000 оС равновесие реакции диссоциации карбоната кальция смещено вправо. Например, при 800 оС на воздухе при общем давлении 101,3 кПа равновесный газ содержит 17 % СО2. Такая газовая смесь создается при содержании в газе 17 % СО, при этом происходит образование карбоната, если менее - то его разложение. При низких температурах трудно создать условия, благоприятствующие разложению СО2, а при высоких температурах - условия для образования карбоната или для предотвращения его распада.
Для характеристики диссоциации карбонатов используется понятие температуры химического кипения. При этой температуре упругость диссоциации карбоната становится равной общему давлении газа, при котором наступает интенсивное разложение карбоната. Для СаСО3 температура химического кипения на воздухе при общем давлении 101,3 кПа равна 1183 К или 910 оС.
Зависимость упругости диссоциации МgС03 от температуры выражается уравнением:
lgРсо2 = - 5786/Т + 6,27 (кПа) (63)
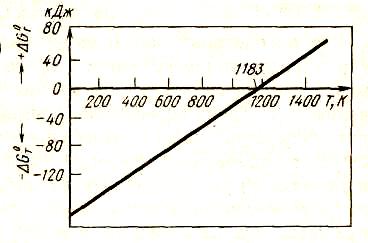
Рисунок 17 - Зависимость ΔG° от температуры для реакции образования карбоната кальция
Зависимость упругости диссоциации MgCO3 от температуры представлена ниже:
t, oC , . . . . . 500 600 700 800 900 1000 1100
Рсо2 , Па .. . 0,06 0,44 2,10 7,54 21,7 53,0 113
Прочность наиболее важных карбонатов падает в следующей пос- ледовательности: СаСО3 → МgСО3 → FеСО3.
Для металлургического производства большое значение имеет также сложный карбонат кальция и магния - доломит - (Са,Мg)*(СO3)2, диссоциация которого протекает в две стадии:
СаМg(СO3)2 = СаСO3 + МgO + СO2, (64)
СаСO3 = СаО + СO2.
Для первой стадии разложения, используя имеющиеся термодинамические данные, можно получить зависимость упругости диссоциации от температуры по следующему уравнению:
lgPco2 = - 6400/T + 8,27 (кПа). (65)
Таким образом, температура начала разложения доломита по первой стадии при атмосферном давлении равна 1021 К или 748 oС. Вторая стадия разложения доломита начинается при температуре разложения карбоната кальция, равной 910 °С.
Связь упругости диссоциации с дисперсностью карбонатов
Упругость диссоциации карбонатов зависит от степени дисперсности частиц. Чем мельче частицы, тем больше упругость диссоциации. Известно, что свойства частиц, находящихся на поверхности твердого вещества, отличаются от свойств частиц, находящихся внутри вещества. Частицы, расположенные на поверхности, подвергаются воздействию неуравновешенных сил межчастичного взаимодействия. Энергия частиц на поверхности будет отличаться от энергии частиц в объеме фазы, так как координационное число на поверхности меньше, чем в центре. Также будет иным и характер движения частиц, другой будет, например, частота колебаний по сравнению с колебаниями частиц, расположенных внутри фазы. На поверхности происходит сгущение свободной энергии Гиббса и рост химического потенциала μ. Чем дисперснее материал, тем соответственно больше его поверхность по отношению к объему и, следовательно, тем больше общая энергия Гиббса всей системы. В этом же направлении действуют искажения кристаллической решетки, разрыхление внутренней структуры и т.п. Поэтому упругость диссоциации становится не только функцией температуры, но и функцией характера кристаллической структуры, степени дисперсности.
Повышение степени дисперсности должно сопровождаться увеличением активности карбонатной фазы, которая уже не будет равна 1. Если μi= μio + RТlgai , то для правильно построенной, крупной кристаллической фазы а = 1 и μi = μio, но для мелкодисперсной фазы lg ai = (μi - μio)/RT,
μi - μio > 0, так как будет происходить возрастание химического потенциала и активность будет более 1, а тогда из соотношения для константы равновесия:
K=(1/Pco2)(a(MeCO3)/a(MeO)); Pco2 =(1/K)( a(MeCO3)/a(MeO))
Поэтому с ростом дисперсности и aМеСО3 будет происходить и рост Pco2.. Уменьшение же степени дисперсности оксида и его активности будет приводить к уменьшению упругости диссоциации карбоната. Мелкодисперсный, тонко помолотый карбонат будет менее устойчивым, он будет легче распадаться. В то же время тонкодисперсный оксид, обладая повышенной химической активностью, будет полнее взаимодействовать с СО2 и снижать его равновесное давление в газовой фазе.
Мелкодисперсные фазы термодинамически неустойчивы и стремятся самоукрупниться, т.е. рекристаллизоваться, при этом происходит уменьшение энергии Гиббса. Истинное равновесие, соответствующее минимальному значению энергии Гиббса, будет достигаться тогда, когда основной вклад в ее значение будет вносить энергия частиц в объеме, а поверхностной энергией можно будет пренебречь. При невысоких температурах рекристаллизация протекает медленно и получаемые значения Pco2 далеки от равновесных.
Подтверждают это опытные данные о разложении доломита. Мелкокристаллический доломит начинает диссоциировать при 710оС, а крупнокристаллический при 745оС.
