
10. Гибридизация – это изменение первоначальной формы атомных орбиталей приводящее к образованию гибридных орбиталей одинаковых по форме и по энергии.
Основные положения:
Гибридизируются орбитали атома, реализующего связи с другими атома;
Гибридизируются АО с близкой энергией;
Число гибридных орбиталей равно суммарному числу исходных орбиталей;
Гибридизация сопровождается изменением формы электронных облаков, поэтому хим. связи с участием гибр. орбиталей обладают большей прочностью, чем связи с «чистыми» АО.
Типи Гибридизации:sp(CO2),sp2(BeCI3),sp3(CH4),sp3d2(SF6)
Метод отталкивания электронных пар (теория Гиллеспи)-определяет изменнение форм молекул и искажения углов между связями по сравнению с идеальными за счёт неподелённых электронных пар и кратных связей, взаимное расположение неравноценных атомов и электронных пар.
11. Основные положения мо:
Образование молекул сопровождается формированием МО.
МО образуется из атомных орбиталей
Из каждых двух АО образуются две МО одна – связывающая, другая –разрыхляющая
Энергия связывающей МО меньше энергии разрыхляющей МО.
Основные положения метода МО
В образовании хим.св. могут участвовать как пара, так и один электрон
Состояние электронов в молекулах соответствует принципам min энергии, Паули и Гунда
АО должны быть близкими по энергии
Из n АО образуется n МО
 МОразрs*
МОразрs*
n s(АО)
+ ns(АО)
s(АО)
+ ns(АО)
МОсвязs
 px*
px*
n px(АО)
+ npx(АО)
px(АО)
+ npx(АО)
px
 y*
z*
y*
z*
n pypz(АО)
+ npypz(АО)
pypz(АО)
+ npypz(АО)
yz
С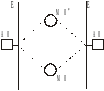 вязывающие
и разрыхляющие МО
вязывающие
и разрыхляющие МО
Для нахождения волновых функций МО используют метод ЛКАО
Из двух перекрывающихся АО образуютсяся две МО
МОсв – min энергия
МОр– max энергия
Энергетическая диаграмма позволяет определить:
Магнитные свойства вещества
Порядок (кратность) связи в молекуле
Порядок связи =(eсвяз - eразр):2
Увеличивается или уменьшается порядок связи при отрыве или присоединении электрона
Изоэлектронные частицы
N2, CO, NO+
имеют одинаковый набор МО, их одинаковую энергетическую последовательность, заселенность электронами и одинаковый порядок связи
12. Водородная связь — форма ассоциации между электроотрицательныматомом и атомом водорода H, связанным ковалентно с другимэлектроотрицательным атомом.
Водородная связь бывает внутримолекулярная (чаще в орг. молекулах) и межмолекулярная (HF, NH3, H2O, H2O2, H2SO4, H3PO4)
Возникает мостиковая связь между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом (N, O, или F) другой молекулы
Свойства водородной связи - направленность и насыщаемость
Энергия водородной связи примерно на порядок ниже энергии хим.связи и в несколько раз выше энергии межмолекулярного взаимодействия

Влияние поляризации на свойства соединений:
растворимость (хуже)
термическая устойчивость (хуже)
окраску
Межмолекулярные взаимодействия
называют силами Ван дер Ваальса
Обеспечивает переход из одного агрегатного состояния в другое, определяет многие физические свойства: Тпл, Ткип, электро- и теплопроводность, твердость, плотность и др.
Три типа межмолекулярных взаимодействий, обусловленных электростатическим притяжением молекул :
Ориентационные силы действуют между близкорасположенными полярными молекулами, противоположно заряженные полюса которых притягиваются друг к другу
Дисперсионное взаимодействие (наиболее универсальное)
Возникает в неполярных молекулах, т.е. возникают мгновенные диполи в результате взаимного притяжения в любой момент времени вследствие несовпадения электрических центров тяжести электронного облака и ядер, вызванного их независимым колебанием.
