
6. Квантовые числа
Четыре квантовых числа описывают состояние электрона в атоме и характеризуют энергию электрона, его спин, форму электронного облака и его ориентацию в пространстве.
При переходе атома из одного состояния в другое происходит перестройка электронного облака, т.е. изменяются значения квантовых чисел, что сопровождается поглощением или испусканием атомом квантов энергии
Главное квантовое число – n
определяет энергию электрона на данном энергетическом уровне, номер уровня и размеры электронных облаков.
Энергия электрона главным образом зависит от расстояния электрона от ядра – чем ближе находится электрон к ядру, тем меньше его энергия.
Главное квантовое число имеет значения ряда целых чисел от 1 до∞.
При значении n = 1 электрон находится на первом энергетическом уровне.
Электрон, находящийся на более удаленном энергетическом уровне, обладает максимальной энергией. Поэтому при переходе электрона с более удаленного энергетического уровня на более близкий выделяются кванты энергии.
Орбитальное квантовое число – L
определяет форму атомнойорбитали (электронного облака), которое имеет значения от 0, 1, 2… до (n– 1).
Каждому значению L, соответствует орбиталь определенной формы
Орбитальное квантовое число принято обозначать буквенными символами:s,p,d,f
для первого уровня (n=1) возможна 1 формаорбитали (s),
для второго уровня (n=2) – две формы орбитали (s, p)
д
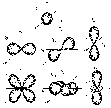 ля
третьего уровня (n=3)
–три формы орбитали (s,
p,
d)
и т.д.
ля
третьего уровня (n=3)
–три формы орбитали (s,
p,
d)
и т.д.
Формы атомных орбиталей
Согласно квантово – механическим расчетам уравнения Шредингера:
s– орбиталь имеет форму шара,
p – орбиталь форму гантели,
d и fорбитали более сложные.
При обозначении электрона главное квантовое число пишут перед символом орбитального квантового числа.
Заполнение атомныхорбиталей электронами, электронные формулы
Заполнение электронами атомных орбиталей и энергетических уровней происходит согласно:
правила Клечковского,
принципа наименьшей энергии,
принципа Паули,
правила Гунда.
Правила Клечковского
Определяют последовательность заполнения орбиталей:
Заполнение энергетических уровней происходит в порядке возрастания суммы чисел (n+l)
При равных значениях (n+l) в первую очередь заполняется состояние с меньшим значением главного квантового числа
Принцип Паули
в атоме не может быть двух электронов у которых были бы одинаковыми все четыре квантовых числа
Правило Гунда
На данном подуровне электроны стремятся занять энергетические состояния таким образом, чтобы суммарный спин был максимальным.
Следствие из принципа Паули
максимально возможное число электронов на каждом энергетическом уровне равно удвоенному значению квадрата главного квантового числа: N = 2n2 ; число подуровней: 2l +1; число электронов на подуровне равно 2(2l +1)
Электронную формулу представляют с помощью двух квантовых чисел.
В электронной формуле главное квантовое число обозначается цифрой, орбитальное буквой, а количество электронов записывается, как показатель степени к орбитальному квантовому числу.
Чтобы записать электронную формулу элемента, находят в периодической системе порядковый номер элемента, который соответствует количеству электронов.
Номер периода говорит о максимальном значении главного квантового числа.
В электронографических формулах каждая орбиталь изображается в виде квадрата и называется квантовой ячейкой, а электроны обозначаются стрелками
Хлор в периодической системе Менделеева находится в 3 периоде, VII группе, главной подгуппе. Заряд ядра атома + 17 Количество протонов 17 Количество электронов 17 Электронная формула 1s2 2s2 2p6 3s2 3p5 Валентные электроны: 3s2 3p5
В невозбужденном состоянии у атома хлора на 3 энергетическом уровне находится один неспаренный электрон, следовательно невозбужденный атом хлора может проявлять валентность 1. Валентность 1 проявляется в следующих соединениях: - газообразный хлор Cl2 (или Сl-Cl) - хлорид натрия NaCl (или Na+ Cl-) - хлороводородHCl (или H-Cl) - хлорноватистая кислота HOCl (или H-O-Cl) В возбужденном сотоянии: 1 ) 3s2 3p5 3d0 + hn --> 3s2 3p4 3d1 3 неспаренных электрона (2 электрона на 3р-подуровне и 1 электрон на 3d-подуровне), следовательно валентность равна 3 Пример соединения: HClO2, Cl2O3 2 ) 3s2 3p4 3d1 + hn --> 3s2 3p3 3d2 5 неспаренных электронов (3 электрона на 3р-подуровне и 2 электрона на 3d-подуровне), следовательно валентность равна 5 Пример соединения: HClO3, Cl2O5 3 ) 3s2 3p3 3d2 + hn --> 3s1 3p3 3d3 7 неспаренных электронов (1 электрон на 3s-подуровне, 3 электрона на 3р-подуровне и 3 электрона на 3d-подуровне), следовательно валентность равна 5 Пример соединения: HClO4, Cl2O
7. свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса
Период — строка периодической системы химических элементов, последовательность атомов по возрастанию заряда ядра и заполнению электронами внешней электронной оболочки
Группа – это совокупность элементов, которые имеют одинаковую высшую валентность в оксидах и в других соединениях. Эта валентность равна номеру группы.
Подгруппы, в которых расположены s- и p-элементы, называют ГЛАВНЫМИ, а подгруппы с d-элементами - ПОБОЧНЫМИ ПОДГРУППАМИ
Периодичность свойств химических элементов и их соединений:
a)Зависимость атомных радиусов (r) от заряда ядра (Z) имеет периодический характер. В пределах одного периода с увеличением Zпроявляется тенденция к уменьшению размеров атомов. Это объясняется увеличением притяжения электронов внешнего слоя к ядру по мере возрастания заряда ядра. В подгруппах сверху вниз атомные радиусы возрастают, т.к. увеличивается число электронных слоев:
б) радиус положительного иона (катиона) всегда меньше, а радиус отрицательного иона (аниона) всегда больше, чем радиус соответствующего электронейтрального атома. В пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра:
в) Электроотрицательность уменьшается сверху вниз по группе и увеличивается слева направо по периоду. Ниже приведеныотносительные электроотрицательности некоторых элементов. Наибольшее значение электроотрицательности имеет фтор, наименьшее – цезий.
8. Химическая связь - это понижение энергии атомов при образовании молекулы.
Энергией химической связи называется энергия которая выделяется при образовании связи или которая затрачивается на ее разрыв.
Длина связи – это расстояние между связанными атомами или между их ядрами.
Валентный угол – это угол между воображаемыми линиями соединяющими центры атомов.
H2O Ð (H-O-H) = 104,50
Типы химических связей:
Ковалентная
а) полярная
б) неполярная
Ионная
Металлическая
Межмолекулярные связи:
а) водородная
б) силы Ван – дер - Ваальса
Донорно-акцепторный механизм образования связи:
связывающие электронные пары образуются объединением пары валентных электронов одного атома (донора) со свободной АО другого атома (акцептора)
Пример:
BF3 + F – = BF4–
ОБМЕННЫЙ МЕХАНИЗМ - в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет в общее пользование по одному электрону:
