
1. Основные классы неорганических соединений: оксиды, кислоты, основания и соли.Оксиды_ - это соединения элементов с кислородом. Кислоты состоят из водорода, способного замещаться металлом, и кислотного остатка, причем число атомов водорода равно валентности кислотного остатка. Примерами кислот могут служить соляная (хлористоводородная) НСl, серная H2SO4, азотная HNO3.Основания состоят из металла и одновалентных гидроксогрупп ОН, число которых равно валентности металла. Примерами оснований могут служить гидроксид натрия NaOH, гидроксид меди Сu(ОН)2.Соли, образованные двумя металлами и одной кислотой, называются двойными солями; соли, образованные одним металлом и двумя кислотами - смешанными солями. Примером двойной соли могут служить алюмокалиевые квасцы, или сульфат калия-алюминия, KAI(SO4)2. Смешанной солью является CaClOCl или (CaOCl2) - кальциевая соль соляной (HCl) и хлорноватистой (HClО) кислот.
Основные оксиды:
1. Основный оксид + кислота → соль + вода
CuO + H2SO4 → CuSO4 + H2O
Примечание: кислота ортофосфорная или сильная.
2. Сильноосновный оксид + вода → щелочь
CaO + H2O → Ca(OH)2.
Кислотные оксиды:
1. Кислотный оксид + вода → кислота
SO3 + H2O → H2SO4
Некоторые оксиды, например SiO2, с водой не вступают в реакцию, поэтому их кислоты получают косвенным путём.
2. Кислотный оксид + основный оксид → соль
CO2 + CaO → CaCO3.
Амфотерные оксиды:
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства:
ZnO + 2HCl → ZnCl2 + H2O
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
ZnO + 2KOH + H2O → K2[Zn(OH)4] (в водном растворе)
ZnO + CaO → CaZnO2 (при сплавлении).
Гидрооксид кислотный:
Важнейшим химическим свойством основных и кислотных гидроксидов является их взаимодействие их между собой с образованием солей (реакция солеобразования), например:
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
Основные гидрооксиды:
N2O5 + 2NaOH = 2NaNO3 + H2O
Гидрооксиды амфотерные:
(а) 2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
2. Эквивалент вещества или Эквивалент — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катионуводорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях[1][2].
Под эквивалентом вещества также часто подразумевается количество эквивалентов вещества или эквивалентное количество вещества — число моль вещества эквивалентное одному моль катионов водорода в рассматриваемой реакции.
Эквивалентная масса — это масса одного эквивалента данного вещества.
Эквивалентная молярная масса вещества
Молярная
масса эквивалентов
обычно обозначается как ![]() или
или ![]() .
Отношение эквивалентной молярной массы
вещества к его собственно молярной
массе называетсяфактором
эквивалентности (обозначается
обычно как
.
Отношение эквивалентной молярной массы
вещества к его собственно молярной
массе называетсяфактором
эквивалентности (обозначается
обычно как ![]() ).
).
Молярная масса эквивалентов вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества.
Mэкв = fэкв×M
2) Молярная масса
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Моль это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро
![]()
Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества. Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar). Например, молярная масса метана CH4 определяется следующим образом:
3. В равных объемах газов (V) при одинаковых условиях (температуре Т и давлении Р) содержится одинаковое число молекул.
Первое следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объём.
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму.
Моль это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро(N=6,022*10^23)
Закон Дюлонга-Пти (Закон постоянства теплоёмкости) — эмпирический закон, согласно которому молярная теплоёмкость твёрдых тел при комнатной температуре близка к 3R:
где R — универсальная газовая постоянная.
Газовые законы:
1.Закон Авагадро
2. Массы равных объемов двух газов должны относится друг к другу как их молярные массы m1/m2=M1/M2
3. Молярная масса газа равна его плотности по отношению к другому газу умноженной на молярную массу второго газа:M1=D*M2
4. Сте́пень окисле́ния (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Степень окисления соответствует заряду иона или формальному заряду атома в молекуле или в химической формальной единице, например:
![]()
Степень окисления указывается сверху над символом элемента. В отличие от указания заряда иона, при указании степени окисления первым ставится знак, а потом численное значение, а не наоборот:
![]() ---
степень
окисления,
---
степень
окисления,
![]() ------
заряды.
(НЕ ПЕРЕПУТАЙТЕ)
------
заряды.
(НЕ ПЕРЕПУТАЙТЕ)
Степень окисления атома в простом веществе равна нулю, например:
Алгебраическая сумма степеней окисления атомов в молекуле всегда равна нулю:
![]()
![]()
Окисление – процесс повышения степени окисления
Восстановление – процесс понижения степени окисления
Атом, находящийся в высшей степени окисления , может быть только окислителем, в низшей только восстановителем, если он обладает промежуточной степенью окисления, то может быть и окислителем, и восстановителем.
Пример: S
Восстановитель:
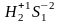 (+1*2+(-2*1))=0
(+1*2+(-2*1))=0
Окислитель:
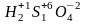
Окислит/Восстановит:
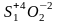
Различают 4 типа О.В.Р
Межмолекулярное окисление-восстановление (Окислит. и восстановит. разные вещ-ва)
Внутримолек-е О.В.Р при которых степень окисления изменяют атомы разных электронов одного и того же вещества

изменяет
степень окисления азот
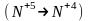 и атом кислорода
и атом кислорода
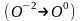 ,
находящийся внутри молекулы
,
находящийся внутри молекулы
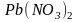
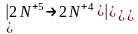

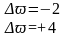
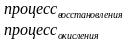
Составляем
уравнение реакции
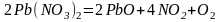
Реакция самоокисления-самовосстановления. В этом случае степень окисления одного и того же элемента и повышается и понижается
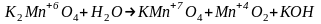 Определим
степени до и после реакции
Определим
степени до и после реакции


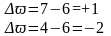
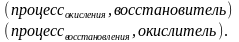
Поскольку
в данной реакции окислителем и
восстановителем выступает одно и то же
вещество
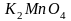 ,
коэффициенты перед ним суммируются.
Записываем уравнение
,
коэффициенты перед ним суммируются.
Записываем уравнение
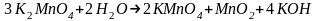
4.
Внутримолекулярные реакции
окисления-восстановления, в которых
происходит выравнивание степеней
окисления атомов одного и того же
элемента, являются процессами
контрдиспропорционирования
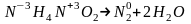
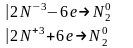
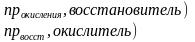
Эквивалентная молярная масса окислителя и восстановителя определяется делением молярной массы на изменение степени окисления( на 1 моль вещества)
