
Khimia_konferents_nedelya
.pdfТеоретические вопросы
1.Классификация неорганических соединений.
2.Основные химические свойства оксидов (на примере реакций).
3.Основные химические свойства гидроксидов, (на примере реакций).
4.Основные химические свойства кислот и солей (на примере реакций).
5.Понятие эквивалента элемента и закон эквивалентов. Расчет молярной массы эквивалента для элементов и соединений (кислоты, основания, соли, окислителя и восстановителя) в реакциях.
6.Понятие степень окисления, правила определения степеней окисления. Окислитель и восстановитель. Типы окислительно-восстановительных реакций.
7.Квантовые числа. Атомные орбитали, энергетические уровни и подуровни. Формы s-p-d- орбиталей. Закономерности формирования электронных оболочек атомов: принцип наименьшей энергии, правила Клечковского, принцип Паули, правило Гунда.
8.Полные электронные формулы атомов и электронографические формулы валентных электронов. Валентные возможности атомов.
9.Периодический закон и система Д.И. Менделеева. Периоды, группы, подгруппы и семейства. Периодичность в изменении атомных радиусов, электроотрицательности элементов, металлических, неметаллических, кислотно –
основных свойств соединений.
10.Основные типы и характеристики связи: энергия связи, длина связи, валентный угол. Взаимосвязь длины и энергии связи в однотипных частицах.
11.Механизм образования ковалентной химической связи: обменный и донорноакцепторный (на примере соединений).
12.Свойства ковалентной связи (направленность, насыщаемость, полярность) Кратность связи. Типы перекрывания атомных орбиталей.
13.Объяснение образования ковалентной связи методом валентных связей (метод ВС на примере любой молекулы или иона), его основные положения.
14. Гибридизация. Основные типы гибридизации. Изменение формы молекул при наличии у центрального атома несвязывающих электронных пар, их объяснение методом отталкивания электронных пар валентной оболочки.
15.Способы выражения концентраций растворов.
Практические вопросы 1.Что такое ангидрид кислоты? Какими свойствами он обладает? Напишите
формулы ангидридов кислот:H2SO4, HNO3, H3PO4, HClO3, HMnO4.
2.Определите формулу соединения, содержащего 80% углерода и 20% водорода, относительная плотность которого по водороду равна 15. Какие законы химии вы используете для расчетов.
3.Какая масса известняка, содержащего 85% СаСО3, потребуется для получения 571,2 л СО2 (н.у.). Какие законы химии вы использовали для расчетов?
4.Атомный номер элемента 55, атомная масса 133. Укажите число протонов, электронов, нейтронов, атомный номер элемента, число неспаренных электронов, семейство элементов. Напишите полную электронную, электронографическую формулу валентных электронов. Какую информацию можно получить еще, зная атомный номер элемента?
5.Какую массу железа можно получить из 2 т руды, содержащей 94% Fe2O3. Составьте уравнение реакции. Как называется такой метод? Какие законы химии вы использовали для расчетов?
6.Как изменяются свойства атомов в периодической системе элементов? Ответ поясните на примерах элементов одного периода и группы.
7.У какой группы частиц электронные формулы одинаковые. Ответ поясните.
1) Sn Sn2+ Sn4+ |
2) F Cl Br I 3) O2- F- Ne N3- 4_Li+ Na+ K+ |
8.Уравняйте реакцию MnO2 + KClO3 +KOH → K2MnO4 + KCl + H2O
9.Уравняйте реакцию: HgS + HNO3 + HCl → HgCl2 + S + NO + H2O
10.Составить схему ВС для иона NH4+, указать тип гибридизации АО в нем, геометрическую форму.
11.Объяснить валентные возможности элементов 7 группы главной подгруппы.
12.Объяснить валентные возможности элементов 6 группы главной подгруппы.
13. Составить схему ВС для молекулы воды, указать тип гибридизации АО в молекуле этого вещества, геометрическую форму.
14. Составить схему ВС для иона BF4-, указать тип гибридизации АО в нем, геометрическую форму. Возможно ли существование иона BF5-?
15. Составить диаграмму МО для молекулы кислорода, указать порядок связи в молекуле.
16. Составить диаграмму МО для молекулы азота и частицы He2-, указать порядок связи в молекуле и частице. Возможно ли существование этой частицы?

1)Классификация неорганических соединений.
Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ.
Сложные вещества (или химические соединения). Молекулы состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.
Металлы – группа элементов, обладающая характернымиметаллическим твёрдые вещества (исключение составляет аллическртуть)иймеютблеск,мет являю хорошими проводниками теплоты и электричества, ковкиеалюминий(железо (F (Al), ртуть(Hg), золото (Au),(Ag)сереброи др.).
Неметаллы – группа элементов: твёрдые, жидкие (бром) и газообразны необладают металлическим блеском, являются изоляторы, хрупкие.
А сложные вещества в свою очередь подразделятся на четыре группы, или класса: оксиды, основания, кислоты и соли.
2) ОКСИДЫ. КЛАССИФИКАЦИЯ. ПОЛУЧЕНИЕ. СВОЙСТВА.
Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, со степенью окисления -2.
(Лишь один химический элемент - фтор, соединяясь с кислородом, образует не оксид, а фторид кислорода OF2. )
Формула |
|
Название |
|
Формула |
|
Название |
CO |
|
оксид углерода ( II ) |
|
Fe2O3 |
|
оксид железа (III ) |
NO |
|
оксид азота ( II ) |
|
CrO3 |
|
оксид хрома (VI ) |
N2O5 |
|
оксид азота (V ) |
|
Mn2O7 |
|
оксид марганца (VII ) |
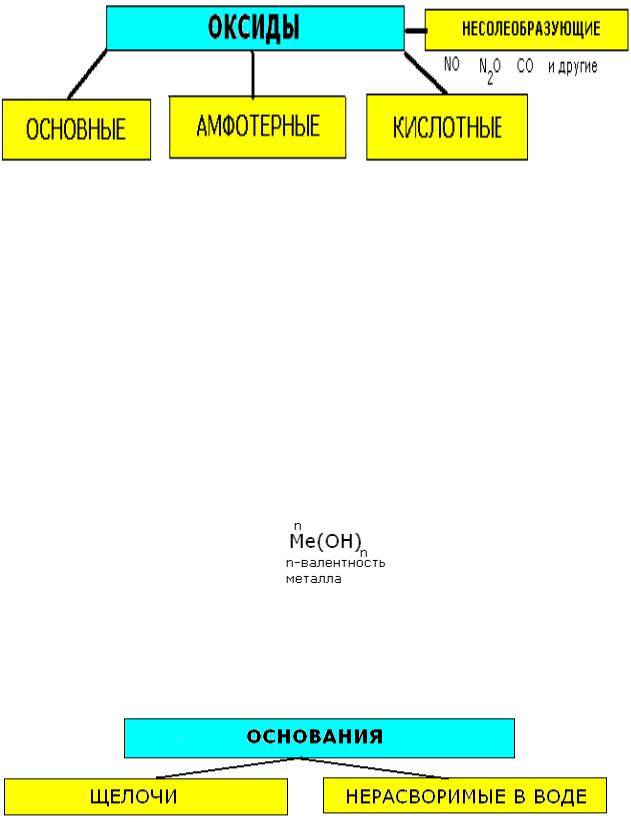
Классификация
Косновным относятся оксиды металлов главных подгрупп I-II групп, а также металлы побочных подгрупп со степенью окисления +1 и +2 (кроме цинка и беррилия).
Ккислотным относят оксиды неметаллов, кроме несолеобразующих, а также оксиды металлов побочных подгрупп со степенью окисления от+5 до +7 ( CrO3-оксид хрома (VI), Mn2O7 - оксид марганца (VII)).
Камфотерным относятся оксиды металлов главных и побочных подгрупп со степенью окисления +3, иногда +4, а также цинк и бериллий.
Т.е. характер свойств оксидов в первую очередь зависит от степени окисления.
Например оксиды хрома CrO(+2 - основный)->Cr 2O3(+3 - амфотерный)->CrO3(+6 - кислотный).
3)ОСНОВАНИЯ. КЛАССИФИКАЦИЯ. ПОЛУЧЕНИЕ. СВОЙСТВА.
Основания - это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксогруппами-ОН. Общая формула:
Формула |
|
Название |
|
Формула |
|
Название |
LiOH |
|
гидроксид лития |
|
Ca(OH)2 |
|
гидроксид кальция |
NaOH |
|
гидроксид натрия |
|
Cu(OH)2 |
|
гидроксид меди(II) |
KOH |
|
гидроксид калия |
|
Fe(OH)2 |
|
гидроксид железа(III) |
К щёлочам относятся гидроксиды металлов подгрупп Iа и IIа (начиная с кальция) Примеры:
(LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Нерастворимые по таблице растворимости;
Амфотерные гидроксиды со степенью окисления -3 + ZN и Be
Получение оснований.

|
1.Металл+вода |
2Na+H2O=2NaOH+H2 |
|
|
Ba+2H2O=Ba(OH)2+H2 |
||
|
|
||
Щелочи |
2.Оксид+вода |
Li2O+H2O=2LiOH |
|
CaO+H2O=Ca(OH)2 |
|||
|
3.Электролиз растворов |
||
|
2NaCl+2H2O=2NaOH+Cl2+H2 |
||
|
щелочных металлов |
||
|
|
||
|
|
|
|
Нерастворимые |
Соль+щелочь |
CuSO4+2NaOH=Cu(OH)2+Na2SO4 |
|
основания |
|||
|
|
3)КИСЛОТЫ. КЛАССИФИКАЦИЯ. ПОЛУЧЕНИЕ. СВОЙСТВА.
Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков.
Классификация кислот. По составу: бескислородные и кислородсодержащие.
2.По числу атомов водорода, способных замещаться на металл: одно-, двух-, трёхосновные...
Бескислородные: |
|
Название соли |
|
HCl - хлористоводородная (соляная) |
одноосновная |
хлорид |
|
HBr – бромистоводородная |
одноосновная |
бромид |
|
|
|
|
|
HI – йодистоводородная |
одноосновная |
йодид |
|
HF - фтористоводородная (плавиковая) |
одноосновная |
фторид |
|
H2S – сероводородная |
двухосновная |
сульфид |
|
|
|
|
|
Кислородсодержащие: |
|
|
|
HNO3 – азотная |
одноосновная |
нитрат |
|
H2SO3 |
– сернистая |
двухосновная |
сульфит |
H2SO4 |
– серная |
двухосновная |
сульфат |
H2CO3 – угольная |
двухосновная |
карбонат |
|
H2SiO3 – кремниевая |
двухосновная |
силикат |
|
H3PO4 |
– ортофосфорная |
трёхосновная |
ортофосфат |
|
|
|
|
Соли - сложные вещества, которые состоят из атомов металла и кислотных остатков. Это наиболее многочисленный класс неорганических соединений.
Классификация
СОЛИ
Средние
Кислые
Основные
Двойные
Смешанные
Комплексные

1.Средние (нормальные) соли — продукты замещения всех катионов водорода в молекулах кислоты на катионы металла (Na2CO3, K3PO4).
2.Кислые соли — продукты частичного замещения катионов водорода в кислотах на катионы металла (NaHCO3, K2HPO4). Они образуются при нейтрализации основания избытком кислоты (то есть в условиях недостатка основания или избытка кислоты).
3.Осно́вные соли — продукты неполного замещения гидроксогрупп основания (OH-) кислотными остатками ((CuOH)2CO3). Они образуются в условиях избытка основания или недостатка кислоты.
По числу присутствующих в структуре катионов и анионов выделяют следующие типы солей[7]:
1.Простые соли — соли, состоящие из одного вида катионов и одного вида анионов
(NaCl)
2.Комплексные — соли, содержащие два различных катиона (KAl(SO4)2·12 H2O).
3.Смешанные соли — соли, в составе которых присутствует два различных аниона
(Ca(OCl)Cl).

2. Основные химические свойства оксидов (на примере реакций).
Химические свойства оксидов. |
|
|
|||
|
|
|
|
|
|
|
Основные |
|
Амфотерные |
|
Кислотные |
|
Основные-реагируют с |
|
Амфотерные (ZnO, Al2O3,Cr2O3, |
|
Кислотные-реагируют с |
|
избытком кислоты с |
|
MnO2 ) |
|
избытком щелочи с |
|
образованием соли и |
|
1.Взаимодействуют как с |
|
образованием соли и |
|
воды.Основным оксидам |
|
кислотами, так и с основаниями. |
|
воды. Кислотным |
|
соответствуют |
|
ZnO+2HCl=ZnCl2+H2O |
|
оксидам часто |
|
основания. |
|
ZnO+2NaOH+H2O=Na2[Zn(OH)4] |
|
соответствуют кислоты. |
|
1.Взаимодействие с |
|
|
|
1.Большинство |
|
водой(оксиды щелочных 2.Реагируют с основными и |
|
взаимодействуют с |
||
|
и щелочноземельных |
|
кислотными оксидами |
|
водой |
|
мет.) |
|
ZnO+CaO=CaZnO2 |
|
SO3+H2O=H2SO4 |
|
CaO+H2O=Ca(OH)2 |
|
ZnO+SiO2=ZnSiO3 |
|
|
|
2.Все-с кислотами |
|
|
|
2.Со щелочами |
|
AI2O3+6HCl=2AlCl3+3H2 |
|
|
|
NaOH+SiO2=Na2SiO3+H2 |
|
O |
|
|
|
O |
|
3.С кислотнями |
|
|
|
|
|
оксидами |
|
|
|
3.С основными оксидами |
|
CaO+CO2=CaCO3 |
|
|
|
SiO2+CaO=CaSiO3 |
|
4.С амфотерными |
|
|
|
|
|
оксидами |
|
|
|
4.С амфотерными |
|
Li2O+Al2O3=2LiAlO2 |
|
|
|
оксидами |
|
|
|
|
|
Al2O3+3SO3=Al2(SO4)3 |
3) Основные химические свойства гидроксидов, (на примере реакций).
3 Химические свойства оснований.
Щёлочи |
|
Нерастворимые основания |
1.Взаимодействие с кислотами |
||
KOH+HCl=KCl+H2O |
|
Cu(OH)2+2HCl=CuCl2+2H2O |
2.Взаимодействие с кислотными оксидами |
||
2KOH+CO2=K2CO3+H2O |
|
не характерны |
3.Действие индикаторов |
||
лакмус-синяя, фенолфталеин- |
|
окраска не изменяется |
малиновая |
|
|
|
|
|
4.Взаимодействие с амфотерными оксидами |
||
2KOH+ZnO=K2ZnO2+H2O |
|
не реагируют |
5.Взаимодействие с солями, если образуется малорастворимая соль или малорастворимое основание
NaOH+CuCl2=Cu(OH)2=2NaCl |
не реагируют |
6.При нагревании |
|
не разлагаются(кроме LiOH) |
Cu(OH)2=CuO+H2O |
Амфотерные гидроксиды( Al(OH)3, Zn(OH)2, Be(OH)2, Fe(OH)3 и другие.
Взаимодействуют с кислотами |
Взаимодействуют с щелочами |
Zn(OH)2+2HCl=ZnCl2+2H2O |
Al(OH)3+NaOH=Na[Al(OH)4] |

4 )Основные химические свойства кислот и солей (на примере реакций).
Химические свойства. Действие на индикаторы.
лакмус - красный метилоранж – розовый
|
Кислородсодержащие |
Бескислородные |
|
1.Изменяют окраску индикаторов
лакмус-красный, метилоранж-красный ( только для растворимых кислот)
2.Взаимодействие с металлами, стоящими до водорода
|
H2SO4+Ca=CaSO4+H2 |
|
2HCl+Ca=CaCl2+H2 |
|
|
|
2.Взаимодействие с основными оксидами |
|
|||
|
H2SO4+CaO=CaSO4+H2O |
|
2HCl+CaO=CaCl2+H2O |
|
|
|
3.Взаимодействие с основаниями |
(реакция нейтрализации) |
|
|
|
|
H2SO4+Ca(OH)2=CaSO4+2H2O |
|
2HCl+Ca(OH)2=CaCl2+2H2O |
|
|
|
4.Взаимодействие с амфотерными оксидами |
|
|||
|
H2SO4+ZnO=ZnSO4+H2O |
|
2HCl+ZnO=ZnCl2+H2O |
|
|
5.Взаимодействие с солями, если образуется малорастворимое, летучее или малодиссоциирующее вещество
|
H2SO4+BaCl2=BaSO4+2HCl |
|
2HCl+Na2CO3=2NaCl+H2O+CO2 |
|
|
|
6.При нагревании |
|
|
|
Слабые кислоты легко разлагаются |
H2S=H2+S |
|
|
|
H2SiO3=H2O+SiO2 |
|
|
|
|
|
|
|
|
Химические свойства солей.
|
Разложение при прокаливании |
|
CaCO3=CaO+CO2 |
|
Cоль+металл |
|
Fe+CuSO4=FeSO4+Cu |
|
Соль+соль |
|
AgNO3+NaCl=AgCl +NaNO3 |
|
Соль+щелочь |
|
CuSO4+2NaOH=Cu(OH)2 +Na2SO4 |
|
Соль+кислота |
|
Na2CO3+2HCl=2NaCl+H2O+CO2 |
|
|
Средние соли |
|
1. |
Термическое разложение. |
|
|
CaCO3 CaO + CO2 |
|
|
|
2Cu(NO3)2 2CuO + 4NO2 + O2 |
|
|
|
NH4Cl NH3 + HCl |
|
|
|
2. |
Гидролиз. |
|
|
Al2S3 + 6H2O 2Al(OH)3 + 3H2S
FeCl3 + H2O Fe(OH)Cl2 + HCl
Na2S + H2O NaHS +NaOH
3.Обменные реакции с кислотами, основаниями и другими солями.
AgNO3 + HCl AgCl + HNO3
Fe(NO3)3 + 3NaOH Fe(OH)3 + 3NaNO3 CaCl2 + Na2SiO3 CaSiO3 + 2NaCl
4.Окислительно-восстановительные реакции, обусловленные свойствами
катиона или аниона.
2KMnO4 + 16HCl 2MnCl2 + 2KCl + 5Cl2 + 8H2O

Кислые соли получение
1.Взаимодействие кислоты с недостатком основания.
KOH + H2SO4 KHSO4 + H2O
2.Взаимодействие основания с избытком кислотного оксида
Ca(OH)2 + 2CO2 Ca(HCO3)2
3.Взаимодействие средней соли с кислотой
Ca3(PO4)2 + 4H3PO4 3Ca(H2PO4)2
Химические свойства.
1.Термическое разложение с образованием средней соли
Ca(HCO3)2 CaCO3 + CO2 + H2O 2. Взаимодействие со щёлочью. Получение средней соли.
Ba(HCO3)2 + Ba(OH)2 2BaCO3 + 2H2O
Основные соли
Получение
1.Гидролиз солей, образованных слабым основанием и сильной кислотой
ZnCl2 + H2O [Zn(OH)]Cl + HCl
2.Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов
AlCl3 + 2NaOH [Al(OH)2]Cl + 2NaCl
3.Взаимодействие солей слабых кислот со средними солями
2MgCl2 + 2Na2CO3 + H2O [Mg(OH)]2CO3 + CO2 + 4NaCl
Химические свойства.
1.Термическое разложение.
[Cu(OH)]2CO3(малахит) 2CuO + CO2 + H2O 2. Взаимодействие с кислотой: образование средней соли.
Sn(OH)Cl + HCl SnCl2 + H2O
Комплексные соли
Химические свойства.
1.Разрушение комплексов за счёт образования малорастворимых соединений:
2[Cu(NH3)2]Cl + K2S CuS + 2KCl + 4NH3
2.Обмен лигандами между внешней и внутренней сферами.
K2[CoCl4] + 6H2O [Co(H2O)6]Cl2 + 2KCl
5) Понятие эквивалента http://onx.distant.ru/posobie-2/02/02.htm
Эквивалент – это реальная или условная частица, которая в кислотно-основных
реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительновосстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества.
Молярной массой эквивалента (Mэкв.) вещества называется выраженная в граммах масса одного моля эквивалента этого вещества, т.е. это масса количества вещества эквивалентов равного числу Авогадро

Химическое количество эквивалентов вещества – количество молярных масс эквивалентов вещества (nэкв.) равно массе вещества (m) деленной на молярную массу эквивалентов этого вещества (Mэкв): nэкв. = m/Mэкв.
Фактор эквивалентности fэкв. — это число, которое обозначает, какая доля реальной частицы эквивалентна одному иону Н+ в данной кислотно-основной реакции, одному электрону в данной ОВР или одной единице заряда в данной реакции обмена. Фактор эквивалентности – это число, на которое необходимо умножить молярную массу вещества, чтобы получить молярную массу эквивалента этого вещества: Мэкв. = М . fэкв.
Закон эквивалентов: вещества реагируют в количествах, пропорциональных их эквивалентам. Если взято n(экв1) моль эквивалентов одного вещества, то столько же моль эквивалентов другого вещества n(экв2) потребуется в данной реакции, т.е.
|
|
|
|
|
|
n(экв1) = n(экв2) |
(2.1) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 1.1 – Расчет фактора эквивалентности |
|
|||
|
|
|
|
|
|
|
|
|
||
|
Частица |
|
|
|
Фактор эквивалентности |
|
|
Примеры |
||
|
Элемент |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
|
|
|
|
|
|
|
|
|
где В(Э) – валентность элемента |
|
|
|
|
|
|
Простое |
|
|
|
|
|
|
fЭ(H2) = 1/(2 1) = 1/2; |
||
|
вещество |
|
|
|
|
|
|
fЭ(O2) = 1/(2 2) = 1/4; |
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
, |
|
|
fЭ(Cl2) = 1/(2 1) = 1/2; |
|
|
|
|
|
|
где n(Э) – число атомов элемента (индекс в химической |
|
fЭ(O3) = 1/(3 2) = 1/6 |
|||
|
|
|
|
|
формуле), В(Э) – валентность элемента |
|
|
|
|
|
|
Оксид |
|
|
|
|
|
|
fЭ(Cr2O3) = 1/(2 3) = 1/6; |
||
|
|
|
|
|
|
|
|
|
fЭ(CrO) = 1/(1 2) = 1/2; |
|
|
|
|
|
|
|
, |
|
|
fЭ(H2O) = 1/(2 1) = 1/2; |
|
|
|
|
|
|
где n(Э) – число атомов элемента (индекс в химической |
|
fЭ(P2O5) = 1/(2 5) = 1/10 |
|||
|
|
|
|
|
формуле оксида), В(Э) – валентность элемента |
|
|
|
|
|
|
Кислота |
|
|
|
|
|
|
fЭ(H2SO4) = 1/1 = 1 (основность равна 1) |
||
|
|
|
|
|
|
|
|
|
или |
|
|
|
|
|
|
|
, |
|
|
fЭ(H2SO4) = 1/2 |
|
|
|
|
|
|
где n(H+) – число отданных в ходе реакции ионов |
|
|
(основность равна 2) |
||
|
|
|
|
|
водорода (основность кислоты) |
|
|
|
|
|
|
Основание |
|
|
|
|
|
|
fЭ(Cu(OH)2) = 1/1 = 1 (кислотность равна 1) или |
||
|
|
|
|
|
|
|
|
|
fЭ(Cu(OH)2) = 1/2 |
|
|
|
|
|
|
|
, |
|
|
(кислотность равна 2) |
|
|
|
|
|
|
где n(ОH–) – число отданных в ходе реакции гидроксид- |
|
|
|
||
|
|
|
|
|
ионов (кислотность основания) |
|
|
|
|
|
|
Соль |
|
|
|
|
|
|
fЭ(Cr2(SO4)3)=1/(23)=1/6 (расчет по металлу) или |
||
|
|
|
|
|
|
|
|
|
fЭ(Cr2(SO4)3)=1/(32)=1/6 (расчет по кислотному |
|
|
|
|
|
|
|
, |
|
|
остатку) |
|
|
|
|
|
|
где n(Ме) – число атомов металла (индекс в химической |
|
|
|
||
|
|
|
|
|
формуле соли), В(Ме) – валентность металла; n(А) – |
|
|
|
|
|
|
|
|
|
|
число кислотных остатков, В(А) – валентность |
|
|
|
|
|
|
|
|
|
|
кислотного остатка |
|
|
|
|
|
|
Частица в |
|
|
|
|
|
|
Fe2+ + 2 Fe0 |
||
|
окислительно- |
|
|
|
|
|
|
|||
|
|
|
|
|
|
2+ |
|
|||
|
восстано- |
|
|
|
, |
|
|
fЭ(Fe ) =1/2; |
||
|
|
|
|
|
|
|
|
|||
|
вительных |
|
|
|
|
|
MnO4– + 8H+ + 5 Mn2+ + 4H2O |
|||
|
|
|
где |
– число электронов, участвующих в процессе |
|
|||||
|
реакциях |
|
|
|
||||||
|
|
|
|
fЭ(MnO4–) = 1/5 |
||||||
|
|
|
окисления или восстановления |
|
|
|||||
|
|
|
|
|
|
|
||||
|
Ион |
|
|
|
|
|
|
fЭ(SO42–) = 1/2 |
||
|
|
|
|
|
|
, |
|
|
|
|
|
|
|
|
|
где z – заряд иона |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
