
- •Основные положения молекулярно-кинетической теории вещества. Газы, жидкости и твердые тела. Статистический и термодинамический методы исследования.
- •Термодинамические параметры. Состояние термодинамического равновесия. Уравнения состояния термодинамической системы.
- •3. Кинетическая теория идеального газа. Основные законы классической статистики. Основное ур-ие кинетической теории идеального газа. Статистический смысл термодинамической температуры.
- •4. Равновесное распределение молекул в потенциальном поле. Барометрическая формула. Статистическое распределение Больцмана.
- •5. Функция распределения. Распределение Максвелла молекул газа по скоростям. Наиболее вероятная, средняя и средняя квадратичная скорости теплового движения молекул.
- •11.Применение первого начала термодинамики к изопроцессам в идеальном газе.
- •12.Адиабатический процесс. Уравнение Пуассона и показатель адиабаты. Термодинамические функции состояния.
- •13. Круговые процессы. Обратимые и необратимые процессы. Тепловая машина. Кпд теплового двигателя.
- •14. Обратимый цикл Карно. Теорема Карно. Кпд реальной тепловой машины.
- •15. Понятие энтропии. Изменение энтропии в однонаправленных процессах. Второе начало термодинамики. Третье начало термодинамики.
- •16. Силы межмолекулярного взаимодействия в реальном газе. Уравнение Ван-дер-Ваальса. Внутренняя энергия реального газа.
- •19. Поверхностное натяжение жидкости. Коэффициент поверхностного натяжения. Силы поверхностного натяжения. Внутреннее дополнительное давление в жидкости. Явление смачивания.
16. Силы межмолекулярного взаимодействия в реальном газе. Уравнение Ван-дер-Ваальса. Внутренняя энергия реального газа.
При рассмотрении реальных газов — газов, свойства которых зависят от взаимодействия молекул, надо учитывать силы межмолекулярного взаимодействия. Они проявляются на расстояниях £ 10–9 м и быстро убывают при увеличении расстояния между молекулами. Такие силы называются короткодействующими.
В основе межмолекулярного взаимодействия лежат силы электромагнитной природы, эти силы на
малых расстояниях имеют характер отталкивания, а на больших – характер притяжения. Впервые
взаимодействие между атомами и молекулами рассматривал и учитывал при определении уравнения состояния реального газа И. Ван-дер-Ваальс (Иоханнес Дидерик Ван дер Ваальс, нидерландский физик, 1837–1923, Нобелевская премия в 1910 г. за работы, содержащие уравнения агрегатных состояний газов и жидкостей), поэтому межмолекулярное взаимодействие часто называют взаимодействием Ван-дер-Ваальса.
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа
Ван-дер-Ваальса оно имеет вид:
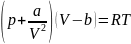
где
p— давление,
V— молярный объём,
T— абсолютная температура,
R— универсальная газовая постоянная.
Для ![]() молей
газа Ван-дер-Ваальса уравнение состояния
выглядит так:
молей
газа Ван-дер-Ваальса уравнение состояния
выглядит так:
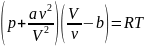
где
V— объём,
Внутренняя энергия газа Ван-дер-Ваальса складывается из его кинетической энергии (энергии теплового движения молекул) и только что нами посчитанной потенциальной. Так, для одного моль газа:
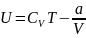
где Cv— молярная теплоёмкость при постоянном объёме, которая предполагается не зависящей от температуры.
17. Изотермы реального газа. Критические параметры. Фазовые переходы реального газа. Насыщенный пар и его зависимость от температуры. Критическая температура. Конденсированное состояние.
Изотермы
С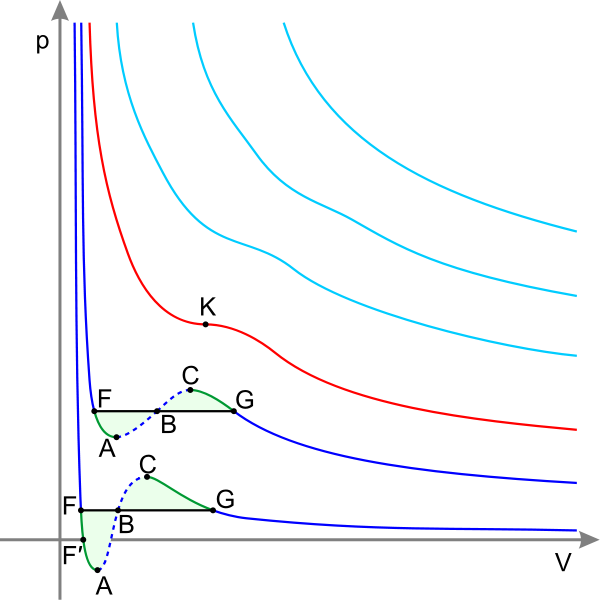 иние
— изотермы при температуре ниже
критической. Зелёные участки на них
— метастабильные
состояния.
Участок
левее точки F — нормальная жидкость.
Точка
F — точка
кипения.
Прямая
FG — равновесие жидкой и газообразной
фазы.
Участок
FA — перегретая
жидкость.
Участок
F′A — растянутая
жидкость (p<0).
Участок
AC — аналитическое
продолжение изотермы,
физически невозможен.
Участок
CG — переохлаждённый
пар.
Точка
G — точка
росы.
Участок
правее точки G — нормальный газ.
Площади
фигуры FAB и GCB равны.
Красная
— критическая
изотерма.
K
— критическая
точка.
Голубые
— сверхкритические изотермы
иние
— изотермы при температуре ниже
критической. Зелёные участки на них
— метастабильные
состояния.
Участок
левее точки F — нормальная жидкость.
Точка
F — точка
кипения.
Прямая
FG — равновесие жидкой и газообразной
фазы.
Участок
FA — перегретая
жидкость.
Участок
F′A — растянутая
жидкость (p<0).
Участок
AC — аналитическое
продолжение изотермы,
физически невозможен.
Участок
CG — переохлаждённый
пар.
Точка
G — точка
росы.
Участок
правее точки G — нормальный газ.
Площади
фигуры FAB и GCB равны.
Красная
— критическая
изотерма.
K
— критическая
точка.
Голубые
— сверхкритические изотермы
Критические параметры.
Критические температура и давление. Газы могут быть превращены в жидкость сжатием при условии, что температура не превышает определенного для каждого газа значения. Температура, при которой и выше которой данный газ не может быть сжижен никаким повышением давления, называется критической Ткр. Давление, при котором и выше которого повышением температуры нельзя испарить жидкость, называется критическим ркр. Объем газа, соответствующий критической температуре, называется критическим Vкр, а состояние газа, отвечающее критической температуре, критическому давлению и критическому объему, — критическим состоянием газа. При критическом состоянии плотность пара становится равной плотности жидкости
Фазовые переходы. Насыщенный пар и его зависимость от температуры.
Переход из одного состояния вещества в другое называется фазовым переходом. Испарение и конденсация являются примерами фазовых переходов.
Все реальные газы (кислород, азот, водород и т. п.) при определенных условиях способны превращаться в жидкости. Однако такое превращение может происходить только при температурах ниже определенной, так называемой критической температурыTкр. Например, для воды критическая температура равна 647,3 K, для азота 126 K, для кислорода 154,3 K. При комнатной температуре (≈ 300 K) вода может находиться и в жидком, и в газообразном состояниях, а азот и кислород существуют только в виде газов.
Испарением называется фазовый переход из жидкого состояния в газообразное. С точки зрения молекулярно-кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, т. е. к охлаждению жидкости (если нет подвода энергии от окружающих тел).
Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость.
В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, т. е. когда скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной. Пар, находящийся в равновесии со своей жидкостью, называют насыщенным.
Число молекул, вылетающих с единицы площади поверхности жидкости за одну секунду, зависит от температуры жидкости. Число молекул, возвращающихся из пара в жидкость, зависит от концентрации молекул пара и от средней скорости их теплового движения, которая определяется температурой пара. Отсюда следует, что для данного вещества концентрация молекул пара при равновесии жидкости и ее пара определяется их равновесной температурой. Установление динамического равновесия между процессами испарения и конденсации при повышении температуры происходит при более высоких концентрациях молекул пара. Так как давление газа (пара) определяется его концентрацией и температурой, то можно сделать вывод: давление насыщенного пара p0 данного вещества зависит только от его температуры и не зависит от объема. Поэтому изотермы реальных газов на плоскости (p, V) содержат горизонтальные участки, соответствующие двухфазной системе.
При повышении температуры давление насыщенного пара и его плотность возрастают, а плотность жидкости уменьшается из-за теплового расширения. При температуре, равной критической температуре Tкр для данного вещества, плотности пара и жидкости становятся одинаковыми. При T > Tкр исчезают физические различия между жидкостью и ее насыщенным паром.
Критическая температура— такая температура, при которой плотность и давление насыщенного пара становится максимальными, а плотность жидкости, находящейся в динамическом равновесии с паром, становится минимальной.
Конденсированное состояние вещества, твёрдое и жидкое состояния вещества. В отличие от газообразного состояния, у вещества в конденсированном состоянии существует упорядоченность в расположении частиц (ионов, атомов, молекул). Кристаллические твёрдые тела обладают высокой степенью упорядоченности — дальним порядком в расположении частиц. Частицы жидкостей и аморфных твёрдых тел располагаются более хаотично, для них характерен ближний порядок. Свойства веществ в конденсированном состоянии определяются их структурой и взаимодействием частиц
18 .Возникновение жидкого и твердого состояния из газа. Агрегатное состояние вещества как следствие соотношения его потенциальной и кинетической энергии. Испарение и кипение жидкости. Зависимость температуры кипения от давления. Фазовые равновесия и фазовые переходы. Уравнение Клапейрона-Клаузиуса. Тройная и критическая точки.
Испарение и кипение жидкости
Кипе́ние — процесс парообразования в жидкости (переход вещества из жидкого в газообразное состояние), с возникновением границ разделения фаз. Температура кипения при атмосферном давлении приводится обычно как одна из основных физико-химических характеристик химически чистого вещества.
Кипение является фазовым переходом первого рода. Кипение происходит гораздо более интенсивно, чем испарение с поверхности, из-за образования очагов парообразования, обусловленных как достигнутой температурой кипения, так и наличием примесей.
На процесс образования пузырьков можно влиять с помощью давления, звуковых волн, ионизации. В частности, именно на принципе вскипания микрообъёмов жидкости от ионизации при прохождении заряженных частиц работает пузырьковая камера.
Испаре́ние — процесс перехода вещества из жидкого состояния в газообразное (пар). Процесс испарения является обратным процессу конденсации (переход из парообразного состояния в жидкое. Испарение(парообразование), переход вещества из конденсированной (твердой или жидкой) фазы в газообразную (пар); фазовый переход первого рода.
Существует более развёрнутое понятие испарения в высшей физике.
Испаре́ние — это процесс, при котором с поверхности жидкости или твёрдого тела вылетают (отрываются) частицы (молекулы, атомы), при этом Ek > Eп.
Зависимость температуры кипения от давления
Из приведенных рассуждений видно, что с уменьшением внешнего давления должна понижаться и температура кипения жидкости.
Принято считать, что точке кипения воды при нормальном атмосферном давлении соответствует температура 100º С. Однако жителям высокогорных селений хорошо известен факт закипания воды при значительно более низкой температуре. Так на вершине Эльбруса вода закипает уже при 82º С. Физическим фактором, ответственным за изменение температуры кипения, является уменьшение внешнего давления в высокогорных районах. Вода кипит при 100º С только при давлении 760 мм Hg. При давлении 0,5 атм она закипает при 82º С, а при давлении 10-15 мм Hg вода закипает в интервале температур 10-15º С. Можно получить даже "кипяток", имеющий температуру замерзающей воды. Для этого придется понизить внешнее давление до 4,6 мм Hg.
Отмечая факт понижения температуры кипения с уменьшением давления, естественно ожидать, что с повышением давления температура кипения будет повышаться. Действительно, при давлении 15 атм кипение воды начинается при 200º С, а давление в 80 атм вызывает кипение воды даже при 300º С. Итак, определенному внешнему давлению соответствует своя температура кипения, или каждой температуре кипения соответствует вполне определенное давление. Напомним, что это давление называется упругостью пара (кипение начинается, когда упругость насыщенного пара внутри пузырьков жидкости равна внешнему давлению).Упругость пара с изменением температуры меняется очень быстро, а температура кипения с изменением давления - довольно медленно.
Фазовые равновесия и фазовые переходы
Фазовое равновесие, сосуществование термодинамически равновесных фаз гетерогенной системы. Является одним из основных случаев термодинамического равновесия и включает в себя условия равенства температуры всех частей системы (термическое равновесие), равенства давления во всем объеме системы (механическое равновесие) и равенство химических потенциалов каждого компонента во всех фазах системы, что обеспечивает равновесное распределение компонентов между фазами. Число фаз f, находящихся одновременно в равновесии, связано с числом компонентов k, числом n независимых параметров, определяющих состояние системы (обычно, когда учитывается только влияние температуры и давления, n = 2), и числом термодинамических степеней свободы v уравнением: v = k + 2 - f (см. Фаз правило).
В общем виде условие фазовое равновесие, согласно принципу равновесия Гиббса, сводится к максимуму энтропии Sсистемы при постоянстве внутренней энергии U, общего объема V и числа молей каждого компонента ni-. Этот принцип можно выразить также как условие минимума любого из термодинамических потенциалов: внутренней энергии U, энтальпии H, энергии Гиббса G, энергии Гельмгольца А при условии постоянства соответствующих параметров состояния, включая число молей каждого компонента. возможны 4 вида двухфазных равновесий: жидкость - пар, кристалл - пар, кристалл - жидкость и кристалл - кристалл; 4 вида трехфазных равновесий: кристалл - жидкость - пар, кристалл - кристалл - жидкость, кристалл - кристалл - пар и кристалл - кристалл - кристалл; при этом не учитывается возможность образования жидких кристаллов
Фазовые переходы, переходы вещества из одной фазы в другую при изменении параметров состояния, характеризующих термодинамическое равновесие. Значение температуры, давления или какой-либо другой физической величины, при котором происходят фазовые переходы в одно-компонентной системе, называют точкой перехода. При фазовых переходах I рода свойства, выражаемые первыми производными энергии Гиббса G по давлениюр, т-ре Т и другим параметрам, меняются скачком при непрерывном изменении этих параметров. При этом выделяется или поглощается теплота перехода
. Уравнение Клапейрона-Клаузиуса
Уравнение
Клапейрона — Клаузиуса — термодинамическое уравнение,
относящееся к квазистатическим (равновесным)
процессам перехода вещества
из одной фазы в
другую (испарение, плавление, сублимация,
полиморфное превращение и др.). Согласно
уравнению, теплота фазового перехода
(например, теплота
испарения, теплота
плавления) при квазистатическом
процессе определяется выражением
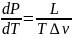 где L—
удельная теплота фазового перехода,
где L—
удельная теплота фазового перехода, 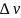 —
изменение удельного объёма тела при
фазовом переходе.
—
изменение удельного объёма тела при
фазовом переходе.
Уравнение названо в честь его авторов, Рудольфа Клаузиуса и Бенуа Клапейрона.
Между
температурой фазового перехода и внешним
давлением существует функциональная
связь, причём при фазовом переходе
производная 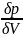 терпит
разрыв. Тогда изотермы для
рассматриваемого вещества будут иметь
характерный вид, изображённый на рисунке.
Для вывода существенен горизонтальный
участок изотермы, соответствующий
фазовому переходу. Слева и справа от
этого участка всё вещество находится
в одной фазе. Осуществим цикл
Карно при бесконечно малой разности
температур следующим образом: сначала
сообщаем телу теплоту, переводя его из
состояния 1 в состояние 2,
затемадиабатически охлаждаем
его на температуру dT, после чего замыкаем
цикл, отводя теплоту и переводя вещество
в фазу 1 с последующим адиабатическим
нагревом. Совершённая работа равна
площади цикла:
терпит
разрыв. Тогда изотермы для
рассматриваемого вещества будут иметь
характерный вид, изображённый на рисунке.
Для вывода существенен горизонтальный
участок изотермы, соответствующий
фазовому переходу. Слева и справа от
этого участка всё вещество находится
в одной фазе. Осуществим цикл
Карно при бесконечно малой разности
температур следующим образом: сначала
сообщаем телу теплоту, переводя его из
состояния 1 в состояние 2,
затемадиабатически охлаждаем
его на температуру dT, после чего замыкаем
цикл, отводя теплоту и переводя вещество
в фазу 1 с последующим адиабатическим
нагревом. Совершённая работа равна
площади цикла:
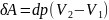
Сообщённая теплота равна
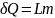
где ![]() —
удельная теплота фазового перехода,
—
удельная теплота фазового перехода, ![]() —
масса тела. Согласно теореме
Карно,
—
масса тела. Согласно теореме
Карно,
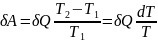
Отсюда
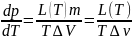
Тройна́я
то́чка — точка
на фазовой
диаграмме,
где сходятся три линии фазовых
переходов.
Тройная точка — это одна из характеристик
химического вещества. Обычно тройная
точка определяется значением температуры
и давления, при котором вещество может
равновесно находиться в трёх (отсюда и
название) агрегатных состояниях —
твёрдом, жидком и газообразном. В этой
точке сходятся линии
плавления, кипения и сублимации.
Критическая
точка —
сочетание значений температуры ![]() и
давления
и
давления ![]() (или,
что эквивалентно, молярного
объёма
(или,
что эквивалентно, молярного
объёма ![]() ),
при которых исчезает различие в свойствах
жидкой и газообразной фаз вещества.
),
при которых исчезает различие в свойствах
жидкой и газообразной фаз вещества.
