
- •Основные положения молекулярно-кинетической теории вещества. Газы, жидкости и твердые тела. Статистический и термодинамический методы исследования.
- •Термодинамические параметры. Состояние термодинамического равновесия. Уравнения состояния термодинамической системы.
- •3. Кинетическая теория идеального газа. Основные законы классической статистики. Основное ур-ие кинетической теории идеального газа. Статистический смысл термодинамической температуры.
- •4. Равновесное распределение молекул в потенциальном поле. Барометрическая формула. Статистическое распределение Больцмана.
- •5. Функция распределения. Распределение Максвелла молекул газа по скоростям. Наиболее вероятная, средняя и средняя квадратичная скорости теплового движения молекул.
- •11.Применение первого начала термодинамики к изопроцессам в идеальном газе.
- •12.Адиабатический процесс. Уравнение Пуассона и показатель адиабаты. Термодинамические функции состояния.
- •13. Круговые процессы. Обратимые и необратимые процессы. Тепловая машина. Кпд теплового двигателя.
- •14. Обратимый цикл Карно. Теорема Карно. Кпд реальной тепловой машины.
- •15. Понятие энтропии. Изменение энтропии в однонаправленных процессах. Второе начало термодинамики. Третье начало термодинамики.
- •16. Силы межмолекулярного взаимодействия в реальном газе. Уравнение Ван-дер-Ваальса. Внутренняя энергия реального газа.
- •19. Поверхностное натяжение жидкости. Коэффициент поверхностного натяжения. Силы поверхностного натяжения. Внутреннее дополнительное давление в жидкости. Явление смачивания.
Основные положения молекулярно-кинетической теории вещества. Газы, жидкости и твердые тела. Статистический и термодинамический методы исследования.
Основные положения молекулярно-кинетической теории вещества:
-Все тела состоят из частиц;
-Частицы находятся в беспорядочном движении;
-Движение никогда не прекращается;
-Частицы взаимодействуют между собой (притягиваются или отталкиваются).
Идеальный газ – газ, взаимодействием частиц которого можно пренебречь, а объем стремится к 0.
Жи́дкость — одно из агрегатных состояний вещества, оно способно менять форму неограниченное число раз под действием напряжений.
Твёрдое тело —это одно из четырёх агрегатных состояний вещества, отличающееся от других агрегатных состояний (жидкости,газов, плазмы) стабильностью формы и характером теплового движения атомов, совершающих малые колебания около положений равновесия.
Статистический и термодинамический метод исследования используется в молекулярной физике и термодинамике.
Статистический метод основан на том, что свойства макроскопической системы в конечном счете определяются свойствами частиц системы, особенностями их движения и усредненными значениями динамических характеристик этих частиц (скорости, энергии и т.п.). Вероятностный метод.
Статистические параметры:
n-концентрация;
mo
– масса одной молекулы; U-
средняя скорость; ω
– средняя кинетическая энергия движения
частиц.
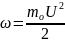
Термодинамический метод не рассматривает микропроцессы, которые лежат в основе этих превращений. Предусматривает характеристику системы как единое целое. p-давление; T-температура; ρ-плотность; V-объем; m-масса ядра.

Термодинамические параметры. Состояние термодинамического равновесия. Уравнения состояния термодинамической системы.
Термодинамическая система – система одного или нескольких тел, способных обмениваться энергией или веществом между собой. Система находится в равновесии если параметры во всех её точках остаются постоянными.
Термодинамический процесс – процесс, при котором в системе меняется хотя бы 1 параметр.
Термодинамические параметры – совокупность физических величин, характеризующих свойства термодинамической системы (температура, давление, удельный объем).
p-давление; T-температура; ρ-плотность; V-объем; m-масса ядра.
Температура – физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. Удельный объем – объем единицы массы.
Давле́ние — физическая величина, равная силе, действующей на единицу площади поверхности перпендикулярно этой поверхности.
Уравнение состояния идеального газа:
R
= 8,31 Дж/моль*К,
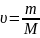 -
количество вещества
-
количество вещества
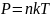 n
– концентрация в единицы объема,
k=1,38*10-23
Дж/К – Постоянная Боцмана.
n
– концентрация в единицы объема,
k=1,38*10-23
Дж/К – Постоянная Боцмана.
3. Кинетическая теория идеального газа. Основные законы классической статистики. Основное ур-ие кинетической теории идеального газа. Статистический смысл термодинамической температуры.
Молекулярно-кинетическая теория является статистической теорией, то есть теорией, рассматривающей поведение систем, состоящих из огромного числа частиц (атомов и молекул), на основе вероятностных моделей.
Так как число молекул огромное количество, то можно применить законы статистики и найти определенные закономерности для всего вещества в целом.
Основные положение молекулярно-кинетической теории:
- все тела состоят из частиц;
- эти частицы находятся в беспорядочном движении;
- это движение никогда не прекращается, частицы взаимодействуют между собой (притягиваются или отталкиваются)
Кинетическая теория газов объясняет неравновесные свойства газов (явления переноса энергии, массы, импульса) на основе законов движения и взаимодействия молекул. Она основана на предположении, что молекулы в газах находятся на расстояниях, значительно превышающих их размер. Так как силы взаимодействия между электрически нейтральными атомами являются очень короткодействующими, то взаимодействие молекул происходит лишь при их непосредственном сближении — при столкновениях. Взаимодействия между молекулами идеального газа отсутствуют; его энергия зависит только от температуры.
Предположим, что молекулы газа движутся хаотически, число взаимных столкновений между молекулами газа пренебрежимо мало по сравнению с числом ударов о стенки сосуда, а соударения молекул со стенками сосуда абсолютно упругие.
Тогда давление газа, оказываемое им на стенку сосуда равно:
 ,
где
,
где
 -
квадрат средней квадратичной скорости
движения молекул;
-
квадрат средней квадратичной скорости
движения молекул;
 - средняя
кинетическая энергия поступательного
движения молекулы;
- средняя
кинетическая энергия поступательного
движения молекулы;
 - концентрация молекул (
- концентрация молекул (
 );
);
 - масса одной молекулы. ( всё выше
перечисленное Статистические Параметры!
)
- масса одной молекулы. ( всё выше
перечисленное Статистические Параметры!
)
Это уравнение называется основным уравнением молекулярно-кинетической теории идеального газа.
Статистический метод – вероятностный метод. Термодинамический метод – предусматривает характеристику системы как единое целое.
Термодинамическая система – система одного или нескольких тел, способных обмениваться энергией или веществом между собой.
Термодинамический процесс – это процесс, при котором в системе меняется хотя бы один параметр.
Система находится в равновесии, если параметры во всех её точках остаются постоянными.
