
- •Основные положения молекулярно-кинетической теории вещества. Газы, жидкости и твердые тела. Статистический и термодинамический методы исследования.
- •Термодинамические параметры. Состояние термодинамического равновесия. Уравнения состояния термодинамической системы.
- •3. Кинетическая теория идеального газа. Основные законы классической статистики. Основное ур-ие кинетической теории идеального газа. Статистический смысл термодинамической температуры.
- •4. Равновесное распределение молекул в потенциальном поле. Барометрическая формула. Статистическое распределение Больцмана.
- •5. Функция распределения. Распределение Максвелла молекул газа по скоростям. Наиболее вероятная, средняя и средняя квадратичная скорости теплового движения молекул.
- •11.Применение первого начала термодинамики к изопроцессам в идеальном газе.
- •12.Адиабатический процесс. Уравнение Пуассона и показатель адиабаты. Термодинамические функции состояния.
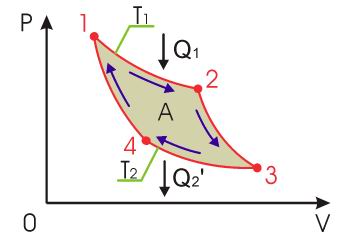
- •13. Круговые процессы. Обратимые и необратимые процессы. Тепловая машина. Кпд теплового двигателя.
- •14. Обратимый цикл Карно. Теорема Карно. Кпд реальной тепловой машины.
- •15. Понятие энтропии. Изменение энтропии в однонаправленных процессах. Второе начало термодинамики. Третье начало термодинамики.
- •16. Силы межмолекулярного взаимодействия в реальном газе. Уравнение Ван-дер-Ваальса. Внутренняя энергия реального газа.
- •19. Поверхностное натяжение жидкости. Коэффициент поверхностного натяжения. Силы поверхностного натяжения. Внутреннее дополнительное давление в жидкости. Явление смачивания.
14. Обратимый цикл Карно. Теорема Карно. Кпд реальной тепловой машины.
Обратимый цикл Карно имеет самый высокий термический КПД среди возможных циклов, осуществляемых в одном и том же интервале температур. Исключение составляют лишь регенеративные циклы, в которых термический КПД такой же, как у цикла Карно.
Обратимый цикл для идеального газа из N молекул состоит из трех процессов: изотермического расширения от V до V2, изобарического сжатия, адиабатического сжатия.
Обратимый
цикл Карно состоит из двух изотерм,
описывающих процесс теплопередачи от
нагревателя к рабочему телу и от рабочего
тела к холодильнику, и двух адиабат,
описывающих расширение и сжатие рабочего
тела в тепловой машине (см. рис. ).
Температура нагревателя считается
равной , а температура холодильника -
соответственно . При этом температуры
нагревателя и холодильника постоянны,
что должно обеспечиваться бесконечно
большой теплоемкостью используемых
тепловых резервуаров.
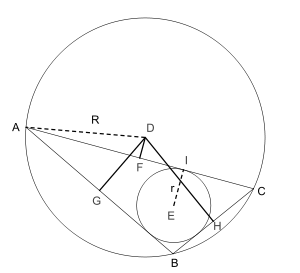
Первая теорема (более известна как формула Карно) Пусть дан произвольный треугольник ABC. Тогда сумма алгебраических расстояний (англ.) от центра описанной окружности D до сторон треугольника ABC будет равна DF+DG+DH=r , где r — радиус вписанной окружности, а R — описанной. Знак расстояния принимается отрицательным тогда и только тогда, когда отрезок DX (X = F, G, H) целиком лежит вне треугольника.
Вторая теорема (известная также как критерий Карно)
Пусть
дан треугольник АВС и точки А1, В1, С1 на
плоскости. Тогда перпендикуляры,
опущенные из А1, В1, С1 на ВС, АС, ВС
соответственно, пересекаются в одной
точке тогда и только тогда, когда
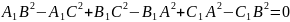
15. Понятие энтропии. Изменение энтропии в однонаправленных процессах. Второе начало термодинамики. Третье начало термодинамики.
Термодинамическая энтропия — термодинамическая функция, характеризующая меру неупорядоченности термодинамической системы, то есть неоднородность расположения и движения ее частиц.
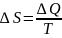 .(то
есть тепло, переданное системе, при
постоянной температуре)
.(то
есть тепло, переданное системе, при
постоянной температуре)
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.Второе начало термодинамики (в формулировке неубывания энтропии) иногда используется критиками эволюционной теории с целью показать, что развитие природы в сторону усложнения невозможно. Однако подобное применение физического закона является некорректным, так как энтропия не убывает только в замкнутых системах (сравн. с диссипативной системой), в то время как живые организмы и планета Земля в целом являются открытыми системами.
Третье начало термодинамики (теорема Нернста) — физический принцип, определяющий поведение энтропии при приближении температуры к абсолютному нулю. Является одним из постулатов термодинамики, принимаемым на основе обобщения значительного количества экспериментальных данных.
Третье начало термодинамики относится только к равновесным состояниям.
Поскольку на основе второго начала термодинамики энтропию можно определить только с точностью до произвольной аддитивной постоянной (то есть, определяется не сама энтропия, а только её изменение):
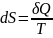
Согласно
третьему началу термодинамики,
при 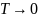 значение
значение 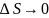
Из третьего начала термодинамики следует, что абсолютного нуля температуры нельзя достичь ни в каком конечном процессе, связанном с изменением энтропии, к нему можно лишь асимптотически приближаться, поэтому третье начало термодинамики иногда формулируют как принцип недостижимости абсолютного нуля температуры.
