
- •Основные положения молекулярно-кинетической теории вещества. Газы, жидкости и твердые тела. Статистический и термодинамический методы исследования.
- •Термодинамические параметры. Состояние термодинамического равновесия. Уравнения состояния термодинамической системы.
- •3. Кинетическая теория идеального газа. Основные законы классической статистики. Основное ур-ие кинетической теории идеального газа. Статистический смысл термодинамической температуры.
- •4. Равновесное распределение молекул в потенциальном поле. Барометрическая формула. Статистическое распределение Больцмана.
- •5. Функция распределения. Распределение Максвелла молекул газа по скоростям. Наиболее вероятная, средняя и средняя квадратичная скорости теплового движения молекул.
- •11.Применение первого начала термодинамики к изопроцессам в идеальном газе.
- •12.Адиабатический процесс. Уравнение Пуассона и показатель адиабаты. Термодинамические функции состояния.
- •13. Круговые процессы. Обратимые и необратимые процессы. Тепловая машина. Кпд теплового двигателя.
- •14. Обратимый цикл Карно. Теорема Карно. Кпд реальной тепловой машины.
- •15. Понятие энтропии. Изменение энтропии в однонаправленных процессах. Второе начало термодинамики. Третье начало термодинамики.
- •16. Силы межмолекулярного взаимодействия в реальном газе. Уравнение Ван-дер-Ваальса. Внутренняя энергия реального газа.
- •19. Поверхностное натяжение жидкости. Коэффициент поверхностного натяжения. Силы поверхностного натяжения. Внутреннее дополнительное давление в жидкости. Явление смачивания.
11.Применение первого начала термодинамики к изопроцессам в идеальном газе.
И зохорный
процесс (V=const).
Диаграмма этого процесса (изохора)
в координатах р, V изображается прямой,
параллельной оси ординат (рис. 1), где
процесс 1—2 есть изохорное нагревание,
а 1—3 — изохорное охлаждение. При
изохорном процессе газ не совершает
работы над внешними телами, т. е.
зохорный
процесс (V=const).
Диаграмма этого процесса (изохора)
в координатах р, V изображается прямой,
параллельной оси ординат (рис. 1), где
процесс 1—2 есть изохорное нагревание,
а 1—3 — изохорное охлаждение. При
изохорном процессе газ не совершает
работы над внешними телами, т. е.

Из
первого начала термодинамики (δQ=dU+δA)
для изохорного процесса следует, что
вся теплота, которая сообщается газу,
идет на увеличение его внутренней
энергии: δQ=dU Для произвольной массы
газа:
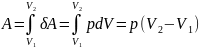
И зобарный
процесс (p=const).
Диаграмма этого процесса (изобара)
в координатах р, V изображается прямой,
которая параллельна оси V. При изобарном
процессе работа газа при увеличения
объема от V1 до
V2 равна
зобарный
процесс (p=const).
Диаграмма этого процесса (изобара)
в координатах р, V изображается прямой,
которая параллельна оси V. При изобарном
процессе работа газа при увеличения
объема от V1 до
V2 равна

и
равна площади заштрихованного
прямоугольника (рис. 2). Если использовать
уравнение Менделеева-Клапейрона для
выбранных нами двух состояний, то
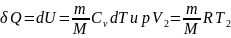 откуда
откуда
 Тогда
выражение (2) для работы изобарного
расширения примет вид
Тогда
выражение (2) для работы изобарного
расширения примет вид

Изотермический
процесс (T=const).
Изотермический процесс описывается
законом Бойля—Мариотта:
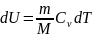
Диаграмма этого процесса (изотерма) в координатах р, V представляет собой гиперболу, которая расположена на диаграмме тем выше, чем выше температура, при которой происходит процесс.
Исходя
из формул для работы газа и уравнения
Менделеева-Клайперона найдем работу
изотермического расширения газа:

Так
как при Т=const внутренняя энергия идеального
газа не изменяется:
 то
из первого начала термодинамики
(δQ=dU+δA) следует, что для изотермического
процесса δQ=δA т. е. все количество теплоты,
сообщаемое газу, расходуется на совершение
им работы против внешних сил:
то
из первого начала термодинамики
(δQ=dU+δA) следует, что для изотермического
процесса δQ=δA т. е. все количество теплоты,
сообщаемое газу, расходуется на совершение
им работы против внешних сил:

12.Адиабатический процесс. Уравнение Пуассона и показатель адиабаты. Термодинамические функции состояния.
Адиабатическим называется процесс, при котором отсутствует теплообмен (δQ=0) между системой и окружающей средой. Адиабатическим процессами можно считать все быстропротекающие процессы.
Из первого начала термодинамики (δQ=dU+δA) для адиабатического процесса следует, что δA=- dU (1)т. е. внешняя работа совершается за счет изменения внутренней энергии системы.
Используя
формулы δA=pdV и CV=dUm/dT,
для произвольной массы газа перепишем
уравнение (1) в виде:
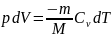 (2) применив
дифференцирование уравнение состояния
для идеального газа
(2) применив
дифференцирование уравнение состояния
для идеального газа
 получим:
получим:
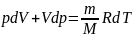 (3)
(3)
Исключим
из (2) и (3) температуру Т.  Разделив
переменные и учитывая, что
Разделив
переменные и учитывая, что
 , найдем
, найдем
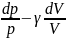 .
Проинтегрируя
это уравнение в пределах от p1 до
p2 и
соответственно от V1 до
V2,
и потенцируя, придем к выражению
.
Проинтегрируя
это уравнение в пределах от p1 до
p2 и
соответственно от V1 до
V2,
и потенцируя, придем к выражению  или
или
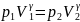
Так
как состояния 1 и 2 выбраны произвольно,
то можно записать
 , полученное
выражение есть уравнение
адиабатического процесса,
называемое также уравнением
Пуассона.
, полученное
выражение есть уравнение
адиабатического процесса,
называемое также уравнением
Пуассона.
 называется показателем
адиабаты (или коэффициентом
Пуассона).
называется показателем
адиабаты (или коэффициентом
Пуассона).
 работа при адиабатическом процессе.
работа при адиабатическом процессе.
13. Круговые процессы. Обратимые и необратимые процессы. Тепловая машина. Кпд теплового двигателя.
Круговым процессом(циклом) называется такой процесс, в результате которого термодинамическая система возвращается в исходное состояние.
Обратимым процессом называют такой процесс, который может быть проведен в обратном направлении таким образом, что система будет проходить через те же состояния, что и при прямом ходе, но в обратной последовательности. Обратимым может быть только равновесный процесс.
В том случае, когда после завершения прямого и обратного процессов система вернулась в первоначальное состояние и в окружающей среде остались изменения, процесс является необратимым. Очевидно, что все процессы в природе необратимые.
Тепловая машина-устройство, преобразующее тепловую энергию в механическую работу (тепловой двигатель) или механическую работу в тепло (холодильник). Преобразование осуществляется за счёт изменения внутренней энергии рабочего тела — на практике обычно пара или газа.
Идеальная тепловая машина — машина, в которой произведённая работа и разница между количеством подведённого и отведённого тепла равны. Работа идеальной тепловой машины описывается циклом Карно.
При работе часть тепла Q1 передается от нагревателя к рабочему телу, а затем часть энергии Q2 передается холодильнику, который охлаждает машину КПД тепловой машины считается по формуле (Q1-Q2/Q1)х100
Периодически действующий двигатель, совершающий работу за счет получаемого извне тепла, называется тепловой машиной.
Коэффициент полезного действия (КПД) теплового двигателя рассчитывается как отношение работы, совершаемой двигателем, к количеству теплоты, полученному от нагревателя:

