
Реакции фосфат - аниона po43-.
● Хлорид бария BaCl2 образует с анионом PO43- белый осадок гидрофосфата бария, растворимый в кислотах, кроме H2SO4.
BaCl2 + Na2HPO4 = BaHPO4↓ + 2NaCl
Ba2+ + HPO42- = BaHPO4↓
● Нитрат серебра AgNO3 с фосфат–анионом PO43- дает желтый осадок фосфата серебра, растворимый в HNO3.
3AgNO3 + Na2HPO4= Ag3PO4↓+ HNO3 + 2NaNO3
● Магнезиальная смесь (MgCl2, NH4Cl, NH4OH) с фосфат - анионами образует белый кристаллический осадок.
NH4Cl
Na2HPO4 + MgCl2 + NH4OH = MgNH4PO4↓ + 2NaCl + H2O
HPO42- + NH4OH + Mg2+ = MgNH4PO4 + H2O
Проведение реакции. К 5-6 каплям хлорида магния прилить несколько капель раствора NH4OH. Образовавшийся осадок Mg(OH)2 растворить, добавляя хлорид аммония NH4Cl, а затем прибавить несколько капель гидрофосфата натрия Na2HPO4, образуется осадок фосфата магния-аммония MgNH4PO4↓, который говорит о присутствии в анализируемом растворе фосфат - анионов. В реакции следует избегать избытка хлорид аммония, который может вызвать образование комплексных ионов. Другие анионы не мешают открытию PO43- этой реакцией.
● Молибденовая жидкость (раствор молибдата аммония в HNO3). (NH4)2MoO4 + HNO3 образует с фосфат - анионом PO43- желтый кристаллический осадок.
Na2HPO4 + 12(NH4)2MoO4 + 23HNO3 = (NH4)3H4[P(Mo2O7)6]↓ + 2NaNO3 + 21NH4NO3 + 10H2O
Этой реакции при открытии PO43- мешают все анионы восстановители (SO32-, J-, NO2-, S2-), так как они с молибденовой жидкостью образуют «молибденовую синь», окрашивая раствор в синий цвет. Все мешающие анионы хорошо окисляются и тем самым удаляются из раствора при кипячении его с концентрированной HNO3.
Открытию фосфат - анионов мешают силикат – анионы SiO32-, так как они в больших концентрациях с молибденовой жидкостью образуют желтый осадок кремнемолибдата аммония, а при малых концентрациях окрашивают раствор в желтый цвет. Для удаления из раствора SiO32- силикат - аниона его 2-3 раза упаривают досуха с концентрированной HCl и разбавляют подкисленной водой, при этом образуется кремниевая кислота H2SiO3, осадок нерастворимый, который легко удалить центрифугированием.
Реакции силикат – анионов SiO32-.
а) Для открытия силикат–анионов SiO32- служит реакция взаимодействия их с разбавленными растворами HCl или H2SO4 и растворимыми солями аммония. Для этого к анализируемому раствору очень медленно (каплями) приливают соляную или серную кислоту. При этом происходит реакция гидролиза, в результате чего кремниевая кислота H2SiO3 выделяется в свободном состоянии в виде белого студенистого осадка (геля). Если на холоде осадка не образуется, то раствор нагревают до кипения, так как при нагревании гидролиз солей кремниевой кислоты усиливается. Другие анионы не мешают открытию SiO32- этой реакцией.
При отсутствии в растворе PO43-, SiO32- - анионы легко обнаруживаются молибденовой жидкостью, которая с силикат - анионами образует желтый осадок кремнемолибдата аммония (NH4)2SiO3∙12MoO3.
б) При действии солей аммония (NH4Cl или NH4NO3) на анион SiO32- выделяют из растворов силикатов кремниевую кислоту H2SiO3. Гидролиз усиливается в результате связывания образующихся OH—ионов с катионами аммония NH4+. Если осадок на холоде не образуется, то раствор нагревают.
S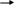
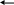 iO32-
+ 2H2O
H2SiO3
+ 2OH-
iO32-
+ 2H2O
H2SiO3
+ 2OH-
2
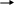
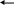 OH-
+ 2NH4+
2NH4OH
OH-
+ 2NH4+
2NH4OH
S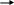 iO32-
+ 2H2O
+ 2NH4+
H2SiO3↓
+ 2NH4OH
iO32-
+ 2H2O
+ 2NH4+
H2SiO3↓
+ 2NH4OH
Налейте в пробирку 4-5 капель анализируемого раствора, добавить 3-4 капли дистиллированной воды, добавить 3-4 кристаллика NH4Cl и нагреть. Образуется студенистый осадок кремниевой кислоты H2SiO3, реакция протекает при избытке NH4Cl и при нагревании.
Ход анализа смеси анионов I аналитической группы (SO42-, SO32-, CO32-, PO43-, SiO32-).
В пробирку помещают 5-7 капель нейтрального или слабощелочного анализируемого раствора, прибавляют 7-8 капель 0,5н раствора хлорида бария BaCl2. Образование белого осадка указывает на присутствие анионов I группы в анализируемом растворе.
Определение сульфат - аниона SO42-.
К 3-4 каплям анализируемого раствора прибавляют 6-8 капель 2н раствора азотной кислоты HNO3 и 3-4 капли 2н раствора хлорида бария BaCl2. Образование осадка говорит о присутствии сульфат - аниона в растворе.
Определение сульфит - аниона SO32-.
К анализируемому раствору прибавляют эквивалентное количество 2н раствора HCl и кусочек металлического цинка. Раствор нагревают, в результате выделяется сероводород H2S, который может быть обнаружен по резкому запаху или по почернению бумаги, смоченной раствором ацетата свинца Pb(CH3COO)2.
Na2SO3 + 2HCl = 2NaCl + H2O + SO2↑
3Zn + 6HCl + SO2 = 3ZnCl2 + 2H2O + H2S↑
H2S + Pb(CH3COO)2 = PbS↓ + 2CH3COOH
К анализируемому раствору прибавляют эквивалентное количество нитрата стронция, выпадает осадок. Осадок отделяют центрифугированием, промывают 2-3 раза горячей дистиллированной водой. Часть осадка смачивают 1-2 каплями 0,1н раствора иода и 2-3 каплями 2н HCl. Обесцвечивание иода – признак присутствия SO32- в анализируемом растворе.
