- •Решебник
- •Ростов-на-Дону
- •Кандидат физико-математических наук
- •Внутреннее строение вещества
- •Введение в теорию идеального газа
- •Основы термодинамики
- •Статистические закономерности в термодинамике
- •Реальные газы
- •Явления переноса
- •Развернутое изложение методов решения физических задач по молекулярной физике
- •Внутреннее строение вещества
- •Классификация кристаллов
- •Физические типы кристаллических решеток
- •Введение в теорию идеального газа
- •Статистические закономерности
- •Решение.
- •Поток теплоты на единицу длины цилиндров
- •Основы термодинамики
- •Поток тепла, проходящий через него, в силу закона Фурье равен
- •Реальные газы
Основы термодинамики
2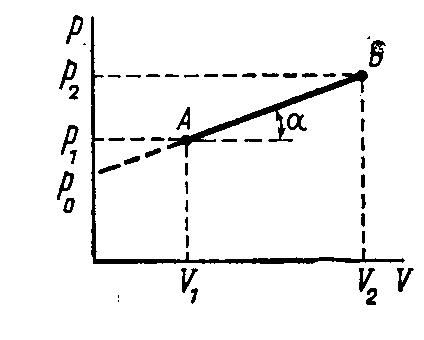 .22.
Процесс перехода моля идеального газа
из состояния А с параметрами р1
и V1
в состояние с параметрами р2
и V2
представлен графически в переменных
рV
прямой линией АВ. Молярная теплоемкость
СV
в данных условиях не зависит от
температуры.
.22.
Процесс перехода моля идеального газа
из состояния А с параметрами р1
и V1
в состояние с параметрами р2
и V2
представлен графически в переменных
рV
прямой линией АВ. Молярная теплоемкость
СV
в данных условиях не зависит от
температуры.
А)
Найти аналитическое выражение процесса
изменения состояния газа.
Б) Вывести
общую формулу для определения молярной
теплоемкости газа в любом процессе.
В)
Определить молярную теплоемкость в
заданном процессе.
Г) Записать условие
перехода данного процесса в политропический
процесс.
Д) Вычислить молярную
теплоемкость для полученного
политропического процесса.
Решение.
Аналитическое выражение для процесс,
представленного прямой АВ, запишется
так:
![]() .
Здесь
и р0
определятся как:
.
Здесь
и р0
определятся как:
![]() .
.
![]() .
.
Процесс 1 не является политропическим, поэтому для определения теплоемкости нельзя пользоваться формулой:
.
Выведем общую формулу для определения молярной теплоемкости идеального газа.
Первое начало термодинамики:
![]()
и определение теплоемкости:
![]()
приводят
к выражению:
![]()
для случая идеального газа, так как внутренняя энергия последнего является функцией только температуры и, следовательно,
![]() .
.
Предыдущее
выражение определяет молярную теплоемкость
идеального газа в любом процессе. Оно
показывает, что величина теплоемкости
зависит только от процесса изменения
состояния газа – от члена
![]() .
.
Определим молярную теплоемкость в условиях нашей задачи. Можно получить:
![]()
откуда
![]()
и
![]() .
.
Процесс
(1) перейдет в политропический при
условии, что р0
= 0 и запишется уравнением политропы
![]()
с показателем политропы n=1.
Для определения молярной теплоемкости политропического процесса можно использовать формулу, полученную из более общей формулы для политропического процесса, определяемого уравнениями
![]()
Итак, в нашем случае для политропы после преобразований имеем
![]() .
.
2.23.
Молярная теплоемкость идеального газа
при некотором процессе изменяется по
закону
![]() ,
где
- постоянная величина. Найти уравнение,
связывающее параметры р и V
в этом процессе.
,
где
- постоянная величина. Найти уравнение,
связывающее параметры р и V
в этом процессе.
Решение.
Использовав общую формулу для молярной теплоемкости в любом процессе
и
учитывая, что
![]() ,
получим
,
получим
![]() .
.
Откуда можно получить
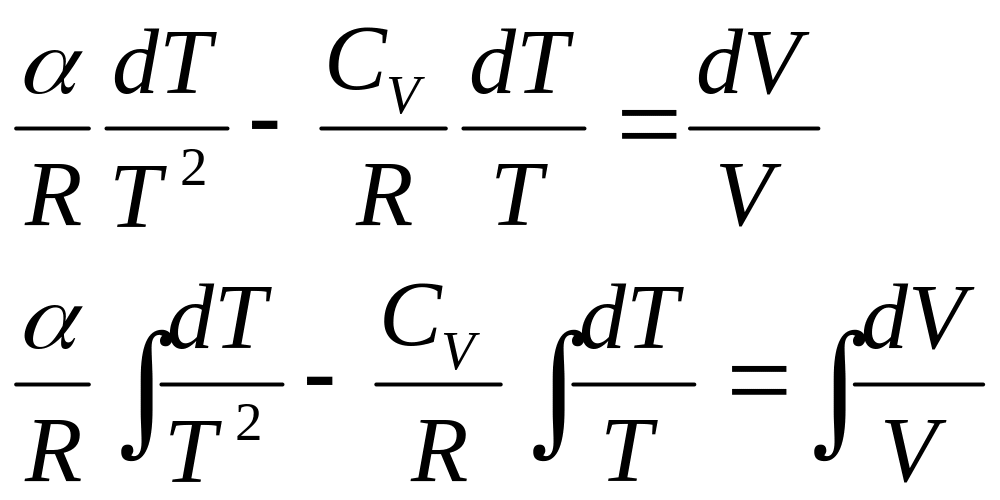
что после интегрирования дает
![]()
или
![]() .
.
Учитывая,
что
![]() ,
получим
,
получим
![]() .
.
2.24. Поршень вдвигается в цилиндр настолько медленно, что вследствие потери теплоты сквозь стенки изменение температуры газа при продвижении поршня вдвое меньше, чем при быстром вдвигании на такое же расстояние. Процесс в газе при быстром вдвигании считать адиабатическим.
1) Найти уравнение данного процесса, выяснить, является ли он политропическим. 2) Определить молярную теплоемкость газа в данном процессе.
Решение.
Обозначим
параметры начального состояния газа
через p0,
V0,
T0
. Имеем два процесса: 1 – быстрое движение
поршня – процесс по условию задачи
адиабатический; 2 – медленное движение
поршня – процесс, вид которого следует
определить. Обозначим параметры
промежуточного состояния газа в первом
процессе через:
![]() и
и
![]() .
.
Во
втором процессе – через:
и
![]() ,
,
где
по условию задачи
![]() .
.
Сравним начальное и конечное состояния газа в адиабатическом процессе. Воспользовавшись уравнением адиабаты, запишем:
![]() .
.
Отсюда будем иметь:
![]() .
.
![]() .
.
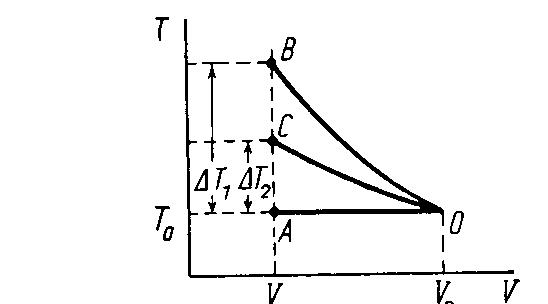
Окончательно уравнение второго процесса имеет вид:
![]()
Графически
данный процесс изображается кривой ОС,
лежащей посередине между изотермой ОА
и адиабатой ОВ, так что АВ=2АС или
![]() .
.
Данный
процесс не является политропическим,
так как не может быть представлен
уравнением вида
![]() ни с каким показателем политропы,
следовательно, чтобы найти молярную
теплоемкость газа в этом процессе, надо
воспользоваться общей формулой для
определения теплоемкости идеального
газа в любом процессе:
ни с каким показателем политропы,
следовательно, чтобы найти молярную
теплоемкость газа в этом процессе, надо
воспользоваться общей формулой для
определения теплоемкости идеального
газа в любом процессе:
![]() .
.
Далее
имеем:
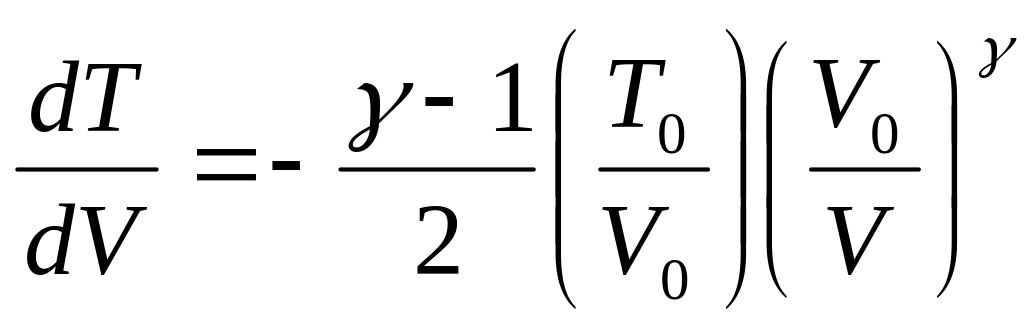 .
.
Учитывая, что можно получить:
![]()
Окончательно получим:
![]() .
.
Отсюда следует, что теплоемкость данного процесса не является постоянной величиной, зависит от температуры. Это также подтверждает, что полученный процесс не является политропическим. Знак «минус» в выражении показывает, что в процессе сжатия теплота теряется газом, а не подводится к нему, при этом газ, однако, нагревается. Это происходит за счет работы, совершаемой над газом внешними силами при перемещении поршня.
2.25. В вертикальном цилиндрическом сосуде высоты H находится один моль идеального газа. Найти теплоемкость этого газа, учитывая наличие поля сил тяжести и предполагая, что MgH<<RT, где М – молекулярный вес газа. Расширением сосуда при нагревании пренебречь.
Решение.
Теплоемкость по определению
.
Так как нагревание производится при постоянном объеме и газ идеальный, то
![]() .
.
Где dU- изменение полной внутренней энергии газа, которое складывается из изменения кинетической и потенциальной энергии молекул в поле сил тяжести, т.е.
![]() .
.
Распределение молекул по высоте неравномерное, зависит от температуры газа и описывается формулой Больцмана
![]()
которая при учете условия задачи MgH<<RT принимает вид
![]() .
.
На
перераспределение молекул по высоте с
температурой будет затрачиваться
дополнительно тепло, и, следовательно,
хотя процесс идет при постоянном объеме,
теплоемкость его, в случае учета влияния
силы тяжести. Отличается от СV
для идеального газа и складывается из
![]() и
и
![]() .
Вычислим зависимость потенциальной
энергии от температуры. Выделим слой
молекул газа толщиной dx
на высоте х от дна цилиндра. Масса этого
слоя
.
Вычислим зависимость потенциальной
энергии от температуры. Выделим слой
молекул газа толщиной dx
на высоте х от дна цилиндра. Масса этого
слоя
![]() .
.
Здесь m0 –масса одной молекулы., S – площадь сечения цилиндра.
Потенциальная энергия слоя
![]() .
.
Потенциальная энергия всех молекул
![]()
n0 – концентрация молекул у дна сосуда. Вычислим ее из условия нормировки
Для этого найдем полное число молекул во всем объеме сосуда и приравняем его к числу Авогадро (число молекул – один моль).
Число
молекул в слое
![]()
Полное число молекул в цилиндре
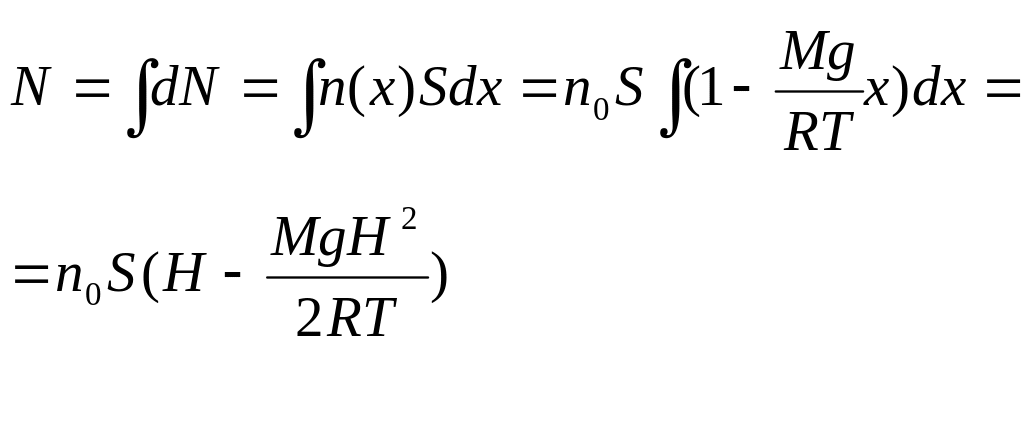
откуда
находим
![]()
и потенциальная энергия
![]()
Как и следовало ожидать, первый член соответствует равномерному распределению молекул, второй – искомая поправка к нему, зависящая от температуры
![]()
Полная молярная теплоемкость газа
![]() .
.
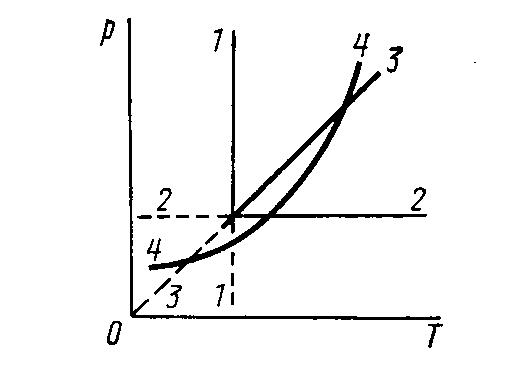
2.26. Даны изохорический, изобарический, адиабатический и изотермический процессы, представленные графически в системе координат pV. Нарисовать примерные графики указанных процессов в системах координат pT и UT, где U – внутренняя энергия газа.
Решение.
1. Представим графически в системе pV процессы, заданные условиями задачи.
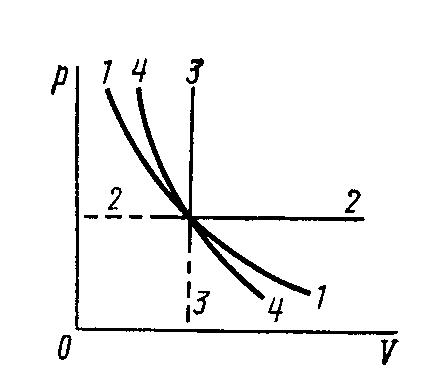
изотермический процесс T=const, кривая 1-1
V/T=const, p=const – изобара, прямая параллельная оси OV, 2 –2
P/T=const, V=const – изохора, прямая, параллельная оси ОР,3-3 Линии 2-2 и 3-3 начинаются с ненулевого значения, так как практически осуществить равное нулю давление или объем невозможно, поэтому на графике такое приближение прямых к оси не имеет смысла.
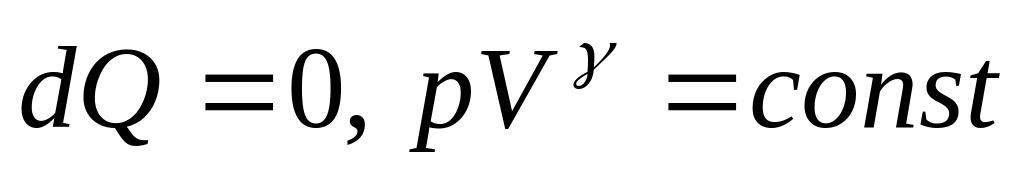 -
адиабата 4-4, более крутая кривая, чем
изотерма.
-
адиабата 4-4, более крутая кривая, чем
изотерма.
Для представления любых политропических процессов в системе координат рТ нужно найти аналитическую зависимость между р и Т в каждом конкретном случае. Для этого используется уравнение заданного процесса и уравнение Клапейрона – Менделеева. Получим:
изотермический процесс в системе координат рТ изобразится прямой 1-1
процесс изобарический изобразится прямой 2-2
изохорический процесс из pV=RT
 ,
т.е.
,
т.е.
 ~T,
следовательно, имеем прямую, проходящую
через начало координат, 3-3
~T,
следовательно, имеем прямую, проходящую
через начало координат, 3-3адиабатический процесс, имеем кривую 4-4.
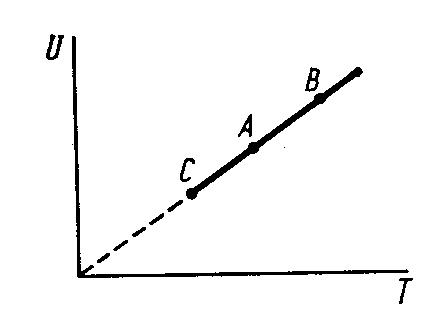
Представим заданные процессы в системе координат UT, где U – внутренняя энергия газа.
1) T=const, pV=const
2) p=const, V/T=const
V=const, p/T=const
dQ=0,
Для
идеального газа внутренняя энергия
является функцией состояния, следовательно
![]() .
.
Таким образом, процессы 2, 3 и 4 изобразятся в указанных переменных прямой линией, проходящей через начало координат.
Процесс 1 – изотермический, изобразится точкой А или любой точкой на прямой СВ, т.к. внутренняя энергия в этом процессе не изменяется.
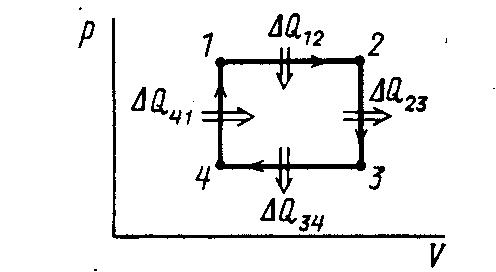
2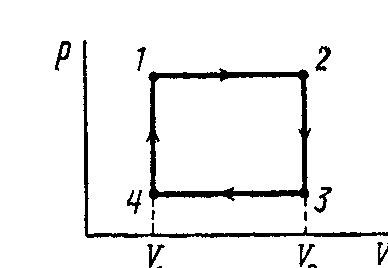 .27.
Термодинамический цикл осуществляется
над одной относительной молекулярной
массой идеального газа. Последовательность
состояний задана на диаграмме рV.
V2
=V1.
Температура в состояниях 2 и4 соответственно
равна Т2
и Т4.
.27.
Термодинамический цикл осуществляется
над одной относительной молекулярной
массой идеального газа. Последовательность
состояний задана на диаграмме рV.
V2
=V1.
Температура в состояниях 2 и4 соответственно
равна Т2
и Т4.
Решение.
Задание цикла pV- диаграммой и последовательность состояний позволяют сразу дать ответ о виде машины, поскольку площадь цикла на pV-диаграмме представляет работу, совершенную рабочим телом за один цикл. При решении будем придерживаться указанной выше последовательности. В данном случае работа положительна. В этом нетрудно убедиться, рассмотрев
 по замкнутому контуру, обход которого
по условию происходит по часовой
стрелке. Это соответствует случаю,
когда рабочее тело совершает полезную
работу в процессе передачи теплоты от
нагревателя к холодильнику, т.е. система
работает как тепловая машина. Если бы
обход контура происходил против часовой
стрелки, мы имели бы дело с холодильной
машиной.
по замкнутому контуру, обход которого
по условию происходит по часовой
стрелке. Это соответствует случаю,
когда рабочее тело совершает полезную
работу в процессе передачи теплоты от
нагревателя к холодильнику, т.е. система
работает как тепловая машина. Если бы
обход контура происходил против часовой
стрелки, мы имели бы дело с холодильной
машиной.Используя общее соотношение для элементарной работы
 найдем
работу на каждом участке цикла
найдем
работу на каждом участке цикла
 Заданный цикл состоит из двух
изобат 1-2 и 3-4 и двух изохор 2-3 и 4-1. Для
нашего цикла
Заданный цикл состоит из двух
изобат 1-2 и 3-4 и двух изохор 2-3 и 4-1. Для
нашего цикла
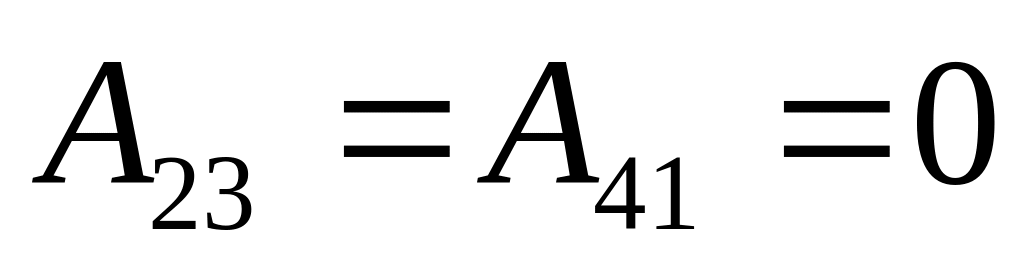 - изохорические процессы. Давления на
изобарах нам не заданы, но их легко
определить, используя уравнение
состояния идеального газа. Действительно,
так как
- изохорические процессы. Давления на
изобарах нам не заданы, но их легко
определить, используя уравнение
состояния идеального газа. Действительно,
так как
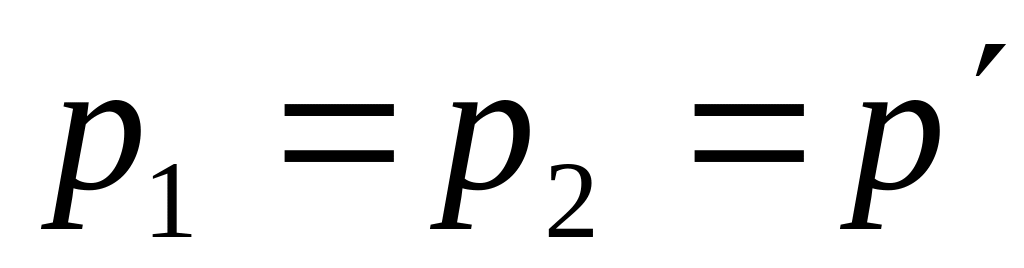 ,
,
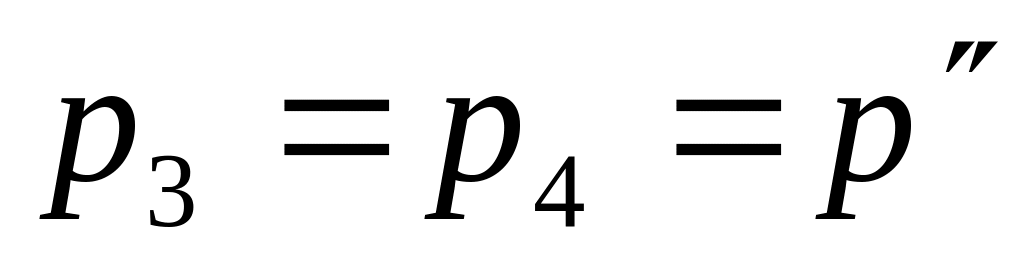 , имеем V2/V1
=T2/T1
= 2, или T2
= 2 T1,
T3=2T4,
а из диаграммы ясно, что T2>T4.
Тогда
, имеем V2/V1
=T2/T1
= 2, или T2
= 2 T1,
T3=2T4,
а из диаграммы ясно, что T2>T4.
Тогда
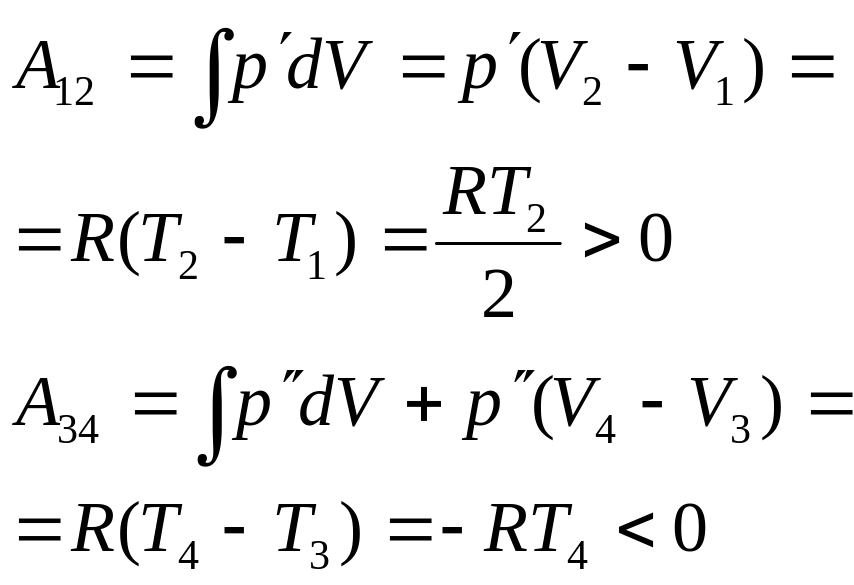 Работа
на 1-2 совершается рабочим телом за счет
теплоты, отбираемой от нагревателя, а
для того чтобы рабочее тело вернуть к
исходному состоянию, его надо сжать или
совершить работу над рабочим телом
(3-4).
При
Работа
на 1-2 совершается рабочим телом за счет
теплоты, отбираемой от нагревателя, а
для того чтобы рабочее тело вернуть к
исходному состоянию, его надо сжать или
совершить работу над рабочим телом
(3-4).
При
![]() =const
газ нагревается и расширяется. Такой
квазистатический процесс можно
моделировать тепловым контактом рабочего
тела с бесконечно большой последовательностью
нагревателей в диапазоне температур
от T1
до Т2.
Сам процесс идет бесконечно медленно.
На этапе 3-4 процесс идет в обратном
направлении – бесконечно большая
последовательность холодильников в
диапазоне температур от Т3
до Т4.
=const
газ нагревается и расширяется. Такой
квазистатический процесс можно
моделировать тепловым контактом рабочего
тела с бесконечно большой последовательностью
нагревателей в диапазоне температур
от T1
до Т2.
Сам процесс идет бесконечно медленно.
На этапе 3-4 процесс идет в обратном
направлении – бесконечно большая
последовательность холодильников в
диапазоне температур от Т3
до Т4.
Используя результаты, полученные ранее, найдем полную работу за цикл
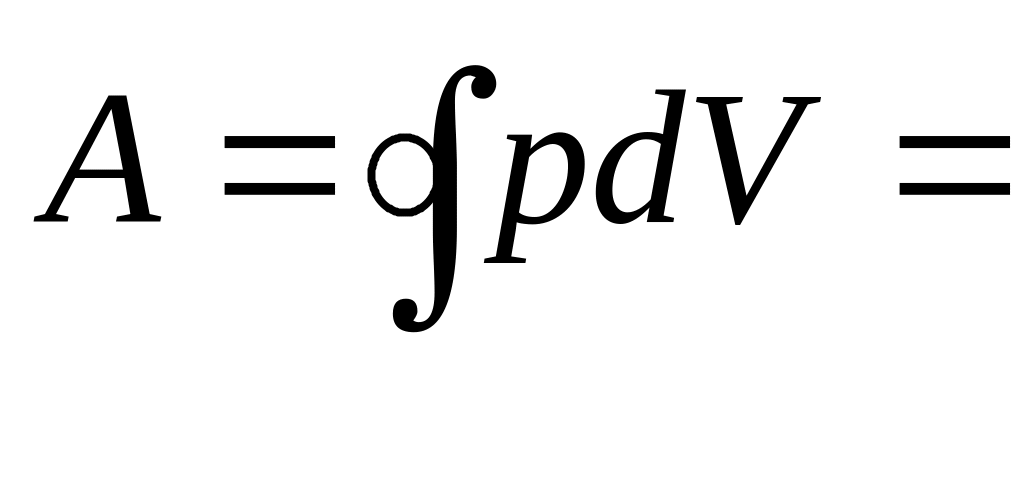
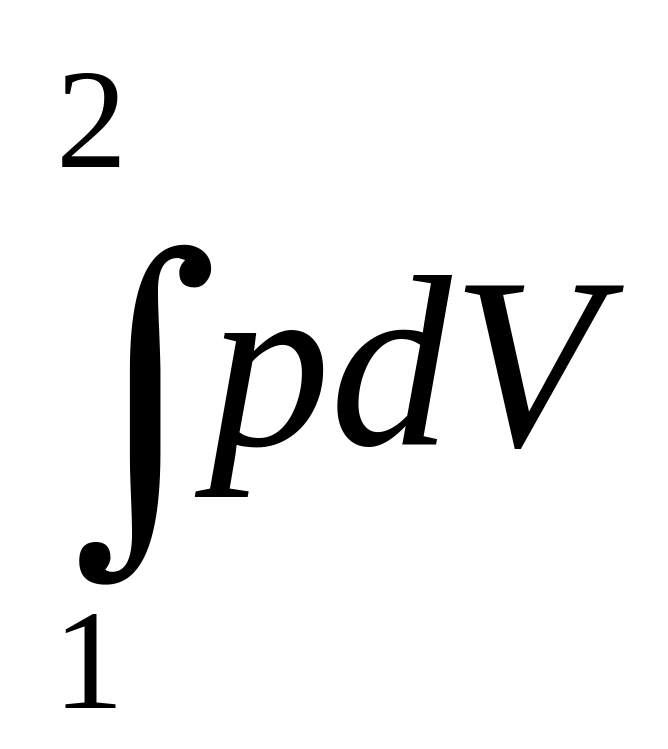 +
+
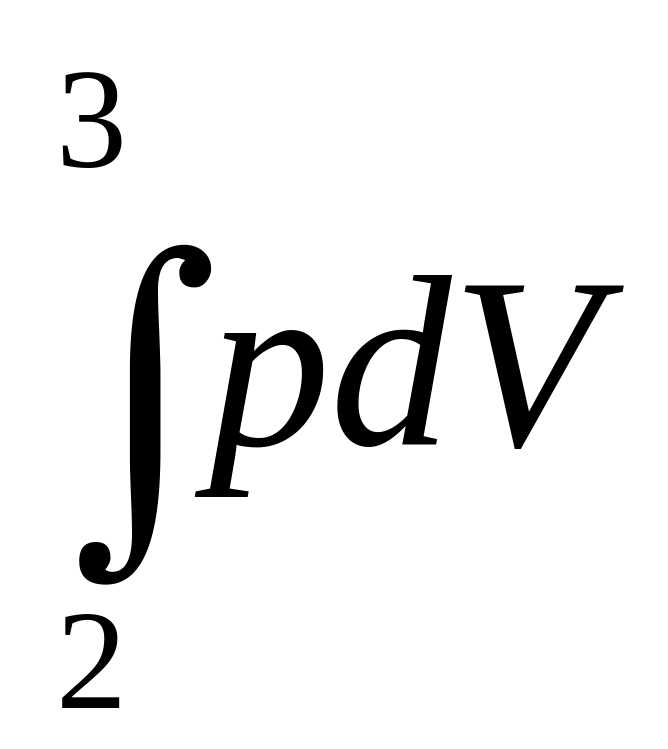 +
+
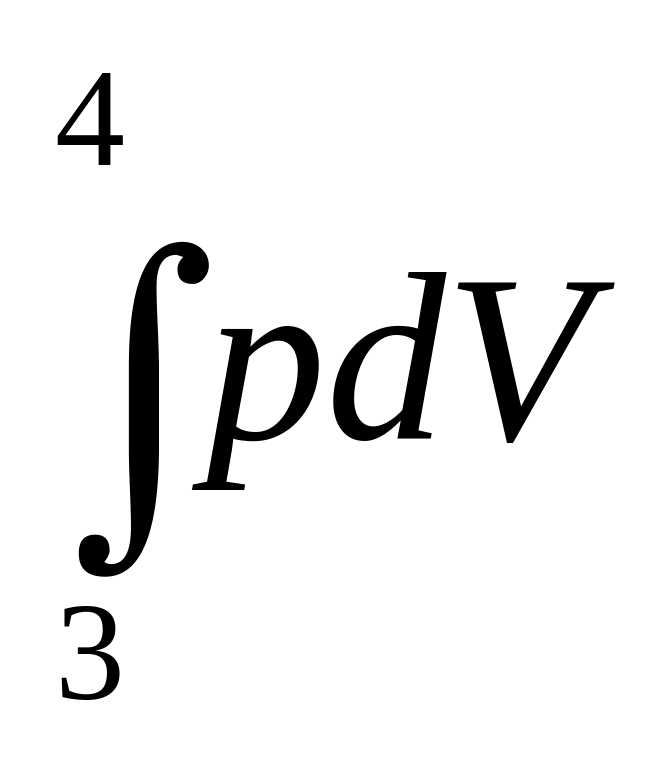 +
+
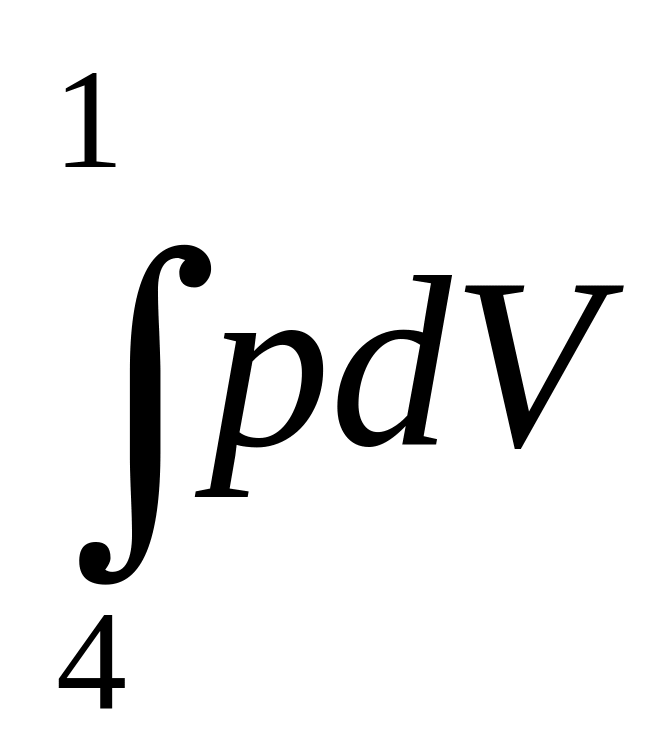 =
=
=
=
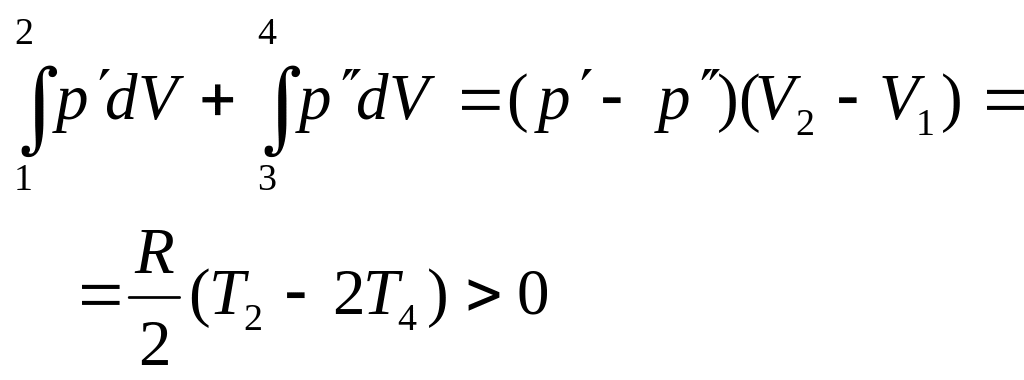 Она
положительна, т.к. обе скобки больше
нуля.
Она
положительна, т.к. обе скобки больше
нуля.
 Найдем
теплоту, которую получает или отдает
рабочее тело на каждом этапе цикла.
Воспользуемся первым началом
термодинамики
Найдем
теплоту, которую получает или отдает
рабочее тело на каждом этапе цикла.
Воспользуемся первым началом
термодинамики
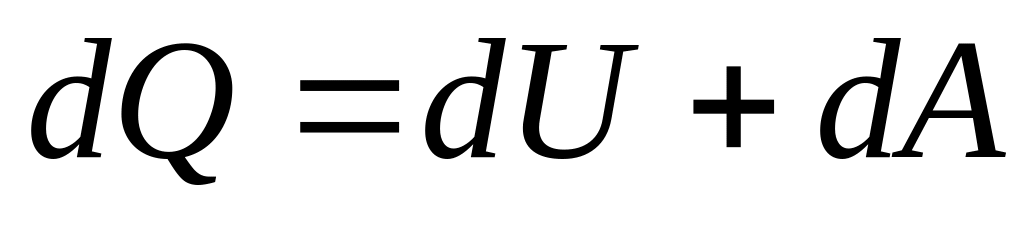 По условию рабочим телом в
нашей тепловой машине является идеальный
газ. Его молярную теплоемкость следует
считать известной. Поэтому
По условию рабочим телом в
нашей тепловой машине является идеальный
газ. Его молярную теплоемкость следует
считать известной. Поэтому
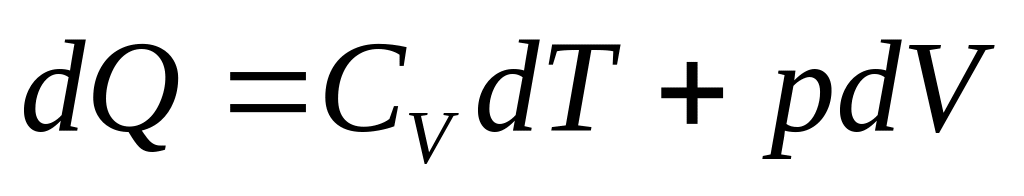 Все расчетные соотношения
целесообразно записывать в наиболее
удобном для данной цели виде. Поясним
на конкретном примере. На этапе 1-2
Все расчетные соотношения
целесообразно записывать в наиболее
удобном для данной цели виде. Поясним
на конкретном примере. На этапе 1-2
 но, с другой стороны, этот процесс
политропический, следовательно, можно
сразу записать
но, с другой стороны, этот процесс
политропический, следовательно, можно
сразу записать
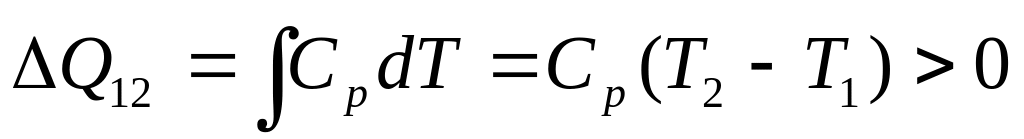 Аналогично
Аналогично
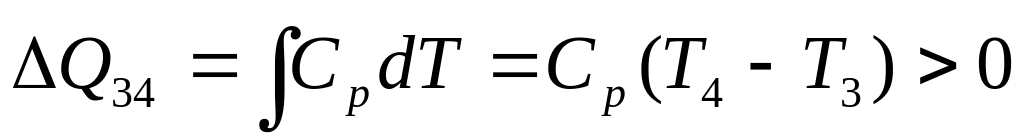 Этапы 2-3 и 4-1 представляют собой
изохорические процессы, поэтому
Этапы 2-3 и 4-1 представляют собой
изохорические процессы, поэтому
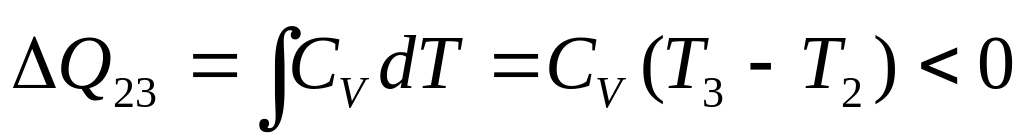
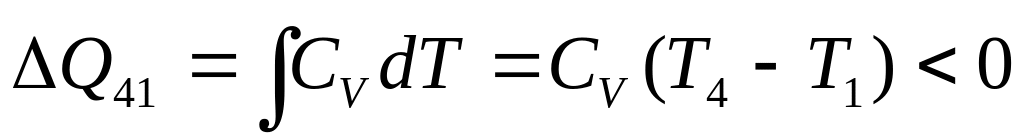 При изохорических процессах газ
нагревается или охлаждается при
постоянном объеме. Такой квазистатический
процесс можно моделировать тепловым
контактом рабочего тела с бесконечно
большой последовательностью холодильников
в диапазоне температур от Т2
до Т3.
Процесс идет бесконечно медленно.
Теплоту, которую получает или отдает
рабочее тело, можно схематически
представить на pV –диаграмме
При изохорических процессах газ
нагревается или охлаждается при
постоянном объеме. Такой квазистатический
процесс можно моделировать тепловым
контактом рабочего тела с бесконечно
большой последовательностью холодильников
в диапазоне температур от Т2
до Т3.
Процесс идет бесконечно медленно.
Теплоту, которую получает или отдает
рабочее тело, можно схематически
представить на pV –диаграммеИз ранее полученных результатов ясно, что для данного цикла общее количество теплоты, получаемой от нагревателя, равно
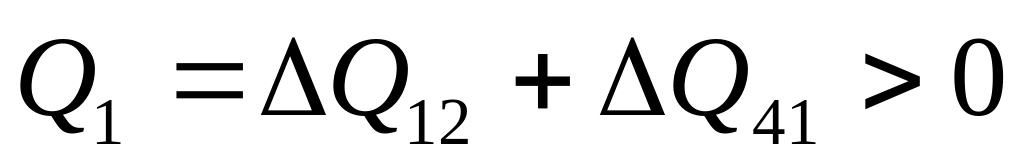 Количество
теплоты, переданное холодильнику,
равно
Количество
теплоты, переданное холодильнику,
равно

Отношение полной работы за цикл к теплоте, полученной рабочим телом на всех этапах цикла, характеризует эффективность машины или КПД тепловой машины
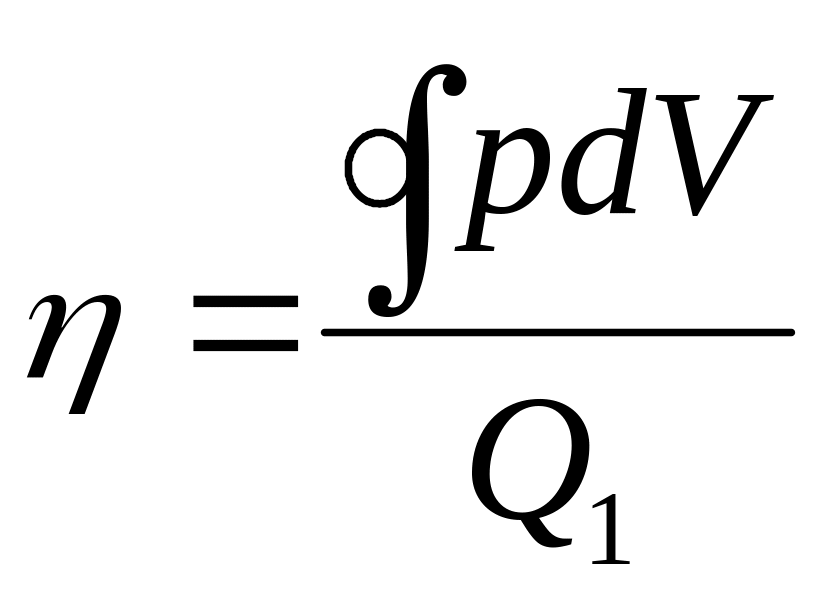 Интеграл
по замкнутому контуру может быть заменен
алгебраической суммой (с учетом
направления обхода) работ на каждом
участке
Интеграл
по замкнутому контуру может быть заменен
алгебраической суммой (с учетом
направления обхода) работ на каждом
участке
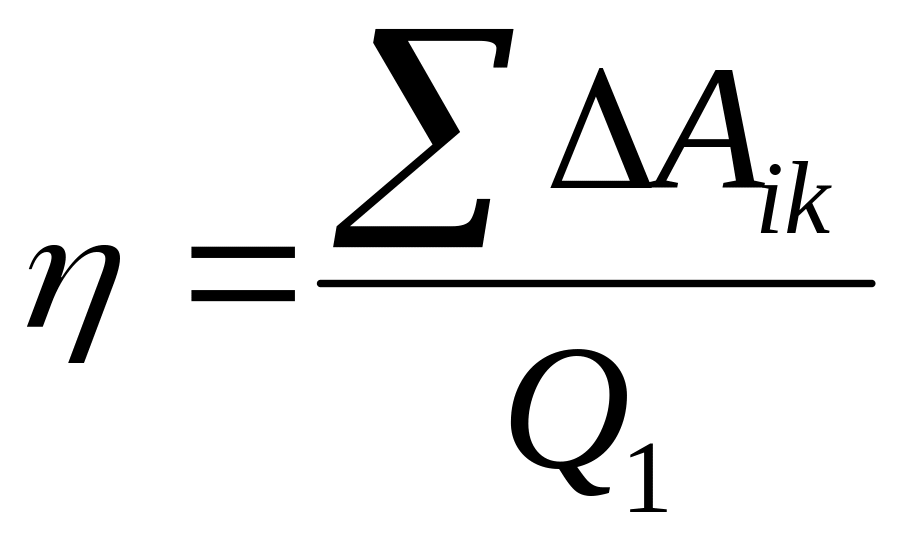 Применяя
первое начало термодинамики к циклическим
процессам, имеем
Применяя
первое начало термодинамики к циклическим
процессам, имеем
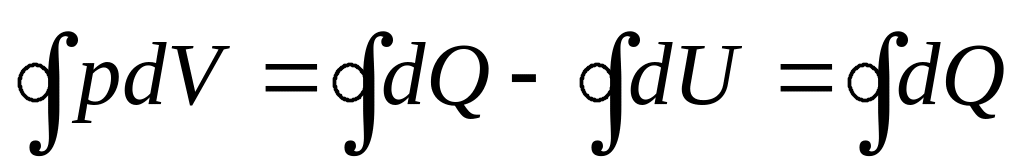 Поэтому
Поэтому
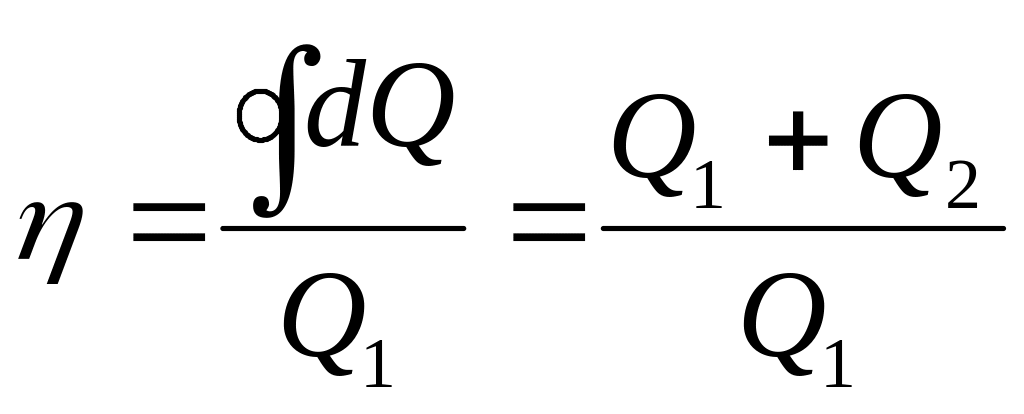 .
Для
нашей конкретной задачи КПД равен
.
Для
нашей конкретной задачи КПД равен
 .
.
2.28. Тепловая машина Карно, имеющая КПД 40%, начинает использоваться при тех же условиях, но как холодильная машина. Найти величину холодильного коэффициента и количество теплоты, которое эта машина может перенести за один цикл от холодильника к нагревателю, если к ней за каждый цикл подводится механическая работа, равная 200 Дж.
Решение.
В
качестве рабочего тела используем
идеальный газ, т.к. КПД машины Карно не
зависит от рода вещества рабочего тела,
1-2 - адиабатическое расширение, то
отсутствует теплообмен рабочего тела
с окружающей средой, поэтому
![]() и
и
![]() или
или
![]() ,
поскольку 2-3 - изотермический процесс.
Внутренняя энергия газа не изменяется
,
поскольку 2-3 - изотермический процесс.
Внутренняя энергия газа не изменяется
![]() и
и
![]() .
.
- адиабатическое сжатие,
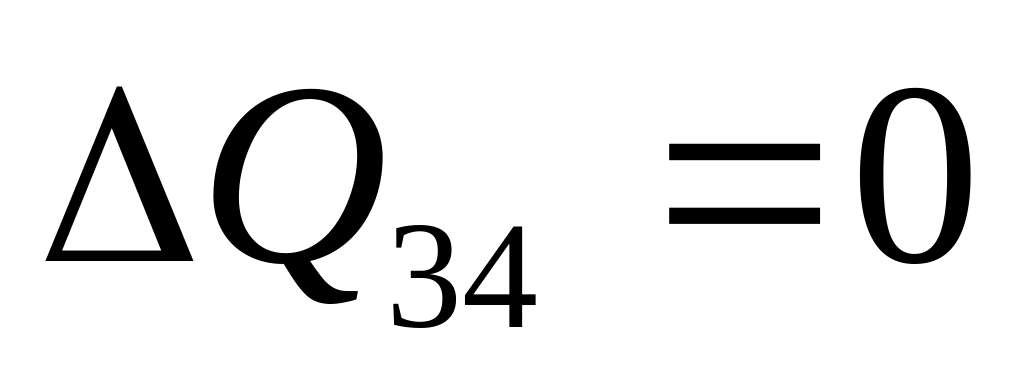
![]() .
.
4-1 – изотермическое сжатие, при котором должен осуществляться тепловой контакт рабочего тела с нагревателем. Сжатие производится внешними силами. В реальном случае нагреватель – это окружающая среда, которой передается тепло, отобранное от холодильника. Тепло, забираемое окружающей средой:
![]() .
.
Таким образом, если тепловая машина Карно за счет теплоты, переданной от нагревателя к холодильнику, совершает работу, то в холодильной машине теплота от холодильника поступает в нагреватель за счет внешней работы.
Воспользовавшись уравнением состояния идеального газа, нетрудно получить так называемое условие замкнутости цикла Карно:
![]()
Полная работа
![]()
Теплота, полученная рабочим телом
![]()
отданная теплота
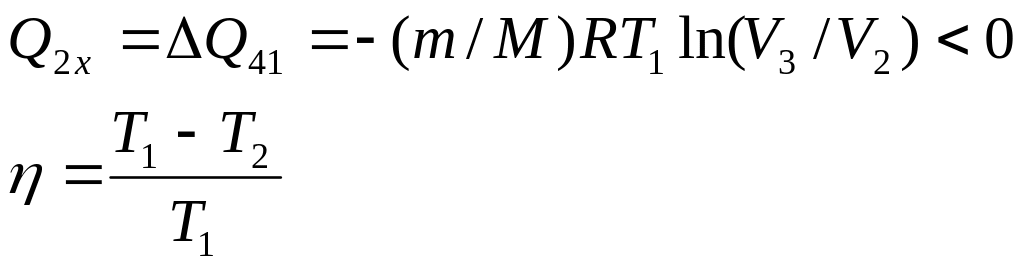
Наша машина работает в обратном направлении. Эффективность такой машины можно охарактеризовать отношением отнятой у холодильника теплоты к совершенной для этого работе. Эту величину называют холодильным коэффициентом
![]() .
.
Наилучшей
холодильной машиной считается та, для
которой при одном и том же
![]() затрачивается наименьшая работа.
затрачивается наименьшая работа.
С другой стороны, при осуществлении в тепловой машине цикла Карно
![]() .
.
Наша машина обратима, при обратном цикле за счет совершенной работы над рабочим телом она забирает от холодильника столько же теплоты, сколько передает ему при прямом цикле. Отсюда
![]() .
.
Холодильная машина не только отбирает теплоту от холодильника, но и предает его нагревателю. Поэтому ее можно рассматривать как своеобразный «тепловой насос», и его эффективность определяется отношением переданной нагревателю теплоты к затраченной для этой цели работе.
Явления переноса
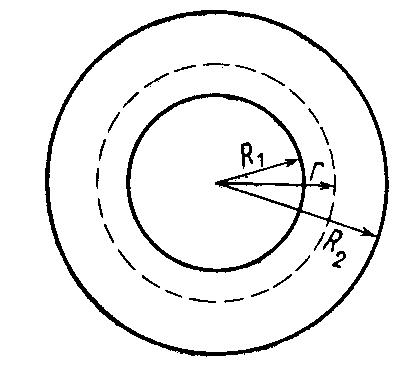
2.29. Пространство между двумя очень длинными коаксиальными цилиндрами с радиусами R1 и R2 заполнено однородным идеальным газом, коэффициент теплопроводности которого равен . Внешний цилиндр R2 поддерживается при температуре T2, внутренний R1 – при температуре Т1.
Считая, что конвекция газа отсутствует и что длина свободного пробега молекул газа меньше расстояния между цилиндрами, найти:
закон распределения температур в пространстве между цилиндрами;
градиент температуры (dT/dr) в пространстве между цилиндрами
поток тепла, приходящийся на единицу длины цилиндра
Решение.
Так как температура внешнего и внутреннего цилиндров поддерживаются постоянными внешними источниками, то в пространстве между ними устанавливается постоянное распределение температур T (r ). Поток тепла не будет зависеть от времени, следовательно, процесс будет носить стационарный характер.
Выделим мысленно цилиндр радиуса r, коаксиальный с данными, все точки которого имеют одинаковую температуру Т=T(r) .