
- •1. Фенолы
- •1.1. Введение
- •2. Получение фенолов
- •2.1. Замещение сульфогруппы на гидроксил
- •2.2.Замещение галогена на гидроксил
- •2.3. Замещение диазогруппы на гидроксил
- •3. Свойства фенолов
- •3.1. Кислотные свойства фенолов
- •3.2. Таутомерия фенолов
- •3.4. Этерификация фенолов
- •3.5. Реакции электрофильного замещения в ароматическом кольце фенола
- •3.5.1. Галогенирование фенолов
- •3.5.2. Нитрование фенолов
- •3.5.3. Сульфирование фенолов
- •3.5.4. Нитрозирование фенолов
- •3.5.5. Алкилирование и ацилирование фенолов по Фриделю-Крафтсу
- •3.5.6. Формилирование фенолов
- •3.5.6А. Реакция Гаттермана
- •3.5.6Б. Реакция Вильсмейера-Хаака
- •3.5.6В. Реакция Реймера-Тимана
- •3.5.7. Конденсация фенолов с альдегидами и кетонами
- •3.5.8. Карбоксилирование феноксид-ионов - реакция Кольбе
- •3.5.9. Азосочетание
- •3.6. Перегруппировка Кляйзена аллилариловых эфиров
- •3.7. Окисление фенолов
3.7. Окисление фенолов
Окисление пространственно незатрудненных фенолов относится к числу сложных, многостадийных процессов, механизм которых мало изучен. Очевидно лишь то, что механизм окисления может сильно меняться в зависимости от природы одно- или двухэлектронного окислителя. Сам фенол при окислении двухэлектронным окислителем - бихроматом натрия или MnO2 в серной кислоте образует с удовлетворительным выходом пара-хинон.

Универсальным одноэлектронным окислителем фенолов является соль Фреми - нитрозодисульфонат калия - редкий пример стабильного неорганического нитроксильного свободного радикала, полученного впервые еще в 1845 году. Окисление фенолов солью Фреми идет в очень мягких условиях по радикальному механизму и приводит к пара-хинонам с выходами, близкими к количественному.
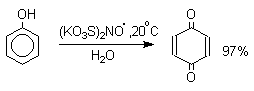
Ароматические амины также гладко окисляются солью Фреми до пара-хинонов.

Самый простой и удобный способ получения орто- и пара-бензохинонов состоит в окислении соответственно пирокатехина и гидрохинона. В качестве окислителей можно использовать самые разнообразные реагенты: дихромат натрия, ферроцианид калия, перкислоты, оксид серебра, тетраокись азота и ряд других окислителей.

Аналогично ведут себя и пара-аминофенолы.

Удовлетворительные результаты при получении орто-бензохинона из пирокатехина достигаются в том случае, если в качестве окислителя используется оксид серебра в эфире в присутствии сульфата натрия для связывания выделяющейся при окислении воды.
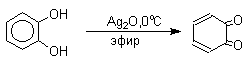
Хиноны, содержащие электроноакцепторные заместители - 2,3,5,6-тетрахлор-1,4-бензохинон ( хлоранил ) или 2,3,5,6-тетрациано-1,4-бензохинон- служат превосходными окислителями для превращения двух- и трехатомных фенолов в хиноны, например:

Окисление двухатомных фенолов до 1,4- или 1,2-хинонов осуществляется в несколько стадий, включающих образование анион-радикалов и радикалов. Механизм этой важной в теоретическом отношении модельной реакции будет рассмотрен в разделе "хиноны".
Механизм окисления фенолов, содержащих в обоих орто-положениях и пара-положении алкильные, арильные или алкоксильные группы, тщательно изучен. Е.Мюллер (1953 год) и независимо от него К.Кук обнаружили, что при окислении 2,4,6-три-трет-бутилфенола гексацианоферратом(III) калия K3Fe(CN)6 в бинарной системе бензол-вода в инертной атмосфере образуется устойчивый радикал одновалентного кислорода - три-трет-бутилфеноксил, окрашенный в синий цвет.

Этот радикал находится в мономерной форме в 0,1 молярном растворе в бензоле или эфире, а также в кристаллическом состоянии. Он очень чувствителен к действию кислорода воздуха, оксида азота (IY), оксида азота (II) и других радикальных частиц. Окисление пространственно затрудненных фенолов до феноксильных (ароксильных) радикалов осуществляется под действием гексацианоферрата (III) калия в бинарной системе бензол-вода, диоксида свинца PbO2, оксида серебра, соли Фреми или другого одноэлектронного окислителя в индифферентной среде, а также электрохимически.

Феноксильные радикалы, содержащие в обоих орто- и пара-положении третичные алкильные группы, мономерны и не проявляют тенденции к образованию димеров в растворе. С другой стороны феноксильные радикалы, содержащие фенильную или алкоксильную группу в орто- или пара-положениях к радикальному центру, проявляют ярко выраженную тенденцию к образованию димеров. Так, например, при окислении 2,4,6-трифенилфенола гексацианоферратом (III) калия получается с выходом 95% димер, который в 0,01 бензольном растворе при 20оС диссоциирован только на 10%. Радикалы с алкоксильной группой в пара-положении более стабильны и 2,6-ди-тре-бутил-4-метоксифеноксил в 3%-ном растворе в бензоле мономерен на 70-75%.
При окислении фенолов образуется несколько различных форм димеров в результате образования новых связей С-С между орто-орто, орто-пара- и пара-пара-положениями исходных радикалов, а также новых С-О связей между атомом кислорода одного радикала и орто-положением другой радикальной частицы. Всего, таким образом, образуется потенциально не менее пяти различных типов димеров, которые находится в равновесии с исходным феноксильным радикалом. Например: для монозамещенного фенола:

Димеры, возникающие в результате рекомбинации радикалов с образованием новой С-С связи, называются хинолидами. Хинолиды далее изомеризуются с образованием изомерных дигидроксибифенилов. Другой тип димеров, содержащих центральную связь С-О, носит название хиноловых эфиров. Образование хиноловых эфиров свойственно для многих пространственно затрудненных феноксильных радикалов, например, для 2,4,6-трифенилфеноксила; 2,6-ди-трет-бутил-4-фенилфеноксила; 2,6-ди-трет-бутил-4-алкоксифеноксилов и т.д. Хиноловые эфиры могут быть получены прямым окислением соответствующих пространственно затрудненных фенолов.

В растворе или при нагревании они диссоциируют на радикалы (см. выше). Хинолидная форма димера образуется в том случае, когда пара-положение или одно из орто-положений феноксила не замещено. Другими словами, хинолиды получаются при окислении 2,4- и 2,6-диалкилфенолов с последующей димеризацией образующихся феноксильных радикалов.



Дальнейшее окисление хинолидного димера, или его таутомерной формы - дигидроксибифенила - приводит к образованию дифенохинона.
Таким образом, производные дифенохинона являются главными конечными продуктами окисления 2,6-диалкилфенолов такими окислителями как: PbO2, Ag2O, K3Fe(CN)6.
