
- •1. Фенолы
- •1.1. Введение
- •2. Получение фенолов
- •2.1. Замещение сульфогруппы на гидроксил
- •2.2.Замещение галогена на гидроксил
- •2.3. Замещение диазогруппы на гидроксил
- •3. Свойства фенолов
- •3.1. Кислотные свойства фенолов
- •3.2. Таутомерия фенолов
- •3.4. Этерификация фенолов
- •3.5. Реакции электрофильного замещения в ароматическом кольце фенола
- •3.5.1. Галогенирование фенолов
- •3.5.2. Нитрование фенолов
- •3.5.3. Сульфирование фенолов
- •3.5.4. Нитрозирование фенолов
- •3.5.5. Алкилирование и ацилирование фенолов по Фриделю-Крафтсу
- •3.5.6. Формилирование фенолов
- •3.5.6А. Реакция Гаттермана
- •3.5.6Б. Реакция Вильсмейера-Хаака
- •3.5.6В. Реакция Реймера-Тимана
- •3.5.7. Конденсация фенолов с альдегидами и кетонами
- •3.5.8. Карбоксилирование феноксид-ионов - реакция Кольбе
- •3.5.9. Азосочетание
- •3.6. Перегруппировка Кляйзена аллилариловых эфиров
- •3.7. Окисление фенолов
3.5.6В. Реакция Реймера-Тимана
Эта реакция по своему механизму резко отличается от реакций электрофильного замещения в ароматическом кольце фенолов, поэтому ее целесообразно рассматривать отдельно от других способов формилирования фенолов.
Формилирование фенолов по Реймеру-Тиману достигается при нагревании смеси фенола и большого избытка хлороформа с водным раствором гидроксида натрия при 50-70оС. Выходы альдегидов обычно невелики и редко превышают 30%, однако метод исключительно прост и доступен в практическом отношении. Главное достоинство реакции Реймера-Тимана заключается в преимущественном образовании орто-, а не пара-изомеров, как это имеет место для реакций Гаттермана и Вильсмейера-Хаака.
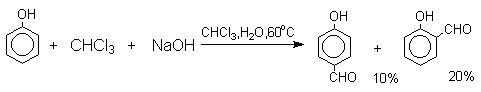
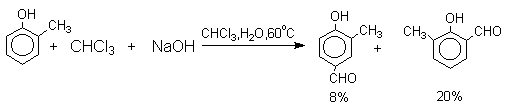
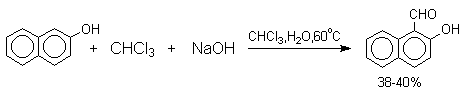
Механизм включает образование дихлоркарбена как интермедиата. Дихлоркарбен : CCl2 выполняет роль электрофильного агента по отношению к феноксид-иону, образующемуся в щелочной среде. Предполагаемый механизм реакции Реймера-Тимана может быть представлен следующей последовательностью превращений:
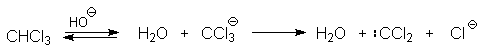
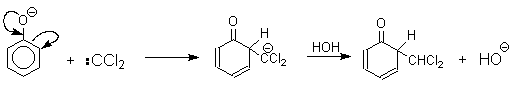
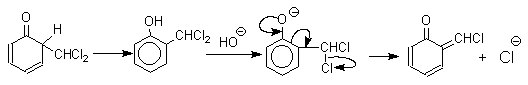
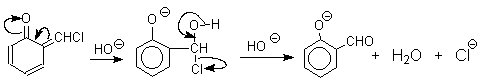
При проведении реакции в D2O более 97% дейтерия включается в формильную группу салицилового альдегида. Это означает, что превращение
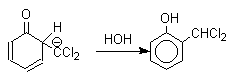
не осуществляется как внутримолекулярный сдвиг.
Хотя анион дихлорметилциклогексадиенона не был выделен в качестве промежуточного продукта реакции Реймера-Тимана, для самого фенола приведенный выше механизм имеет экспериментальные доказательства. Для фенолят-ионов, у которых орто- или пара-положение занято алкильной группой, помимо гидроксибензальдегида другим продуктом реакции всегда оказывается циклогексадиенон, содержащий дихлорметильную группу. Так, например, из пара-крезола получается 2-гидрокси-5-метилбензальдегид и 4-метил-4-дихлорметилциклогексадиен-2,5-он примерно в равных количествах.
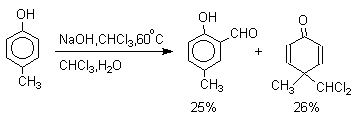
2,4,6-Триметилфенол образует оба возможных изомерных дихлорметилциклогексадиенона, в которых CHCl2 - группа не подвергается гидролизу.

2,6-Ди-трет-бутил-4-метилфенол в этих условиях дает, как и следовало ожидать, только один из двух возможных изомеров.

Образование аномальных продуктов служит убедительным подтверждением механизма, предлагаемого для нормального направления реакции, приводящего к образованию альдегида после изомеризации и гидролиза дихлорметильной группы. Реакция протекает только в сильно щелочной среде при наличии фенольного гидроксила, тогда как простые эфиры фенолов и диалкиланилины не формилируются в этих условиях. Выходы альдегидов в реакции Реймера-Тимана невелики, так как большая часть дихлоркарбена гидролизуется в водной щелочи с образованием CO и NaCl. Кроме того, дихлорметиловый эфир фенола, образующийся в результате атаки дихлоркарбена по кислородному атому амбидентного фенолят-иона, нацело гидролизуется до исходного фенола.
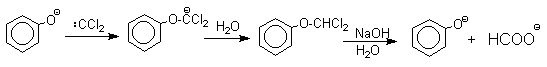
3.5.7. Конденсация фенолов с альдегидами и кетонами
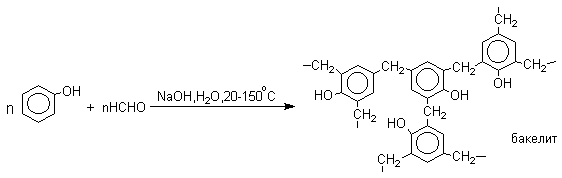
Фенолы реагируют с формальдегидом в водном растворе в присутствии основания с образованием полимерного продукта, получившего название феноло-формальдегидной смолы, карболита или бакелита. В 1909 году Л.Бакелунд запатентовал способ получения этого первого синтетического высокомолекулярного соединения, которое сразу же нашло широкое применение в различных областях машиностроения, электротехники и быта, например, при изготовлении корпусов телефонов, электрических выключателей и т.д.
Взаимодействие феноксид-иона с формальдегидом напоминает альдегидную конденсацию с той лишь разницей, что роль нуклеофильного агента вместо енолят-иона выполняет амбидентный феноксид-ион, а карбонильной компонентой является формальдегид.
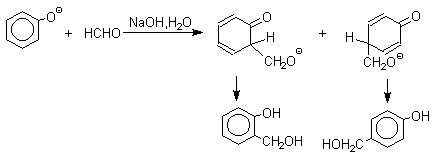
Подобно альдолям, орто- и пара-изомеры гидроксиметилфенола подвергаются дегидратации с образованием хинонметидов - соединений, родственных орто- и пара-хинонам.
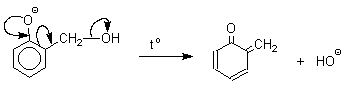
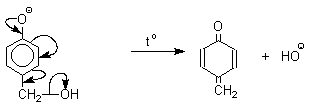
Последующее присоединение феноксид-иона к хинонметиду представляет собой присоединение амбидентного аниона к , -непредельному кетону по Михаэлю.
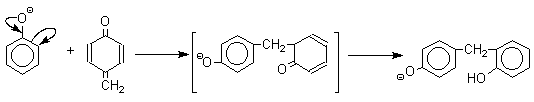
В результате дальнейшей поликонденсации в орто- и пара-положение к гидрокси-группе фенола получается трехмерная структура конечного продукта - бакелита. Бакелит представляет собой прозрачную смолу, где линейные звенья связаны "поперечными" связями в пара-положениях.
Фенол конденсируется с ацетоном в кислой среде с образованием так называемого бисфенола А.
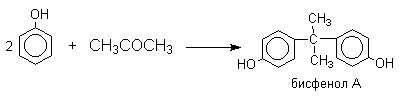
Получено много подобных продуктов конденсации фенолов с кетонами. Они находят применение в качестве антиоксидантов и мономеров для получения эпоксидных смол, получаемых, например, при конденсации бисфенола А с эпихлоргидрином:
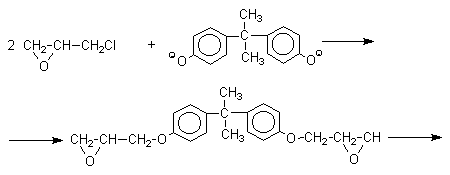
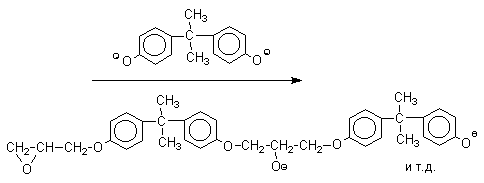
Эпоксидные смолы широко применяется в современной технике и в быту
