- •1. Фенолы
- •1.1. Введение
- •2. Получение фенолов
- •2.1. Замещение сульфогруппы на гидроксил
- •2.2.Замещение галогена на гидроксил
- •2.3. Замещение диазогруппы на гидроксил
- •3. Свойства фенолов
- •3.1. Кислотные свойства фенолов
- •3.2. Таутомерия фенолов
- •3.4. Этерификация фенолов
- •3.5. Реакции электрофильного замещения в ароматическом кольце фенола
- •3.5.1. Галогенирование фенолов
- •3.5.2. Нитрование фенолов
- •3.5.3. Сульфирование фенолов
- •3.5.4. Нитрозирование фенолов
- •3.5.5. Алкилирование и ацилирование фенолов по Фриделю-Крафтсу
- •3.5.6. Формилирование фенолов
- •3.5.6А. Реакция Гаттермана
- •3.5.6Б. Реакция Вильсмейера-Хаака
- •3.5.6В. Реакция Реймера-Тимана
- •3.5.7. Конденсация фенолов с альдегидами и кетонами
- •3.5.8. Карбоксилирование феноксид-ионов - реакция Кольбе
- •3.5.9. Азосочетание
- •3.6. Перегруппировка Кляйзена аллилариловых эфиров
- •3.7. Окисление фенолов
3.5.6. Формилирование фенолов
В этом разделе из множества методов введения формильной группы в орто- и пара-положения к гидроксильной группе фенолов будут подробно рассмотрены только наиболее синтетически важные реакции: реакции Гаттермана, Вильсмейера-Хаака и Реймера-Тимана.
3.5.6А. Реакция Гаттермана
Попытки введения формильной группы в ароматическое кольцо фенолов, нафтолов и их простых эфиров с помощью СО и HCl ( катализаторы AlCl3 или AlCl3 - Cu2Cl2 ; реакция Гаттермана-Коха ) оказались безуспешными. Поэтому сам Гаттерман предложил метод введения альдегидной группы, в котором в качестве формилирующего агента использовалась смесь безводного HCN и газообразного хлористого водорода (катализатор ZnCl2 , реакция Гаттермана). Формильная группировка вступает в пара-положение к ОН- и RO-группе фенолов или их простых эфиров. Выходы целевых продуктов около 80%.

Следует отметить, что истинная природа электрофильной частицы, принимающей участие при введении формильной группы с помощью HCN, HCl и кислоты Льюиса точно не установлена. Для того, чтобы избежать применения ядовитой синильной кислоты, Р.Адамс модифицировал условия реакции, заменив ее цианидом цинка. Это позволило из цианида цинка и HCl получать непосредственно в реакционной смеси HCN и безводный хлористый цинк, играющий роль слабой кислоты Льюиса. Этот метод дает хорошие результаты при формилировании фенолов и их простых эфиров.
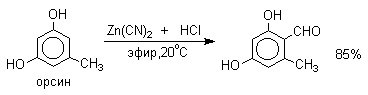
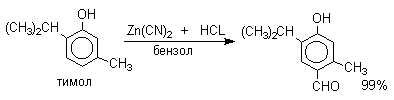
Реакция Гаттермана стала очень популярной после того, как было установлено, что вместо цианидов для введения формильной группы можно использовать нетоксичный и легко доступный симметричный 1,3,5-триазин. Этот метод обеспечивает высокие выходы альдегидов при формилировании алкилбензолов, фенолов, эфиров фенолов, конденсированных углеводородов и гетероциклических соединений.

Определенное сходство с реакцией Гаттермана имеет реакция Геша. К.Геш (1915 г) нашел, что реакционноспособные фенолы (обычно двухатомные фенолы, производные резорцина) могут быть успешно ацилированы при взаимодействии с нитрилами и сухим хлористым водородом в присутствии хлорида цинка, как слабой кислоты Льюиса.
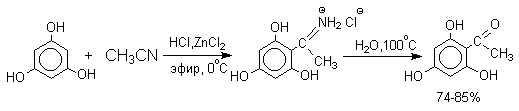
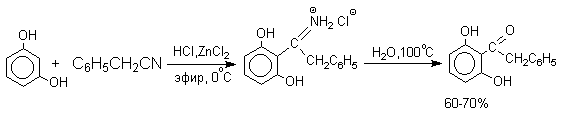
Сам фенол и многие другие одноатомные фенолы в условиях реакции Геша дают не кетоны, а соли иминоэфиров ArOC(R) = N+ H2Cl- .
3.5.6Б. Реакция Вильсмейера-Хаака
Для введения альдегидной группы в
ароматическое кольцо, активированное
диалкиламино-, гидрокси- или алкоксигруппой,
эффективна реакция, описанная в 1927 году
А.Вильсмейером и А.Хааком. N-Алкиламиды
муравьиной кислоты -диметилформамид и
N-метилформамид - в присутствии хлорокиси
фосфора являются превосходными
региоселективными формилирующими
агентами. С помощью этих реагентов
альдегидная группа вводится в
пара-положение по отношению к имеющейся
NR2; ОН или OR-группе. Эту реакцию
можно также рассматривать как ацилирование,
где роль катализатора - (кислоты Льюиса)
выполняют хлорокись фосфора (POCl3 ),
тионилхлорид (SOCl2), фосген (COCl2).
Наиболее эффективна система ДМФА-POCl3,
в которой ДМФА служит и реагентом, и
растворителем. Электрофильным агентом
в реакции Вильсмейера-Хаака является
иминиевая соль, которая образуется при
взаимодействии ДМФА и хлорокиси фосфора,
тионилхлорида или фосгена.
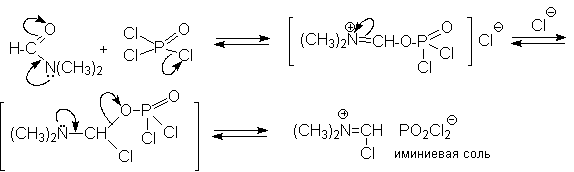
Иминиевая соль при необходимости может быть выделена в индивидуальном виде, например, при взаимодействии ДМФА с фосгеном, где после отщепления СО2 образуется соль (CH3)2N+ =CHCl Cl- . Однако обычно ее не выделяют и используют непосредственно после ее образования.
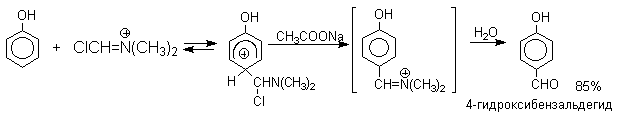
Реакция Вильсмейера-Хаака чрезвычайно проста в экспериментальном отношении и обеспечивает очень высокие выходы ароматических альдегидов, содержащих NR2,OR и ОН группу. Она оказывается практически ценной при формилировании конденсированных ароматических углеводородов - антрацена, азулена, пирена и др., а также разнообразных гетероциклических соединений ряда фурана, тиофена, пиррола, индола. В таблице 2 приведены сводные данные по формилированию фенолов, нафтолов, их простых эфиров.
Таблица 2
Исходное соединение |
Реагент |
Катализатор |
Условия реакции |
Продукт и выход % |
фенол |
ДМФА |
POCl3 |
ДМФА, 20оС |
4-оксибензальдегид, 85% |
резорцин |
HCN, HCl |
ZnCl2 |
эфир, -5оС |
2,4-дигидроксибензальдегид, 70% |
2-нафтол |
CHCl2OCH3 |
SnCl4 |
CH2Cl2, 20оС |
2-гидрокси-1-формилнафталин, 82% |
2-метоксинафталин |
ДМФА |
POCl3 |
ДМФА, 20оС |
2-метокси-1-нафтальдегид, 90% |
анизол |
Cl2CHOCH3 |
SnCl4 |
CH2Cl2, 0-20оС |
анисовый альдегид,67% |
анизол |
|
AlCl3 |
20оС |
анисовый альдегид, 67% |
анизол |
ДМФА |
POCl3 |
ДМФА |
анисовый альдегид, 21% |
анизол |
HCl |
Zn(CN)2 |
бензол, 40оС |
анисовый альдегид, 94% |