- •Вода h2o
- •Строение молекулы воды
- •Физические свойства воды
- •Аномалии воды
- •1. При обычных условиях вода – жидкость
- •2. При кристаллизации плотность воды понижается
- •3. Аномально высокая теплоемкость
- •4. Вода – очень хороший растворитель
- •Химические свойства воды
- •Галогены
- •История открытия
- •Распространение в земной коре
- •Химические свойства галогенов
- •Особенности химии фтора
- •Все уравнения приведены без коэффициентов
- •Общие химические свойства галогенов
- •7) Более активные галогены вытесняют менее активные из их соединений
- •8) Взаимодействуют с органическими соединениями
- •Получение галогенов
- •1) Действием сильных окислителей на соляную кислоту
- •2) Действием сильных окислителей на хлорид натрия
- •3) Особо чистый хлор получают разложением хлорида золота(III)
- •Применение галогенов и их соединений
Окончание Лекции № 3
Вода h2o
Вода – наиболее распространенная в природе жидкость. Поверхность Земли на 80 % покрыта водой. Жизнь зародилась в водной среде, и вода входит в состав всех живых существ, а также содержится в минералах, горных породах, почве и атмосфере. Вода является средой для протекания многих химических реакций.
Строение молекулы воды
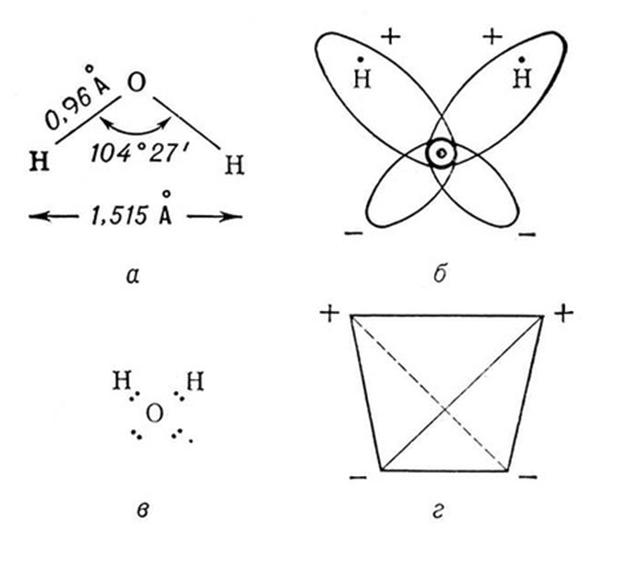
![]()
Атом кислорода находится в sp3-гибридном состоянии и имеет форму тетраэдра (рис. г). Электроны атомов водорода смещены в сторону более электроотрицательного атома кислорода, поэтому в молекуле воды существует разделение зарядов. То есть молекула воды является диполем: неподеленные электронные пары кислорода создают отрицательный полюс, а атомы водорода – положительный (рис. б).
Каждая молекула воды образует по 2 водородные связи:
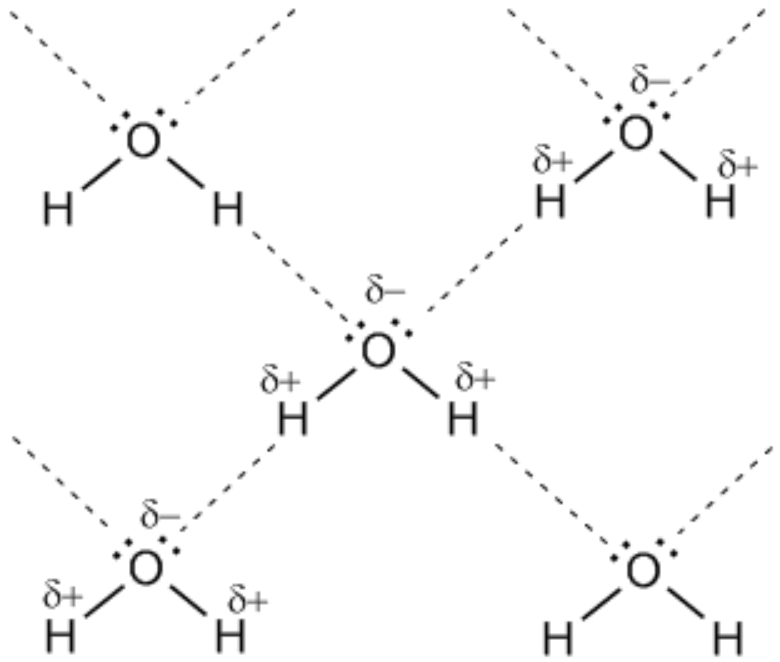
Эти связи полностью разрушаются только в парообразном состоянии.
Физические свойства воды
Вода – бесцветная жидкость без вкуса и запаха. tпл = 0 °C, tкип = 100 °С. Плотность 1 г/см3 (при 4 °С).
Аномалии воды
1. При обычных условиях вода – жидкость
Вода может находиться в жидком и даже в твердом состоянии (лед) в условиях, в которых похожие соединения водорода с более тяжелыми элементами (серой, селеном и т.д.) газообразны:
Сравнение водородных соединений по периоду |
CH4 |
NH3 |
H2O |
HF |
Температура кипения, °С |
-164 |
-33 |
+100 |
+20 |
Агрегатное состояние |
газ |
газ |
жидкость |
газ |
Сравнение водородных соединений по группе |
H2O |
H2S |
H2Se |
H2Te |
Температура кипения, °С |
+100 |
-60,4 |
-41,4 |
-2 |
Агрегатное состояние |
жидкость |
газ |
газ |
газ |
Это объясняется наличием большого числа водородных связей в воде.
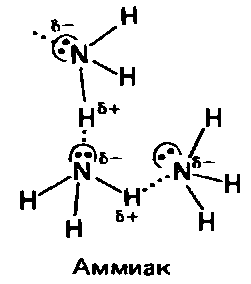
Аммиак NH3 и фтороводород HF также образуют водородные связи:
Точками обозначены неподеленные электронные пары, пунктиром обозначены водородные связи, δ- и δ+ – частично отрицательный и частично положительный заряды |
|
Однако только у
воды число неподеленных пар у
электроотрицательного атома равно
числу протонов![]() ,
поэтому только молекулы воды образуют
наиболее упорядоченную тетраэдрическую
структуру.
,
поэтому только молекулы воды образуют
наиболее упорядоченную тетраэдрическую
структуру.
2. При кристаллизации плотность воды понижается
Это объясняется тетраэдрической структурой льда, в которой расстояния между молекулами гораздо больше самих молекул, поэтому плотность льда меньше, чем у жидкой воды:
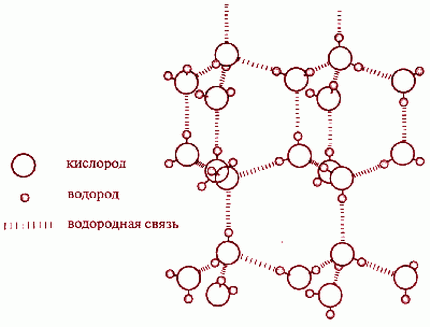
При плавлении льда часть (10‑15 %) водородных связей разрушается. Свободные пустоты заполняются молекулами воды, и плотность повышается. Максимальную плотность вода имеет при температуре +4 °С.
Аномалия плотности имеет огромное значение в жизни водоемов. Лед, имея меньшую плотность, всплывает на поверхность, а в на глубине сохраняется температура +4 °С. Если бы было наоборот, водоемы промерзали бы до дна. Энергии Солнца тогда не хватило бы, чтобы растопить всю замерзшую воду.