
- •Завдання
- •1 Завдання 1 2
- •2 Завдання 2 6
- •1 Завдання 1
- •1. 1 Принципова схема джерела нагріву при електрошлаковому зварюванні дротяним електродом
- •1. 2 Якісна характеристика процесу при електрошлаковому зварюванні дротяним електродом
- •1. 3 Параметри режиму зварювання при електрошлаковому зварюванні дротяним електродом
- •1. 4 Розрахункові схеми тіл, що зварюються та джерела нагріву при електрошлаковому зварюванні дротяним електродом
- •2 Завдання 2
- •2. 1 Принципова схема ручного дугового зварювання електродом, що плавиться
- •2. 2 Параметри режиму зварювання при ручному дуговому зварюванні електродом, що плавиться
- •2. 3 Розподіл температур вздовж електроду від дії джерела нагріву при ручному дуговому зварюванні (рдз) електродом, що плавиться
- •2. 3. 1 Нагрів електрода скінченної довжини струмом при рдз
- •2. 3. 2 Нагрів електрода скінченної довжини дугою при рдз
- •2. 3. 3 Розплавлення електрода скінченної довжини
- •3 Завдання 3
- •3. 1 Термодинамічні функції стану в зварювальних процесах
- •3. 1. 1 Внутрішня енергія
- •3. 1. 2 Ентальпія або тепломісткість
- •3. 1. 3 Ентропія
- •3. 1. 4 Вільна енергія Геймгольца (ізохорний потенціал)
- •3. 1. 5 Вільна енергія Гібса (ізобарний потенціал)
3. 1. 3 Ентропія
Ентропія (S) – показує безкорисно втрачену енергію при проходженні хімічної реакції (Дж/моль град).
Поняття ентропії введене Клаузіусом. Ентропія однозначно залежить від параметрів стану. Суть ентропії в слідуючому.
Нехай система переходить з стану 1 в стан 2 двома різними шляхами (рисунок 3.2).

Рисунок 3.2 — Схема переходу системи з положення 1 в положення 2
На
кожній елементарній ділянці шляху
приймається, що Т=const. Кожна така ділянка
поглинає кількість теплоти
![]() .
.
Якщо просумувати теплоти поділені на відповідні температури на переході системи з стану 1 в стан 2 за обома шляхами, то виявиться, що ці суми рівні. Взявши інтеграл по колу від цієї величини з’ясується, що він дорівнює нулю.
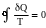
. (3.15)
![]()
Підінтегральну величину можна замінити повним диференціалом іншої
функції від тих же параметрів стану.
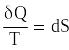
. (3.16)
 .
(3.17)
.
(3.17)
З останнього виразу випливає, що в обернених термодинамічних процесах зміна ентропії дорівнює нулю. В необернених самовільно протікаючих процесах по мірі розвитку процесів ентропія зростає (S >0), і в стані рівноваги ентропія приймає максимальне значення (S = Smax).
З цього слідує, що ентропія є мірою незворотності процесу чи кількісною мірою розсіяння, безкорисно використаної енергії. Розмірність ентропії кал·моль-1·гр. Ентропія характеризує кількість розсіяної енергії, віднесеної до одного градусу температури.
Для стандартних умов в діапазоні 0–298 К ентропія визначається за формулою (3.18)
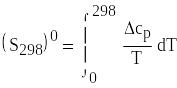
(3.18)
.
Вираз (3.18) справедливий, якщо в цьому інтервалі температур не відбуваються фазові чи полиморфні перетворення.
Значення ентропії для температур більше 298 К визначається виразом (6.49)
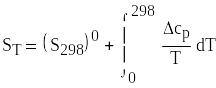
. (3.19)
До цього виразу зауваження теж саме. Якщо відбуваються полиморфні чи фазові перетворення, в записані вище вирази вносяться ентропії відповідних перетворень, які беруться з таблиць.
Термодинамічна функція ентропії використовується в тих випадках, коли маємо справу з відокремленими системами, тобто системами, для яких відсутній обмін енергії з зовнішнім середовищем (U=const, V=const).
3. 1. 4 Вільна енергія Геймгольца (ізохорний потенціал)
Для процесів у яких об’єм і температура постійні (T=const, V=const) використання термодинамічної функції ентропії незручне. В цьому випадку використовується функція F, яка введена Гельгольцем.
F має назву вільної енергії при постійному об’ємі, чи ізохорно–ізотермічного потенціалу, чи просто ізохорного потенціалу (Дж/моль).
F = U – TS . (3.20)
Згідно першого закону термодинаміки справедливий вираз (3.21).
![]() , (3.21)
, (3.21)
д![]() е
—
елементарна робота.
е
—
елементарна робота.
![]()
. (3.22)
З другого закону термодинаміки
![]()
. (3.23)
Тоді
![]()
. (3.24)
Проінтегрувавши вираз (3.24) при умові, що T=const, отримаємо
A2 – A1 = T(S2 – S1) – (U2 – U1) = –((U2 – TS2) – (U1 – TS1)) (3.25)
Позначимо
U2 – TS2 = F2 , (3.26)
U1 – TS1 = F1 . (3.27)
При ізотермічних зворотних процесах виконуєма робота максимальна
A2 – A1 = Amax , (3.28)
AmaxV = –( F2 – F1) = – F, (3.29)
де F — та частина внутрішньої енергії, яка може бути повністю перетворена в роботу (називається корисною роботою).
Та частина внутрішньої енергії, яка не пішла на використання внутрішньої роботи, називається зв’язанною енергією.
У зворотному термодинамічному процесі при T=const, V=const зміна вільної енергії дорівнює нулю ( F=0). Вільна енергія не змінюється. В необернених термодинамічних самовільно протікаючих процесах по мірі розвитку процесів вільна енергія зменшується, залишаючись меншою нуля, тобто від’ємною величиною.
В стані рівноваги системи вільна енергія наближається до мінімуму своєї величини (F = Fmіn).
