
- •Завдання
- •1 Завдання 1 2
- •2 Завдання 2 6
- •1 Завдання 1
- •1. 1 Принципова схема джерела нагріву при електрошлаковому зварюванні дротяним електродом
- •1. 2 Якісна характеристика процесу при електрошлаковому зварюванні дротяним електродом
- •1. 3 Параметри режиму зварювання при електрошлаковому зварюванні дротяним електродом
- •1. 4 Розрахункові схеми тіл, що зварюються та джерела нагріву при електрошлаковому зварюванні дротяним електродом
- •2 Завдання 2
- •2. 1 Принципова схема ручного дугового зварювання електродом, що плавиться
- •2. 2 Параметри режиму зварювання при ручному дуговому зварюванні електродом, що плавиться
- •2. 3 Розподіл температур вздовж електроду від дії джерела нагріву при ручному дуговому зварюванні (рдз) електродом, що плавиться
- •2. 3. 1 Нагрів електрода скінченної довжини струмом при рдз
- •2. 3. 2 Нагрів електрода скінченної довжини дугою при рдз
- •2. 3. 3 Розплавлення електрода скінченної довжини
- •3 Завдання 3
- •3. 1 Термодинамічні функції стану в зварювальних процесах
- •3. 1. 1 Внутрішня енергія
- •3. 1. 2 Ентальпія або тепломісткість
- •3. 1. 3 Ентропія
- •3. 1. 4 Вільна енергія Геймгольца (ізохорний потенціал)
- •3. 1. 5 Вільна енергія Гібса (ізобарний потенціал)
3 Завдання 3
3. 1 Термодинамічні функції стану в зварювальних процесах
Термодинамічні функції введені для аналізу конкретних процесів.
Термодинамічні функції:
U — внутрішня енергія.
H — ентальпія або тепломісткість
H = U + pV , (3.1)
де р — тиск;
V — об’єм.
S — ентропія.
F — вільна енергія Гельмгольца
F = U+TS. (3.2)
G — вільна енергія Гібса
G = H+TS. (3.3)
Основна властивість цих функцій крім ентропії у тому, що у спонтанно протікаючих термодинамічних процесах вони зменшуються і у стані термодинамічної рівноваги приймають мінімальні значення. Через часткові похідні цих функцій можна вивести значення будь–якого термодинамічного параметру. Самі ці функції виводяться з першого та другого законів термодинаміки.
3. 1. 1 Внутрішня енергія
Внутрішня енергія U (Дж·моль-1) — енергія яку мають усі тіла та системи. Саме за її допомогою відбуваються взаємодії між тілами, або частками одного тіла, та їх рух.
Повна внутрішня енергія визначається
U=Wкін+Wпот, (3.4)
де Wкін — кінетична енергія пов’язана з рухом часток;
Wпот — потенціальна енергія взаємодії між елементарними
частками або тілами.
Класична термодинаміка не оперує поняттям повної внутрішньої енергії, а лише розглядає ту її частину, яка здобуває зміни у наслідку зміни маси речовини, або параметрів стану
U=Wпот (3.5)
Внутрішня енергія — термодинамічна функція стану, тому що її значення не залежить від шляху процесу, а визначається лише абсолютним значенням термодинамічних параметрів.
Поняття внутрішньої U енергії тісно пов’язане з першим законом термодинаміки.
Перший закон термодинаміки встановлює енергетичний баланс між ізольованою системою та навколишнім середовищем. Базується на законі збереження енергії Ломоносова: на заміну зниклого виду енергії з’являється новий в суворо еквівалентній кількості.
Передана тілу енергія іде на виконання роботи і зміну внутрішньої енергії тіла або системи
Q=
![]() U+A
,
(3.6)
U+A
,
(3.6)
де Q — передана системі енергія;
U — зміна внутрішньої енергії термодинамічної системи;
A — робота, яку виконала термодинамічна система.
3. 1. 2 Ентальпія або тепломісткість
Ентальпія (Н) або тепломісткість (Дж/моль).
 1 2
1 2
Н1 Н2
Рисунок 3.1 — Схема переходу системи з положення 1 в положення 2
Якщо система прийшла з початкового положення 1 в кінцеве 2, то тепловий ефект на основі 1–го закону термодинаміки буде визначатись
Q12 = (U2+pV2) – (U1+pV1), (3.7)
H1=U1+pV1 , (3.8)
H2=U2+pV2 , (3.9)
де H1, H2 — тепломісткість системи у положенні 1 і 2 відповідно.
Тоді
Q12 = H2 – H1= H , (3.10)
де H — зміна ентальпії.
У загальному випадку
H= U+ pV , (3.11)
де H — термодинамічна функція стану, яка представляє з себе суму внутрішньої енергії і роботи розширення або об’ємної роботи pV, переданої в зовнішнє середовище.
З виразу (3.10) витікає, що поглинута теплота в процесі, який проходить при р=const, витрачається на приріст ентальпії. Перший закон термодинаміки можна записати у вигляді
Qp= Qv+ pV . (3.12)
Тобто тепловий ефект ізобарного процесу (Qp) відрізняється від теплового ефекту ізохорного процесу (QV) на величину виконаної роботи (pV). Якщо газова фаза відсутня, то рV=0 тоді Qp = QV.
З виразу (3.10) витікає
dQ = d( H) = cpdT , (3.13)
де cp — теплоємність при р=const;
H — зміна ентальпії для системи у якій не проходять
полиморфні перетворення і зміни агрегатного стану.
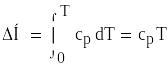
(3.14)
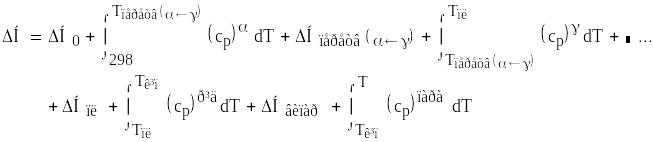
![]() ),
і зміна агрегатних станів, то
H
визначається за формулою
),
і зміна агрегатних станів, то
H
визначається за формулою
H0 — ентальпія початкового стану системи;
Hперетв, Hпл, Hвипар — ентальпія переходів із одного стану в інший;
cp — теплоємність при р=const.
