
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РФ
СЕВМАШВТУЗ
ФАКУЛЬТЕТ: IV
КАФЕДРА: ФИЗИКИ
Лабораторная работа
ОПРЕДЕЛЕНИЕ УНИВЕРСАЛЬНОЙ ГАЗОВОЙ ПОСТОЯННОЙ
СЕВЕРОДВИНСК
2001
ЛАБОРАТОРНАЯ РАБОТА № 6
ОПРЕДЕЛЕНИЕ УНИВЕРСАЛЬНОЙ ГАЗОВОЙ ПОСТОЯННОЙ
ЦЕЛЬ И МЕТОД РАБОТЫ
Определить численное значение универсальной газовой постоянной методом термостатирования.
ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ
На базе экспериментальных законов Бойля-Мариотта, Гей-Люссака, Шарля, Клапейрон установил, что для разреженных газов выполняется соотношение
![]() , (1)
, (1)
где P – давление газа (Па), V – объем газа (м3), T – абсолютная температура (К), C – газовая постоянная, зависящая от массы газа.
Соотношение (1)
называют уравнением Клапейрона. Известно,
что при нормальных условиях, т.е. при
P=1 атм.=1,013105
Па и T=273 К один моль
любого газа занимает один и тот же объем,
равный
![]() =22,4
литра=2,2410-2
м3, поэтому для одного моля газа
из соотношения (1) получаем:
=22,4
литра=2,2410-2
м3, поэтому для одного моля газа
из соотношения (1) получаем:
![]() ,
,
или ![]() ,
,
![]() , (2)
, (2)
где величина R=8,31
![]() одинакова для всех газов и называется
молярной газовой постоянной или
универсальной газовой постоянной.
одинакова для всех газов и называется
молярной газовой постоянной или
универсальной газовой постоянной.
Для произвольной массы m газа его объем V можно записать в виде:
![]() ,
,
откуда ![]() , (3)
где
, (3)
где
![]() - масса одного моля газа (кг/моль);
- масса одного моля газа (кг/моль);
![]() - объем одного моля газа
- объем одного моля газа
![]()
Подставляя соотношение (3) в (2) получим:
![]() (4)
(4)
Уравнение (4) называется уравнением Клапейрона-Менделеева. Оно справедливо для реальных газов при давлениях, существенно не превосходящих атмосферное, и для так называемых идеальных газов. Идеальным газом называется газ, между молекулами которого отсутствуют силы взаимного притяжения и отталкивания, а сами молекулы имеют пренебрежимо малый объем. Идеальный газ определяется требованием подчинения законам Бойля-Мариотта, Гей-Люссака и Шарля.
Состояние газа или системы характеризуется параметрами состояния, т.е. значениями P, V и T. Если параметры состояния не изменяются бесконечно долгое время, то состояние называется равновесным. Переход газа (или системы) из одного равновесного состояния с параметрами P1 , V1 и T1 в другое равновесное состояние с параметрами P2 , V2 и T2 называется процессом. Если процесс состоит из последовательности равновесных промежуточных состояний, то процесс называется равновесным.
Процесс, происходящий при постоянном давлении P=const, называется изобарическим.
Процесс, происходящий при постоянной температуре T=const, называется изотермическим.
Процесс, происходящий при постоянном объеме V=const, называется изохорическим.
Рассмотрим
изобарический процесс расширения газа
из состояния P1,
V1 и T1
в состояние P2
, V2 и T2
(рис.1). Представим себе газ, заключенный
в цилиндр с поршнем, движением которого
изменяется объем газа. Будем считать,
что движение поршня происходит без
трения. Площадь поршня равна S.
Сила F, создаваемая
давлением P1
газа на поршень площади S,
равна
![]() и, следовательно, работа, совершаемая
газом при перемещении поршня на величину
dh, равна
и, следовательно, работа, совершаемая
газом при перемещении поршня на величину
dh, равна
![]() ,
где
,
где
![]() - изменение объема газа.
- изменение объема газа.
Условились считать, что работа, произведенная газом при увеличении его объема, имеет положительный знак, а работа произведенная внешними силами над газом, имеет отрицательный знак.
Работа изобарического расширения газа из состояния P1, V1, T1 в состояние P2 , V2 , T2 определяется интегралом
![]() . (5)
. (5)
Т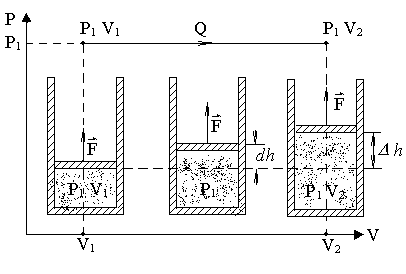 ак
как при расширении газа объем увеличивается,
то для сохранения постоянства давления
к газу необходимо подводить теплоту Q.
ак
как при расширении газа объем увеличивается,
то для сохранения постоянства давления
к газу необходимо подводить теплоту Q.
Объем газа V1 в начальном состоянии согласно уравнения (4), равен
Рис. 1 Изобарический процесс расширения газа в координатах PV.
![]() ,
(6)
,
(6)
а объем газа V2 в конечном состоянии будет равен
![]() .
(7)
.
(7)
Из уравнений (6) и (7) получаем
![]() . (8)
. (8)
Подставив выражение (8) в уравнение (5) будем иметь:
![]() . (9)
. (9)
Если масса газа m
равна массе одного моля газа ,
а в процессе изобарического расширения
температура газа увеличилась на 1К,
т.е.![]() =1К,
то из уравнения (9) мы получим
=1К,
то из уравнения (9) мы получим
![]() (10)
(10)
Таким образом, универсальная газовая постоянная R численно равна работе, совершаемой одним молем идеального газа при изобарическом расширении вследствие нагревания на один Кельвин.
3. ВЫВОД РАБОЧЕЙ ФОРМУЛЫ
В результат проведения лабораторной работы известны:
Объем воздуха в сосуде V.
Атмосферное давление P.
Плотность воздуха в сосуде .
Изменение объема V воздуха в сосуде в результате изменения температуры воздуха на величину T при P=const.
Рассчитать универсальную газовую постоянную.
При расширении воздуха в условиях P=const, работа, совершаемая воздухом равна
![]() , (11)
, (11)
где
![]() -
изменение объема воздуха при расширении.
-
изменение объема воздуха при расширении.
Приравнивая правые и левые части уравнений (9) и (11), получим
![]() , (12)
, (12)
где
![]() -
изменение температуры воздуха в сосуде; m
- масса воздуха в сосуде.
-
изменение температуры воздуха в сосуде; m
- масса воздуха в сосуде.
Изменение объема воздуха можно определить по изменению уровня жидкости в левом колене манометра (см. рис. 2), вызванное расширением воздуха при его нагреве:
![]() , (13)
, (13)
где S – площадь поперечного сечения трубки манометра;
![]() -
изменение уровня жидкости в левом колене
манометра, взятое по шкале в мм.
-
изменение уровня жидкости в левом колене
манометра, взятое по шкале в мм.
Массу m воздуха в сосуде можно определить по плотности воздуха, взятой из таблиц в зависимости от температуры и давления при начальных условиях опыта, т.е.
![]() . (14)
. (14)
С учетом (13) и (14) из уравнения (12) получим
![]() - рабочая формула.
- рабочая формула.
Величина
![]() для воздуха равна 29 10-3
для воздуха равна 29 10-3
![]() .
.
Описание опытной установки
В данной лабораторной работе требуется определить численное значение универсальной газовой постоянной с помощью установки, принципиальная схема которой представлена на рис.2.
Рис. 2 Принципиальная схема установки
Опытная установка включает в себя термостат Т, манометр М, сосуд с воздухом В. Сосуд с воздухом вмонтирован в термостат, залитый водой, и соединен герметично резиновой трубкой с манометром. С помощью крана К1 сосуд с воздухом может быть соединен с атмосферой. Термостат имеет нагреватель Н, включаемый тумблерами «Нагрев 1500 Вт» и «Нагрев 700 Вт», и холодильник Х, через который пропускается проточная холодная вода. С помощью крана К2 можно включать или отключать проточную воду. Для перемешивания воды в термостате имеется мешалка ММ, приводимая в действие электродвигателем, установленным на термостате. Включение электродвигателя производится тумблером «электродвигатель». Холодильник предназначен для создания необходимой температуры воздуха в начале опыта. В процессе нагрева сосуда с воздухом нагреватель должен быть включен, а холодильник отключен (кран К2 закрыт). Мешалка позволяет выравнивать температуру воды по всему объему термостата и в процессе проведения опыта должна быть включена. Температура воды в термостате измеряется термометром Т1, а температура воздуха в сосуде термометром Т2. При нагревании воды в термостате через стенки сосуда В нагревается воздух, который, расширяясь, понижает уровень жидкости в левом колене манометра на h (см. рис. 2). В результате этого давление внутри сосуда будет больше атмосферного на некоторую величину P, определяемую разностью уровней жидкости (воды) в манометре. Однако, если разность уровней жидкости в манометре не превосходит 10 см, то это составит не более 1% от атмосферного давления P. Поэтому можно считать, что в процессе проведения опыта давление воздуха в сосуде постоянное и равно атмосферному давлению, которое определяется по барометру в лаборатории.
Порядок проведения работы
По барометру определить давление P окружающей среды, записать его в Па.
Тумблеры «нагрев» термостата поставить в положение «выключено». Подключить термостат в сеть 220 В.
Краном К1 сосуд с воздухом соединить с атмосферой, при этом разность уровней жидкости в манометре должна быть равна нулю.
Включить электродвигатель механической мешалки.
Зафиксировать по термометру Т1 температуру воды в термостате, а по термометру Т2 температуру воздуха в сосуде. Если температура воздуха в термостате не равна температуре воды в термостате, то подождать, пока они не станут равными.
При достижении равновесного состояния воздуха в сосуде (температура воздуха в сосуде по термометру Т2 и температура воды в термостате по термометру Т1 станут равными, а показания термометров перестанут изменяться) закрыть кран К1 и включить нагреватель термостата тумблерами “Нагрев 1500 Вт” и “Нагрев 700 Вт”
Нагреть воду в термостате по термометру Т1 на
 и выключить нагреватель термостата.
и выключить нагреватель термостата.Наблюдая за изменением уровня жидкости в левом колене манометра и изменением температуры воздуха в сосуде по термометру Т2 дождаться равновесного состояния воздуха в сосуде, в котором температура воздуха по термометру Т2 и температура воды в термостате станут равными. В равновесном состоянии записать изменение температуры воздуха в сосуде по термометру Т2 и изменение уровня жидкости в левом колене манометра.
Открыть кран К1 и выровнять уровни жидкости в манометре.
Закрыть кран К1 и аналогично провести еще 4 раза измерения и .
Открыть кран К2 и охладить воду в термостате до начальной температуры.
Закрыть кран К2.
Выключить установку.
