
- •Методические указания к учебной практике студентов 3 курса
- •2.1 Водоструйный насос
- •2 .2 Аппарат Сокслета
- •2.3 Контактный термометр
- •2.4 Задание для самостоятельной работы
- •3.1 Приготовление титрованных растворов
- •3.1.1 Фиксаналы
- •3.1.2 Общие правила при приготовлении титрованных растворов
- •3.1.3 Установка титра раствора или определение коэффициента поправки.
- •3.1.4 Общие правила при определении коэффициента поправки
- •3.2 Способы выражения содержания растворенного вещества
- •3.3 Задание для самостоятельной работы
- •4.1 Определение сорбционных характеристик ионообменных волокон
- •4.2 Определение степени набухания волокон с особыми свойствами
- •4.3 Задание для самостоятельной работы
- •5.1. Потенциометрическое титрование.
- •5.2 Определение обменной емкости с помощью кривых
- •5.3 Задание для самостоятельной работы
- •6.1.Углеродные волокна и их применение
- •6.2 Оценка сорбционно-кинетических характеристик по сорбции красителя метиленового голубого
- •6.3 Задание для самостоятельной работы
- •7.1 Задание для самостоятельной работы
5.1. Потенциометрическое титрование.
Потенциометрия как электрохимический метод исследования и анализа заключается в измерении электродного потенциала и нахождении зависимости между его величиной и концентрацией (точнее, активностью) потенциалопределяющего компонента в растворе. Используя эту зависимость, можно установить не только активность ионов, но и ряд характеристик, изучаемых равновесных, химических, биологических и других систем. С другой стороны, проследив во время химической реакции за изменением электродного потенциала, можно судить об изменение концентрации реагирующих веществ в растворе. Таком приемом, например, пользуются в производстве при непрерывном технологическом контроле химических процессов и при количественном определении веществ. В последнем случае имеется в виду широко используемый в аналитической химии метод потенциометрической индикации конечной точки титрования (к.т.т.).
К достоинствам потенциометрии как метода анализа относится простота аппаратурного оформления, применимого в разных конкретных условиях.
Потенциометрическая индикация к.т.т., как и визуальная, преследует чисто прикладную цель количественного определения исследуемого вещества. Но по сравнению с последней потенциометрический метод обладает рядом существенных преимуществ:
Как инструментальный метод исключает субъективные ошибки, связанные с визуальным определением к.т.т.
Более чувствителен, т.е. при той же величине погрешности можно понизить предел определяемых концентраций.
Позволяет осуществлять титрование в мутных и окрашенных растворах.
Легко поддаётся автоматизации процесса титрования.
К химической реакции, применяемой в потенциометрическом титровании, предъявляют те же требования, что и в обычном титрометрическом методе:
достаточно большая скорость реакции;
количественное протекание её в нужном направлении;
реакция должна обладать большой константой равновесия;
строгая стехеометричность;
отсутствие побочных реакций на ряду с основной.
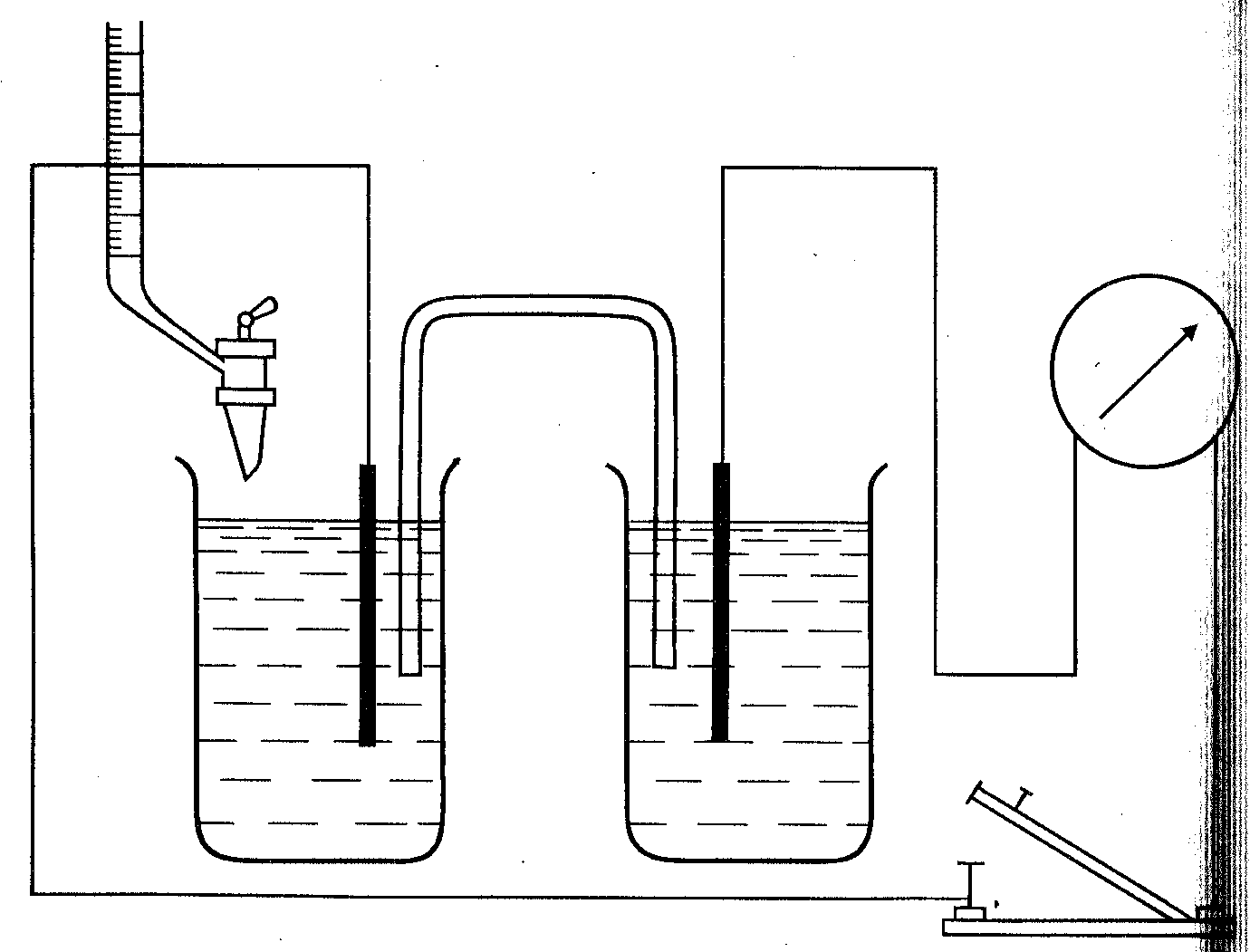
Рисунок 5.Схема установки для титрования до точки эквивалентности:
В установке должен быть прибор для
измерения ЭДС, электрод сравнения с
неизменным, известным потенциалом и
индикаторный электрод, потенциал
которого изменяется с изменением
концентрации исследуемого вещества
(иона).
установке должен быть прибор для
измерения ЭДС, электрод сравнения с
неизменным, известным потенциалом и
индикаторный электрод, потенциал
которого изменяется с изменением
концентрации исследуемого вещества
(иона).
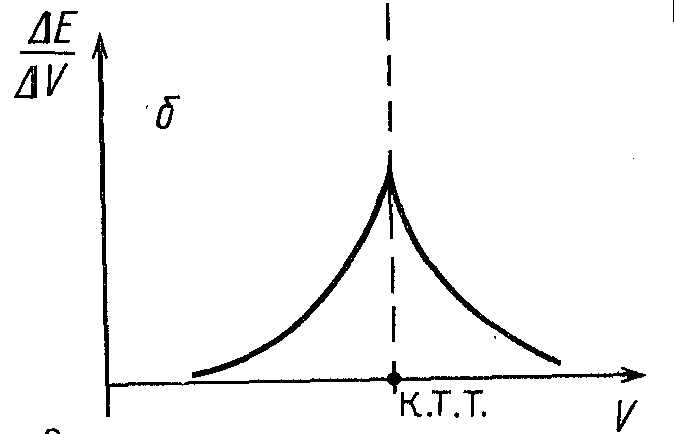
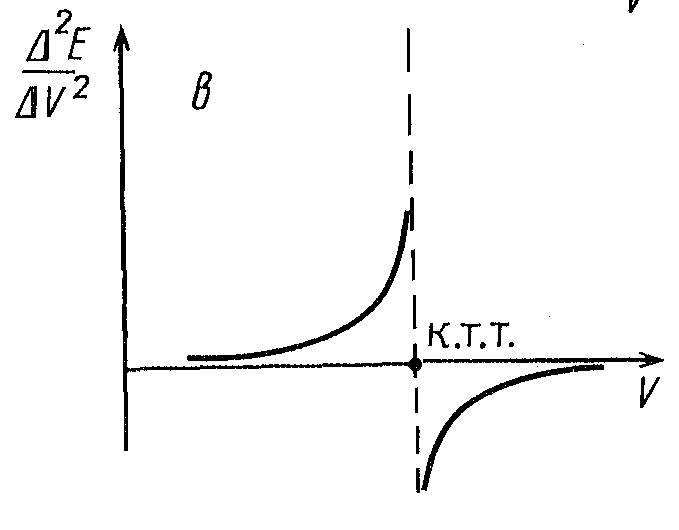
Рисунок 6. Формы кривых потенциометрического титрования.
5.2 Определение обменной емкости с помощью кривых
потенциометрического титрования
Волокно, взятое для потенциометрического исследования, предварительно заряжают в кислую форму. Для этого его заливают НС1 с концентрацией 1 моль/л при модуле ванны 100, выдерживают в течение I ч, отжимают между листами фильтровальной бумаги и центрифугируют в течение 20 мин при частоте вращения 5000 мин-1. Затем высушивают при 80°С.
Потенциометрическое титрование проводят методом многих навесок. В 25 колб емкостью 50 мл помещают по 0,2500 г воздушно-сухого волокна. В колбы приливают возрастающие объемы КС1 с концентрацией 0,5 моль/л и недостающие до 25 мл объемы титранта – раствор КОН с концентрацией 0,1 моль/л, приготовленный в растворе КС1 с концентрацией 0,5 моль/л. Смеси выдерживают в течение 24 ч при периодическом перемешивании и затем измеряют рН с помощью рН-метра. Кривую потенциометрического титрования строят в координатах рН – Скон (ммоль/г) (Рисунок 7)
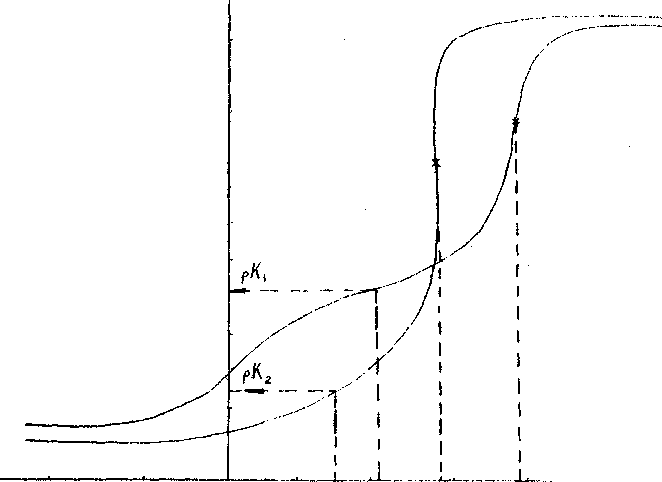 pH
pH
Скон
Рисунок 7. Пример кривых потенциометрического титрования
Для определения обменной емкости на кривой потенциометрического титрования находят точку, соответствующую середине скачка. Эта точка является точкой полной нейтрализации. Скачок на кривой титрования соответствует концентрации функциональных групп в ионите и численно равен количеству титранта (моль/г), пошедшего на титрование.
