
- •Методические указания к учебной практике студентов 3 курса
- •2.1 Водоструйный насос
- •2 .2 Аппарат Сокслета
- •2.3 Контактный термометр
- •2.4 Задание для самостоятельной работы
- •3.1 Приготовление титрованных растворов
- •3.1.1 Фиксаналы
- •3.1.2 Общие правила при приготовлении титрованных растворов
- •3.1.3 Установка титра раствора или определение коэффициента поправки.
- •3.1.4 Общие правила при определении коэффициента поправки
- •3.2 Способы выражения содержания растворенного вещества
- •3.3 Задание для самостоятельной работы
- •4.1 Определение сорбционных характеристик ионообменных волокон
- •4.2 Определение степени набухания волокон с особыми свойствами
- •4.3 Задание для самостоятельной работы
- •5.1. Потенциометрическое титрование.
- •5.2 Определение обменной емкости с помощью кривых
- •5.3 Задание для самостоятельной работы
- •6.1.Углеродные волокна и их применение
- •6.2 Оценка сорбционно-кинетических характеристик по сорбции красителя метиленового голубого
- •6.3 Задание для самостоятельной работы
- •7.1 Задание для самостоятельной работы
3.2 Способы выражения содержания растворенного вещества
Содержание растворенного вещества в растворе может быть выражено либо безразмерными единицами – долями, либо величинами размерными – концентрациями. Ниже приведены наиболее часто употребляемые в химии способы выражения содержания растворенного вещества в растворе:
Массовая доля (С) – отношение (обычно в процентах) массы растворенного вещества к общей массе раствора; например, С = 9,25 % (масс.)
Молярная доля (Ni) – отношение количества растворенного вещества (или растворителя) к сумме количеств всех веществ, находящихся в растворе. Например, в системе, состоящей из растворителя и единственного растворенного вещества, молярная доля последнего (N2) равна:
![]()
а молярная доля растворителя (N1) равна:
![]()
где
![]() и
и
![]() – соответственно количество вещества
растворителя и количество растворённого
вещества.
– соответственно количество вещества
растворителя и количество растворённого
вещества.
Молярная концентрация – отношение количества растворённого вещества к объёму
или
молярность (![]() или М) –
раствора; например, 1,5 М раствор или
или М) –
раствора; например, 1,5 М раствор или
![]()
Моляльная концентрация – отношение количества растворённого вещества к массе
или
моляльность (m)
– растворителя;
например, m
= 1,5 моль/кг (![]() )
)
Эквивалентная концентрация – отношение числа эквивалентов растворенного вещества
или нормальность (Сн или н) – к объему раствора; например, 0,75 н. раствор или
Сн =0,75 г.экв/л
3.3 Задание для самостоятельной работы
Подготовить условия 5 задач и решения к ним на тему «Способы выражения концентрации растворов»
4. Получение ионообменных волокон на основе полиакрилонитрильного волокна и изучение его свойств
Для получения ионообменного волокна используют свежесформованное полиакрилонитрильное волокно (тройной сополимер). В колбу емкостью 200-250 мл вносят модифицирующий раствор гидроокиси натрия соответствующей концентрации. Колбу с раствором помещают на водяную баню, нагревают до необходимой температуры. После нагрева модифицирующей ванны в колбе до требуемой температуры в модифицирующую ванну вносят навеску полиакрилонитрильного волокна (модуль ванны 100) и проводят обработку при заданной температуре в течение необходимого времени.
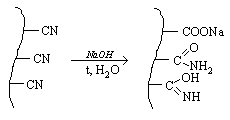
Рисунок 6.
На рисунке 6 представлена схема реакций, происходящих при омылении.
Волокно сначала окрашивается в желтый цвет, а затем последовательно в темно-желтый и бурый. Увеличение концентрации щелочи ускоряет процесс изменения цвета. Продолжительность омыления до заданной степени (о чем судят по сорбционной емкости) увеличивается с уменьшением концентрации NaOH.
4.1 Определение сорбционных характеристик ионообменных волокон
Общую обменную емкость (ООЕ) ионообменных волокон определяют методом обратного титрования в статических условиях. Образцы волокон массой 0,5 г обрабатывают растворов NaOH с концентрацией 0,1 моль/л, при этом происходит полная перезарядка в Na/OH форму. Волокна отмывают от избытка щелочи раствором NaOH с концентрацией 3,3 ммоль/л. Для определения ООЕ высушенные до постоянной массы (0,5 г) образцы заливают соляной кислотой ( 0,1 моль/л) при модуле ванны 100, через 45 минут отбирают 10 мл раствора и оттитровывают NaOH c концентрацией 0,1 моль/л, по метилоранжу. ООЕ рассчитывают по формуле:
![]()
Где: А- объем раствора гидроксида натрия с концентрацией 0,1 моль/л, пошедшего на титрование, мл;
fщ – фактор раствора гидроксида натрия с концентрацией 0,1 моль/л;
С-концентрация соляной кислоты, моль/л;
fк – фактор соляной кислоты;
В- масса волокна, г
5- отношение общего объема раствора, соляной кислоты к объему аликвоты, взятой на титрование.
