- •Часть 1. Компьютерное моделирование электронной структуры фуллерена с60
- •Введение
- •Лабораторная работа №1 «Основы работы в редакторе GaussView пакета Gaussian03»
- •1.1 Теоретическая часть
- •1.1.1 Программный комплекс Gaussian03
- •1.1.2 Редактор GaussView
- •1.2 Практическая часть
- •1.2.1 Построение молекул c использованием библиотек редактора GaussView
- •1.2.2. Примеры задания конфигурации молекул в редакторе GaussView
- •Вопросы
- •Лабораторная работа №2 «Численное моделирование электронной структуры молекул с использованием пакета Gaussian03»
- •2.1 Теоретическая часть
- •2.1.1 Основные методы расчета молекулярных структур
- •2.1.2 Неэмпирические методы расчета
- •2.1.2.1 Метод Хартри-Фока
- •2.1.2.2 Метод теории функционала плотности
- •2.1.3 Основные квантово- механические базисы
- •2.2 Практическая часть
- •2.2.1 Использование Gaussian Calculation Setup для установки параметров расчетов
- •2.2.2 Контрольный пример. Расчет характеристик молекулы кислорода o2
- •2.2.2.1 Визуализация электронной структуры атома кислорода
- •2.2.2.2 Зависимость полной энергии двух атомов кислорода от расстояния между ними
- •2.2.2.3 Расчет равновесного расстояния молекулы кислорода
- •Лабораторная работа №3 «Молекулярное строение и электронная структура молекулы фуллерена с60»
- •3.1 Теоретическая часть
- •3.1.1 Молекулярное строение фуллеренов c60
- •3.1.2 Получение фуллеренов
- •3.1.3 Свойства фуллеренов
- •3.1.4 Применение фуллеренов
- •3.1.5 Фуллериты
- •3.1.6 Электронная структура фуллеренов с60
- •3.2 Практическая часть
- •3.2.1 Электронная структура молекулы фуллерена с60
- •Вопросы
- •Лабораторная работа №4 «ик- спектр изолированной молекулы фуллерена с60»
- •4.1 Теоретическая часть
- •4.1.2 Колебательный спектр двухатомной молекулы
- •4.1.3 Колебания многоатомных молекул
- •4.2 Практическая часть
- •4.2.1 Расчет нормальных колебательных мод в Gaussian
- •4.2.2 Расчет структуры и колебательного спектра молекулы воды
- •Вопросы:
- •Лабораторная работа №5 «ик- спектр молекулы фуллерена с60 в растворах»
- •5.1 Теоретическая часть
- •5.1.1 Типы растворов
- •5.1.2 Растворимость фуллеренов
- •5.2 Практическая часть
- •5.2.1 Учет эффектов сольватации при расчетах в Gaussian03
- •Вопросы:
- •Литература
- •Глоссарий терминов.
- •Приложение 1. Панель меню и панель команд редактора GaussView.
- •Приложение 2. Настройки параметров расчетов Gaussian03.
- •Приложение 3. Справочная информация о неорганических молекулах
- •Приложение 4. Справочная информация об органических молекулах
- •Приложение 5. Правила оформления лабораторных работ
3.2 Практическая часть
3.2.1 Электронная структура молекулы фуллерена с60
Молекула фуллерена С60 содержится
в библиотеке циклических соединений
![]() редактора
GaussView. Заходим в библиотеку циклических
соединений редактора, в правом нижнем
углу окна выбираем иконку
редактора
GaussView. Заходим в библиотеку циклических
соединений редактора, в правом нижнем
углу окна выбираем иконку
![]() .
Осуществляем процесс оптимизации
методом DFT LSDA
в базисе 3-21G.
.
Осуществляем процесс оптимизации
методом DFT LSDA
в базисе 3-21G.
Задание 1. Методом DFT B3LYP 6-31(d)G выполнить оптимизацию линейных структур из атомов углерода с числом атомов n=2…10. Начальное расстояние между атомами во всех случаях взять равным 1.3552 Å. Рассчитать энергии связи эВ/атом по формуле:
![]()
Задание 2. Методом DFT B3LYP 6-31(d)G выполнить оптимизацию углеродного гексагона (рис.3.10). Длины связей r=1.3948 Å.

Рис. 3.10 Гексагон с атомами углерода в вершинах
Задание 3. Визуализировать молекулярные орбитали гесагона и линейной структуры С6.
Задание 4. Оптимизировать молекулу фуллерена С60 методом DFT B3LYP 6-31(d)G.
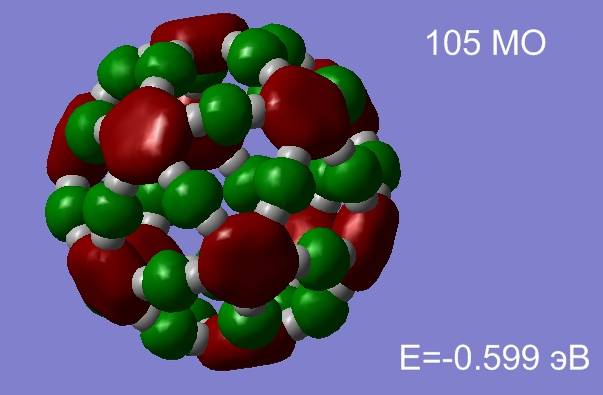
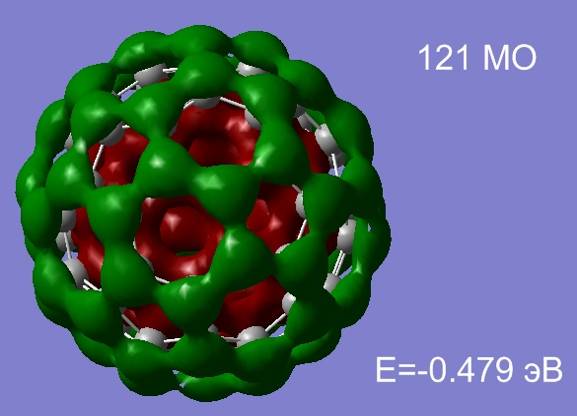
После окончания процесса оптимизации открываем *.chk файл с результатами расчетов. Открываем редактор молекулярных орбиталей, выбираем 105 и 121 МО, нажимаем Update, результаты визуализации представлены на рис.3.9.
МО 105 относится к σ- электронной системе обеспечивающей высокую стабильность молекуле, 121 МО является представителем легко поляризуемой π- электронной системы.
|
|
Рис.3.11 Распределение электронной плотности 105 и 121 МО фуллерена С60.
Задание 5. Построить диаграмму уровней молекулы фуллерена С60. Визуализировать 60, 61, 64, 180 МО.
Задание 4*. Преобразовать молекулу фуллерена C60 в молекулу C70 (см. пункт 3.1.1).
Вопросы
Особенности молекулярного строения фуллерена С60.
Фуллерит. Полупроводниковые свойства фуллерита С60.
Особенности электронного строения молекулы С60. Объяснить ЯМР-спектр фуллеренов С60.
Основные методы получения фуллеренов.
Масс-спектр углеродных кластеров в высокотемпературной плазме.
Механизмы самосборки молекул фуллеренов в процессе синтеза.
Свойства фуллеренов С60.
Области применения фуллеренов.
Форма отчетности:
В электронном виде, в соответствии общим требованиям (см. приложение). Представить диаграмму уровней атома углерода. Представить значения полной энергии молекулы С60 в синглетном и триплетном состояниях. Представить диаграмму уровней и визуализированные МО фуллерена С60.
При сдаче работы необходимо знать ответы на вопросы лабораторной работы №3.
Лабораторная работа №4 «ик- спектр изолированной молекулы фуллерена с60»
Цель работы: численный расчет ИК-спектра молекулы фуллерена С60 как способа идентификатора молекулы.
4.1 Теоретическая часть
4.1.1 ИК-спектроскопия как метод идентификации молекул
ИНФРАКРАСНАЯ (ИК) спектроскопия- раздел молекулярной оптической спектроскопии, изучающий спектры поглощения и отражения электромагнитного излучения в ИК области, т.е. в диапазоне длин волн от 10-6 до 10-3 м. Инфракрасную область спектра обычно условно разделяют на:
1. ближнюю (l от 0,74 до 2,5 мкм);
2. среднюю (2,5-50 мкм);
3. далёкую (50-2000 мкм).
ИК спектроскопия является одним из основных методов анализа органических соединений, позволяет идентифицировать пространственные и конформационные изомеры, изучать внутри- и межмолекулярные взаимодействия, характер химических связей, распределение зарядов в молекулах, фазовые превращения, кинетику химических реакций, регистрировать короткоживущие (время жизни до 10-6 с) частицы, уточнять отдельные геометрические параметры, получать данные для вычисления термодинамических функций и др.
Атомы в молекулах испытывают колебательные движения. Колебательная энергия квантована, т.е. поглощаемая энергия изменяется дискретно. В результате колебательный спектр молекулы представляет собой ряд пиков. Возникающие полосы поглощения появляются в результате переходов между колебательными уровнями электронного состояния системы. Большинство колебательных переходов в молекулах органических соединений реализуется в диапазоне длин волн λ от 2.5 до 25 мкм или в единицах волновых чисел, обратных длинам волн, 4000-400 см-1.
Для регистрации спектров используют классические спектрофотометры и фурье-спектрометры. Основные части классического спектрофотометра - источник непрерывного теплового излучения, монохроматор, приемник излучения. Кювета с веществом помещается перед входной щелью Источники излучения - накаливаемые электрическим током стержни из различных материалов. Приемники: чувствительные термопары, металлические и полупроводниковые термосопротивления и газовые термопреобразователи. Достоинства приборов классической схемы: простота конструкции, относительная дешевизна. Недостатки: невозможность регистрации слабых сигналов из-за малого отношения сигнал: шум, что сильно затрудняет работу в далекой ИК области; сравнительно невысокая разрешающая способность (до 0,1 см-1), длительная (в течение минут) регистрация спектров.
Основным элементом фурье-спектрометров является интерферометр. Поток излучения от источника делится на два луча, которые проходят через образец и интерферируют. Разность хода лучей варьируется подвижным зеркалом, отражающим один из пучков. Для получения спектра в обычной форме производится соответствующее фурье-преобразование с помощью встроенной ЭВМ. Достоинства фурье-спектрометра: высокое отношение сигнал/шум, быстрая (за секунды и доли секунд) регистрация спектра, высокая разрешающая способность (до 0,001 см-1). Недостатки: сложность изготовления и высокая стоимость.
Кюветы для ИК спектрофотометров изготовляют из прозрачных в ИК области материалов. В качестве растворителей используют обычно ССl4, СНСl3, тетрахлорэтилен, вазелиновое масло. Твердые образцы часто измельчают, смешивают с порошком КВr и прессуют таблетки. Влияние воздуха устраняют вакуумированием прибора или продувкой его азотом.
В ИК- спектрометрии очень важным является понятие характеристичности нормальных колебаний, т.е. соответствия их определенной функциональной группе. Характеристичность по частоте проявляют колебания многих групп в органических соединениях, например, C=O, C=C, O-H, C-H и др. Именно характеристичность колебаний позволяет использовать ИК- спектроскопию для идентификации органических соединений, при этом можно выделить три основные области:
1. 4000-2500 см-1. Область валентных колебаний простых связей X-H: O-H, N-H, C-H, S-H.
2. 2500-1500 см-1. Область валентных колебаний кратных связей X=Y, X≡Y: C=C, C=O, C=N, C≡C, C≡N.
3. 1500-500 см-1. Область валентных колебаний простых связей X-Y: C-C, C-N, C-O и деформационных колебаний простых связей X-H: C-H, O-H, N-H. Эта область также называется “областью отпечатков пальцев”, т.к. положение и интенсивность полос поглощения в этом диапазоне сугубо индивидуальны для каждого конкретного органического соединения. Только по полному совпадению частот и интенсивностей линий в этой области ИК- спектра можно говорить об идентичности сравниваемых объектов.