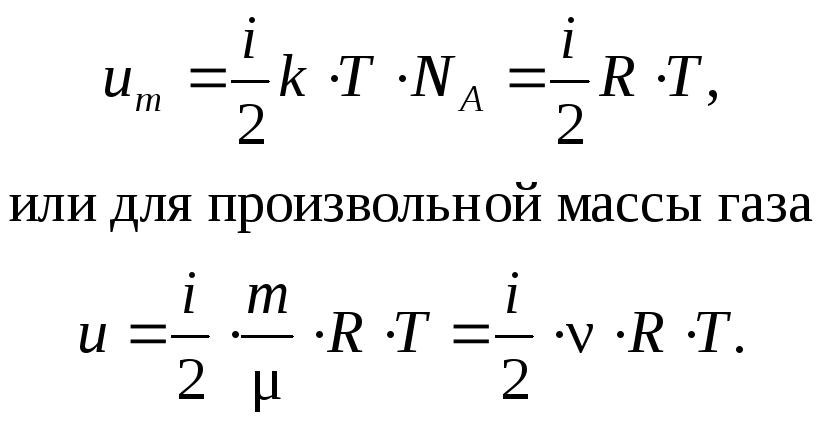- •Статистические и термодинамические методы, опытные законы идеальных газов.
- •Уравнение клапейрона-менделеева.
- •Основное уравнение молекулярно-кинетической теории газа.
- •При каждом соударении молекула, движущаяся перпендикулярно площадке, передает импульс
- •Закон максвелла о распределении молекул идеального газа по скоростям и энергиям теплового движения.
- •При возрастании скорости множитель
- •Параметрическая формула распределения больцмана.
- •Среднее число столкновений. Средняя длина свободного пробега.
- •Явление переноса в термодинамических неравновесных системах.
- •Число степеней свободы молекул. Закон равномерного распределения энергии по степеням свободы молекул.
Число степеней свободы молекул. Закон равномерного распределения энергии по степеням свободы молекул.
Важной характеристикой термодинамической системы является ее внутренняя энергия u. Энергия хаотического теплового движения микрочастиц системы, молекул, атомов, электронов, ядер и т.д., а также энергии взаимодействия этих частиц.
К внутренней энергии не относятся кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях. Внутренняя энергия – это однозначная функция термодинамического состояния системы, т.е. в каждом состоянии система обладает вполне определенной внутренней энергией, и она не зависит от того, как система пришла в данное состояние. Это означает, что при переходе системы из одного состояния в другое изменение внутренней энергии определяется только разностью значений внутренних энергий этих состояний и не зависит от пути перехода.
ОПРЕДЕЛЕНИЕ: Число независимых переменных или координат, полностью определяющих положение системы в пространстве, называется числом степеней свободы.
В ряде задач молекулу одноатомного газа рассматривают как материальную точку, которой приписывают три степени свободы поступательного движения. В классической механике молекула двухатомного газа в первом приближении рассматривается как совокупность двух материальных точек, жестко связанных недеформированной связью. Эта система кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения. Таким образом, двухатомный газ обладает пятью степенями свободы. Трехатомные и многоатомные нелинейные молекулы имеют число степеней свободы равное 6. Т.к. жесткой связи между атомами не существует, то для реальных молекул необходимо учитывать степени свободы колебательных движений. Независимо от общего числа степеней свободы молекул, три всегда являются поступательными; ни одна из поступательных не имеет преимущество перед другими, поэтому на каждую из них приходится в среднем одинаковая энергия, равная 1/3кинетической энергии молекулы
![]()
Таким образом,
![]()
В классической статистической физике выводится закон Больцмана о равномерном распределении по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степень свободы приходится в среднем кинетическая энергия, равная одной второй kT, а на каждую колебательную – в среднем энергия, равная kT.
Колебательная степень обладает вдвое большей энергией, потому что на нее приходится не только кинетическая энергия, но и потенциальная, причем, среднее значение кинетической и потенциальной энергии равны. Таким образом,
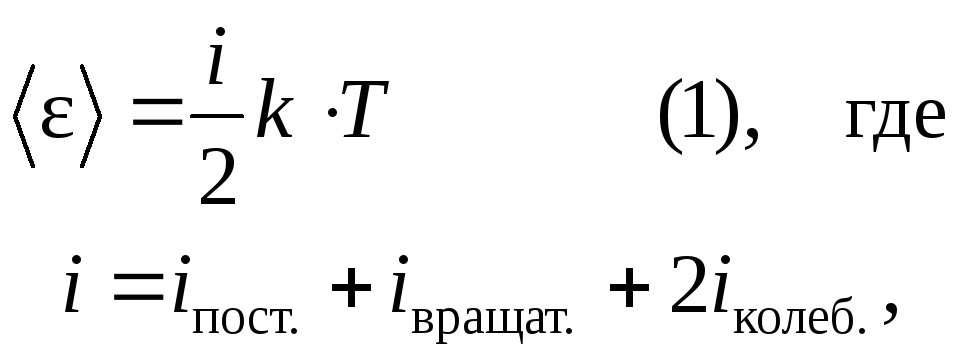
i – число степеней свободы. Т.к. потенциальная энергия равна нулю для идеального газа (молекулы между собой не взаимодействуют), то внутренняя энергия, отнесенная к 1 молю газа, будет определяться по формуле: