
- •Статистические и термодинамические методы, опытные законы идеальных газов.
- •Уравнение клапейрона-менделеева.
- •Основное уравнение молекулярно-кинетической теории газа.
- •При каждом соударении молекула, движущаяся перпендикулярно площадке, передает импульс
- •Закон максвелла о распределении молекул идеального газа по скоростям и энергиям теплового движения.
- •При возрастании скорости множитель
- •Параметрическая формула распределения больцмана.
- •Среднее число столкновений. Средняя длина свободного пробега.
- •Явление переноса в термодинамических неравновесных системах.
- •Число степеней свободы молекул. Закон равномерного распределения энергии по степеням свободы молекул.
Закон максвелла о распределении молекул идеального газа по скоростям и энергиям теплового движения.
По молекулярно-кинетической теории, как бы не изменялись скорости молекул при столкновениях, средняя кинетическая энергия, а следовательно и средняя квадратичная скорость молекул массой m в газе, находящемся в состоянии равновесия, при постоянной температуре остается неизменной и рассчитывается по формуле (7).
Это объясняется тем, что в газе, находящемся в состоянии равновесия, устанавливается некоторое стационарное, не меняющееся со временем, распределение молекул по скоростям, которое подчиняется вполне определенному статистическому закону. Этот закон был теоретически выведен Максвеллом, который предположил:
1) газ состоит из очень большого числа N тождественных молекул, находящихся в состоянии беспорядочного теплового движения при одинаковой температуре;
2) силовые поля на газ не действуют.
Закон Максвелла описывается некоторой функцией f(v), названной функцией распределения молекул по скоростям. Если разбить диапазон скоростей молекул на интервалы равные dv, то на каждый интервал скорости будет приходиться некоторое число молекул dN(v), имеющих скорость, заключенную в этом интервале. Функция f(v) определяет относительное число молекул
![]()
скорости которых лежат в интервале от v до v + dv, т.е.
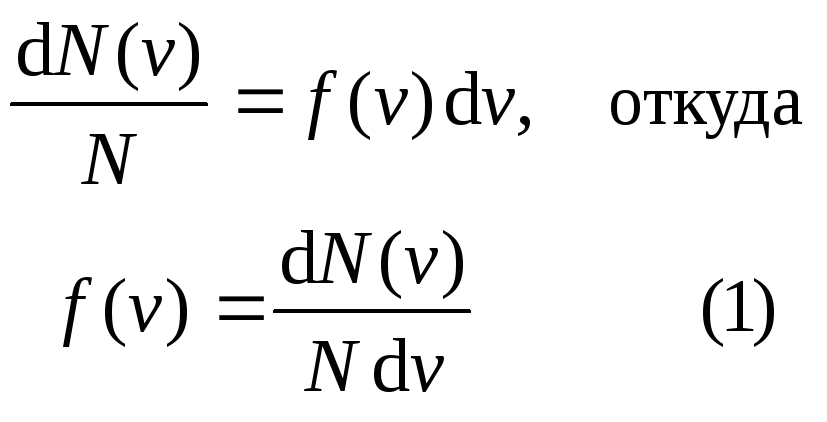
Применяя методы теории вероятности, Максвелл нашел функцию f(v) – закон распределения молекул газа по скоростям
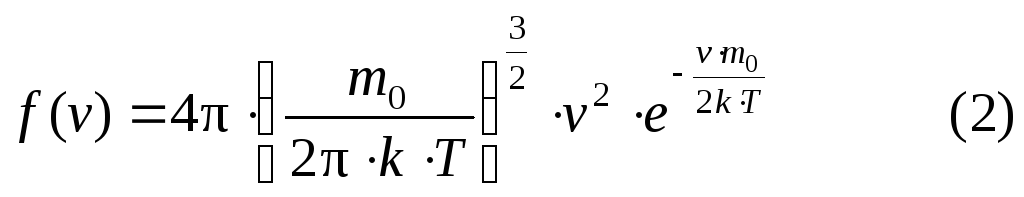
Из формулы (2) видно, что конкретный вид функции зависит от рода газа, т.е. от массы молекулы и от параметра состояния T. Приведем график функции (2):
При возрастании скорости множитель
![]()
уменьшается гораздо быстрее, чем растет множитель v2, поэтому функция f(v), начинаясь от нуля, достигает максимума при vв и затем асимптотически стремится к нулю. Относительное число молекул
![]()
скорости которых лежат в интервале от v до v + dv, находится как площадь заштрихованной полоски и равно 1. Это означает, что функция f(v) удовлетворяет условию нормировки
![]()
ОПРЕДЕЛЕНИЕ: Скорость, при которой функция распределения молекул идеального газа по скоростям максимальна, называется наиболее вероятной скоростью.
Значение наиболее вероятной скорости можно найти, продифференцировав формулу (2) по аргументу v, прировняв результат к нулю, используя условие максимума для выражения
![]()
Средняя арифметическая скорость определяется по формуле
![]()
Итак, по результатам распределения Максвелла по скоростям были получены скорости, характеризующие состояние газа:
1) наиболее вероятная;
![]()
2) среднеарифметическая;
![]()
3) среднеквадратичная.
![]()
Сравнивая формулы (1) и (2), перейдем от переменной v к m0v2 / 2:
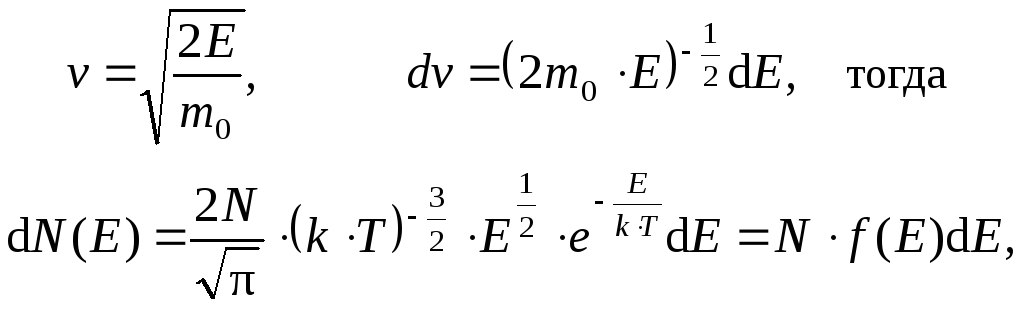
где dN(E) – это число молекул, имеющих кинетическую энергию поступательного движения, заключенную в интервале от E до E + dE. Таким образом, функция распределения молекул по энергиям теплового движения имеет вид:
![]()
Параметрическая формула распределения больцмана.
Молекулы любого газа находятся в постоянном потенциальном поле тяготения Земли. Тяготение с одной стороны и тепловое движение молекул с другой с другой, приводят к некоторому стационарному состоянию газа, при котором давление газа с высотой убывает. Пологая, что поле тяготения однородно, температура постоянна и масса всех молекул одинакова, пусть на высоте h атмосферное давление равно P, тогда на высоте h + dh оно равно P + dP. При dh больше нуля dP должно быть меньше нуля, т.к. давление с высотой убывает.
Р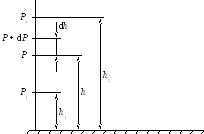 азность
давленийP
и P + dP
равна весу газа, заключенного в объеме
цилиндра высотой dh
с основанием площадью 1 м2,
тогда
азность
давленийP
и P + dP
равна весу газа, заключенного в объеме
цилиндра высотой dh
с основанием площадью 1 м2,
тогда
P – (P + dP) = gdh,
где – плотность газа на высоте h, а изменение dh настолько мало, что плотность газа можно считать постоянной, тогда
dP = –gdh (1)
Из уравнения Менделеева-Клапейрона
![]()
Подставим в формулу (1), получим

С изменением высоты от h1 до h2 давление меняется от P1 до P2, тогда
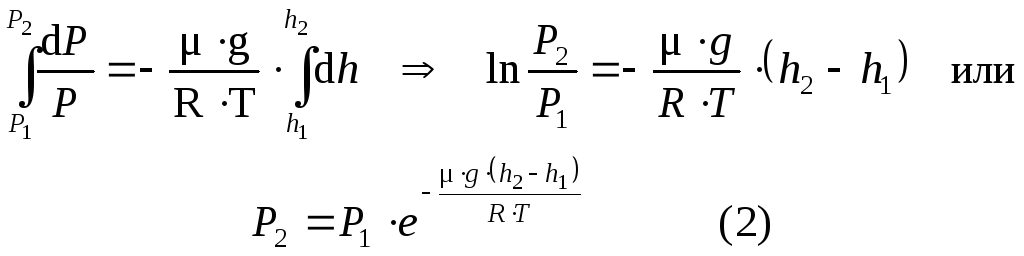
Выражение (2) определяет параметрическую формулу. Если обозначить высоту относительно уровня моря, где давление считается нормальным, тогда выражение (2) можно записать в виде
![]()
При P = nkT
![]()
где n – концентрация молекул на высоте h. Принимая во внимание, что = m0NA, R = kNA, получим
![]()
m0gh – это есть потенциальная энергия, тогда
![]()
Выражение (5) определяет распределение Больцмана для внешнего потенциального поля. Из него следует, что при постоянной температуре плотность газа больше там, где меньше потенциальная энергия его молекул. Если частицы имеют одинаковую массу и находятся в состоянии хаотического теплового движения, то распределение Больцмана справедливо в любом внешнем потенциальном поле.
