
- •Статистические и термодинамические методы, опытные законы идеальных газов.
- •Уравнение клапейрона-менделеева.
- •Основное уравнение молекулярно-кинетической теории газа.
- •При каждом соударении молекула, движущаяся перпендикулярно площадке, передает импульс
- •Закон максвелла о распределении молекул идеального газа по скоростям и энергиям теплового движения.
- •При возрастании скорости множитель
- •Параметрическая формула распределения больцмана.
- •Среднее число столкновений. Средняя длина свободного пробега.
- •Явление переноса в термодинамических неравновесных системах.
- •Число степеней свободы молекул. Закон равномерного распределения энергии по степеням свободы молекул.
Уравнение клапейрона-менделеева.
Состояние некоторой массы газа определяется тремя термодинамическими параметрами P (давление), V (объем) и T (температура). Между этими параметрами существует связь, называемая уравнением состояния, которое в общем виде имеет запись
f(P, V, T) = 0,
где каждая из переменных является функцией двух других.
Французский физик и инженер Клапейрон вывел уравнение состояния идеального газа, объединив законы Бойля-Мариотта и Гей-Люссака.
Пусть некоторая масса газа занимает объем V1, имеет давление P1 и находится при температуре T1. Эта же масса газа в другом состоянии характеризуется параметрами P2, V2, T2.

Переход из состояния 1 в состояние 2 осуществляется в виде двух процессов:
1) изотермического (изотерма 11);
2) изохорического (изохора 12).
В соответствии с законами Бойля-Мариотта и Гей-Люссака

Т.к. состояния 1 и 2 выбраны произвольно, то для данной массы газа выражение
![]()
Выражение (3) является уравнением Клапейрона, в котором B – некая газовая постоянная, различная для разных газов.
Менделеев объединил уравнение Клапейрона с законом Авогадро, отнеся уравнение (3) к одному молю, использовав при этом молярный объем. Таким образом,
![]()
R – это общая для всех газов постоянная, названная молярной газовой постоянной, или универсальной газовой постоянной.
Уравнению
PVm = RT (4)
удовлетворяет только идеальный газ. Уравнение (4) называется уравнением состояния идеального газа, или уравнением Менделеева-Клапейрона. От уравнения (4) для моля газа можно перейти к уравнению для произвольной массы газа.
Если для заданных P и T моль газа занимает молярный объем, то при тех же условиях масса газа m займет тот же объем.
![]()
Тогда получим выражение:
![]()
Выражение (5) является уравнением Клапейрона-Менделеева для произвольной массы газа. Если взять
![]()
где k – постоянная Больцмана, то получим
![]()
Давление идеального газа при данной температуре прямо пропорционально концентрации его молекул. При одинаковых температурах и давлении все газы содержут в единице объема одинаковое число молекул.
ОПРЕДЕЛЕНИЕ: Число молекул, содержащихся в 1 м3 газа, при нормальных условиях называется числом Лошмидта. Оно равно 2,681025 1/м3.
Основное уравнение молекулярно-кинетической теории газа.
Рассмотрим одноатомный идеальный газ, предположив, что молекулы движутся хаотически, число взаимных столкновений между молекулами газа пренебрежимо мало по сравнению с числом ударов о стенки сосуда, удары абсолютно упругие.
Выделим на стенке сосуда некоторую элементарную площадку S.
При каждом соударении молекула, движущаяся перпендикулярно площадке, передает импульс
m0v – (– m0v) = 2m0v,
где m0 – масса молекулы, v – ее скорость.
За время t площадки S достигнут только те молекулы, которые заключены в объеме цилиндра с основанием S и высотой vt. Число их равно nSvt, где n – концентрация молекул.
Для упрощения расчетов хаотическое движение молекул заменяют движением вдоль трех взаимно перпендикулярных направлениях так, что в любой момент времени вдоль каждого из них движется 1/3 часть всех молекул, причем половина из них движется в одну сторону, а половина – в обратную сторону. Тогда число ударов молекул, движущихся в заданном направлении и ударяющихся о площадку S, будет равно
![]()
При столкновении все они передают импульс
![]()
Тогда давление газа, оказываемое им на стенку сосуда
![]()
Если газ в объеме V содержит N молекул, которые двигаются со скоростями v1, v2, …, vn, то рассматривают среднюю квадратичную скорость
![]()
которая характеризует всю совокупность молекул газа, тогда
![]()
Выражение (3) – это основное уравнение молекулярно-кинетической теории идеальных газов. Учитывая, что n = N / V, получим
![]()
где E – суммарная кинетическая энергия всех молекул. Т.к. масса m = m0N, то можно записать
![]()
Сравним с уравнением Менделеева-Клапейрона, получим:

или, зная, что = m0NA и R = kNA, получим
![]()
Средняя кинетическая энергия поступательного движения одной молекулы идеального газа
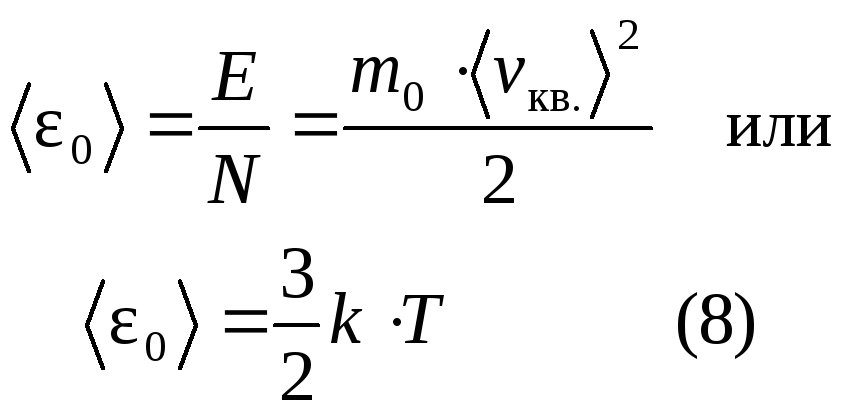
При температуре равной 0 К средняя энергия равна нулю, следовательно давление тоже равно нулю. Таким образом, термодинамическая температура является мерой средней кинетической энергии поступательного движения молекул идеального газа, и формула (8) раскрывает молекулярно-кинетическое толкование температуры.
